臨床試験の選択基準の緩和:われわれにとっての利点
基準緩和か従来通りか:後ろ向き解析結果
米国臨床腫瘍学会(ASOC)ならびに非営利団体であるFriends of Cancer Researchは2017年に、臨床試験の患者集団により現実を反映させ、そこで得た知見をより一般化できるように、選択基準を緩和する努力が必要だとする共同声明を出した[1]。選択基準を緩和すればより多くの患者が臨床試験に参加でき、データの収集も進むため、その結果、新規の治療法の登場を促すことにもつながる。
そこで、Harveyらは2011年1月から2018年12月までのリアルワールドデータを用いて後ろ向き研究を行い、選択基準を緩和した場合と従来通りの選択基準を採用した場合、進行NSCLC患者の試験参加にどのような影響を及ぼすかを調査した[2]。ASCOの傘下NPO法人、CancerLinQ Discovery (CLQD)が匿名化した電子カルテを基に、進行NSCLCの診断後に治療を受けた患者を特定した。従来の選択基準と緩和した選択基準とに分けて患者の人数と特性について調べた。
選択基準のうち、がんの既往歴と現在併発しているがん、脳転移、腎機能の3点に重点を置いて評価している。がんの既往歴がある患者、脳転移がある患者、クレアチニンクリアランスが60 mL/分以下である患者は、臨床試験に組み入れられないことが多い。緩和した選択基準の場合、肺がん以外の原発巣の診断を受けている患者だけでなく、治療の状態も臨床上の安定性も問わず脳転移のある患者、そしてクレアチニンクリアランスが30 mL/分以上の患者も組み入れられることになる。
組み入れられる患者は2倍
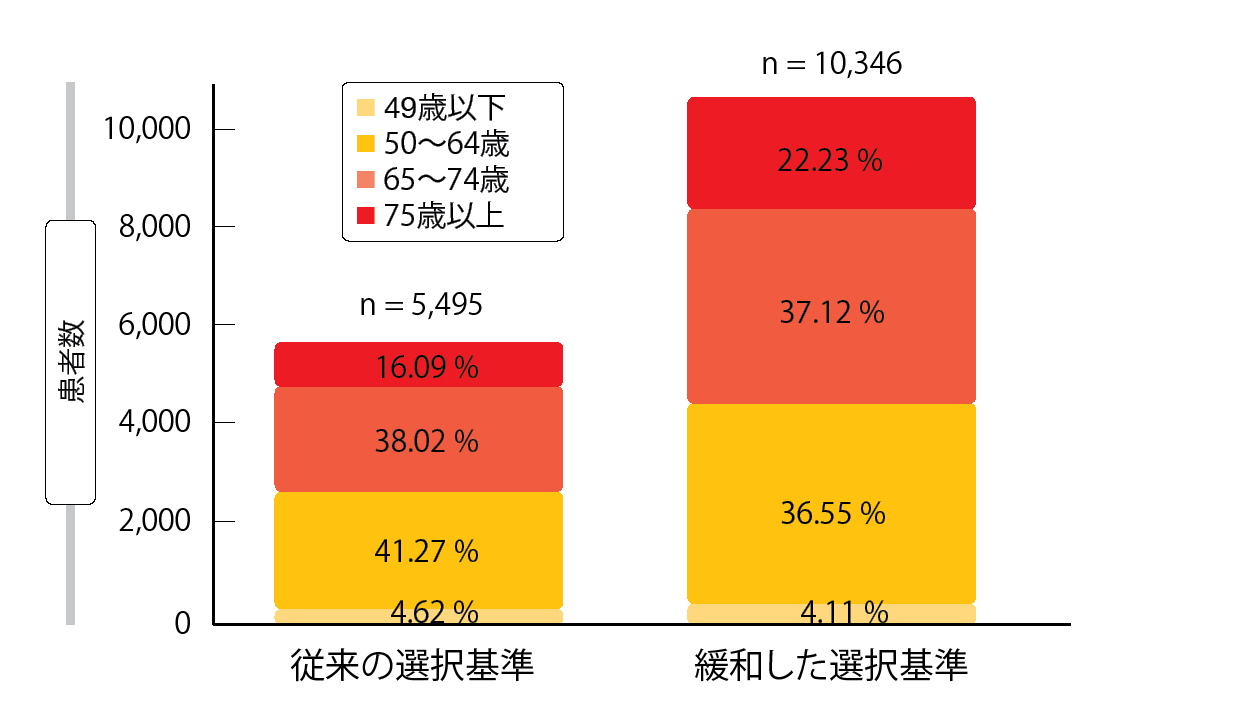
合計で10,500人の患者集団のうち、従来の選択基準を適用すると、がんの既往歴と現在併発しているがんで除外になる患者は21.5%、脳転移で除外になる患者は21.2%、クレアチニンクリアランスが60 mL/分以下で除外になる患者は14.4%になる。この場合、全体で47.7%の患者が臨床試験に参加することができなくなる。一方で、緩和した選択基準を適用すると、クレアチニンクリアランスのカットオフ値が除外基準に該当するので、実際に参加できないのは1.5%の患者に限られる。以上を受けて、従来通りの選択基準で組み入れとなった患者は5,495人、緩和した選択基準で組み入れとなった患者は10,346人になり、75歳を超える患者が占める率が後者で大幅に増えた(前者は16.09%、後者は22.23%、図)。
後ろ向き解析の結果からは、緩和した選択基準を採用すると、臨床試験の対象になり得る進行NSCLC患者の人数がほぼ2倍になることが分かった。また、この基準によって、より幅広いタイプの患者が臨床試験に参加する可能性も高まる。厳格な選択基準を採用するのであれば、説得力のある科学的根拠がある場合に限定するべきだろうと、著者らは語った。ASOCとFriends of Cancer Researchによる他の推奨事項の作成が進行中である。
図:従来通りの選択基準群と緩和した選択基準群の年齢別の患者の割合
参考文献
- Kim ES et al., Broadening eligibility criteria to make clinical trials more representative: American Society of Clinical Oncology and Friends of Cancer Research Joint Research Statement. J Clin Oncol 2017; 35(33): 3737-3744
- Harvey RD et al., Impact of broadening clinical trial eligibility criteria for advanced non-small cell lung cancer patients: real-world analysis. J Clin Oncol 37, 2019 (suppl; abstr LBA108)
More posts
小細胞肺がん:セカンドライン治療の改善
再発性小細胞肺がん(SCLC)患者への治療の選択肢は非常に限られている。プラチナ製剤感受性肺がんのセカンドライン治療に、米食品医薬品局が承認した治療薬はトポテカンだけであるが、臨床的有用性が思わしくない割には、重度の血液学的毒性を引き起こしている。 活性化した発がん性転写因子を抑制することが新薬の開発につながるかもしれない。SCLCは転写因子に依存する腫瘍であることが分かっている。Rudinらが、4種類の主な転写制御因子の発現差異別に、SCLCの遺伝子のサブタイプを分類した。
まれな遺伝子変異:治療を一歩先へ進める
NSCLC患者の3%から4%にMETエクソン14スキップ変異(METex14)を認める、という報告がある。この遺伝子変異は予後だけでなく、免疫療法といった標準治療への反応が不良になることと関係している。その上、MET遺伝子変異のある患者は高齢であることが多いため、忍容性を改善する対策が必要になる。カプマチニブは、非常に高い選択性とMET阻害作用を持つ薬剤として開発されており、MET遺伝子変異を生じさせたがん動物モデルに対してin vitroとin vivoの両方で効果を示している。
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー
血液検体を用いる診断検査というのは肺がんの診断だけでなく、遺伝子変異の予測にも利用できます。肺がんの場合は現在、患者個人のDNAにどのような変異があるかによって、細かくいくつものサブグループに分類しています。現在の技術をもってすれば、組織中の遺伝子変異はもとより血液中の遺伝子変異も検出可能です。
臨床試験の最新結果および免疫療法の新規バイオマーカー
KEYNOTE-001試験は、進行NSCLCの治療歴のない患者と治療歴のある患者に抗PD-L1抗体薬ペムブロリズマブの作用が見られた、初の臨床試験である[1]。このマルチコホート第IB相試験では、腫瘍細胞のうちPD-L1発現が陽性になる細胞の割合を表すTPSがペムブロリズマブ群で上昇し、より大きな効果が示された。2012年の5月から2014年の7月にかけて、進行NSCLC患者550人が非ランダム化比較試験の4試験と、ランダム化比較試験の2試験の患者コホートとして組み入れられた。
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だが、投与開始後8~12か月以内に耐性を獲得することは避けられず、治療がうまくいかない原因となっている。EGFR阻害薬の活性を延長させる選択肢のないところが、アンメットニーズになっている。VEGFとEGFRのシグナル伝達経路をダブルでブロックする方法が、このアンメットニーズへの解決策になる可能性がある。
早期NSCLC:期待を持てる(ネオ)アジュバント療法
切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果の高い治療法が求められている[1]。転移巣の広がりと転移後の生存にはPD-L1のupregulationが非常に重要になることを、Chenらが動物モデルを参照して示した[2]。この点を念頭に置いて、ネオアジュバント療法に免疫療法を行った場合の有効性などを、複数の臨床試験で検証している。