进一步采取抗EGFR药物治疗:多线
先前EGFR TKI疗法后的奥希替尼(osimertinib)治疗
获得性耐药通常伴随着一线EGFR TKI疗法,而门控T790M突变是最常见的机制。第三代不可逆EGFR TKI 奥希替尼已被许可用于治疗已证实其肿瘤携带这种突变的患者。Tan等人提供的回顾性数据显示出多线奥希替尼在52名患者中的活性,这52名患者在新加坡参与了早期使用项目 [1]。在先前EGFR TKI治疗期间发生进展后,从第二治疗线至第九治疗线(中位数,三线)给予奥希替尼。53 %的患者在治疗开始时具有脑转移。
独立评估的ORR为46%,中位缓解持续时间为8.7个月。完全缓解(CR)和部分缓解(PR)分别达到7.7 %和38.5 %。疾病稳定发生率为40.4 %。中位PFS为10.3个月;OS数据在分析时尚不成熟。奥希替尼显示出超过二线治疗的疗效,并且与是否存在CNS转移无关。
CNS控制相关数据
已知奥希替尼具有CNS活性,这已经由WCLC上介绍的分析所证实。Zhu等人在10名有症状性脑部病灶的患者中评估了第一代TKI疗法后奥希替尼80 mg的疗效[2]。2名患者在CNS中达到PR,7名获得疾病稳定(SD)。同样,二线奥希替尼疗法在参与开放的多国实际ASTRIS治疗研究且具有可测量基线脑转移的韩国患者中显示出显著的CNS控制[3]。在可对缓解进行评估的16名患者构成的治疗组中,颅内ORR为81.3%,并且所有患者均达到PR。中位颅内缓解持续时间尚未达到。无论放射史如何,奥希替尼均显示出临床CNS疗效。
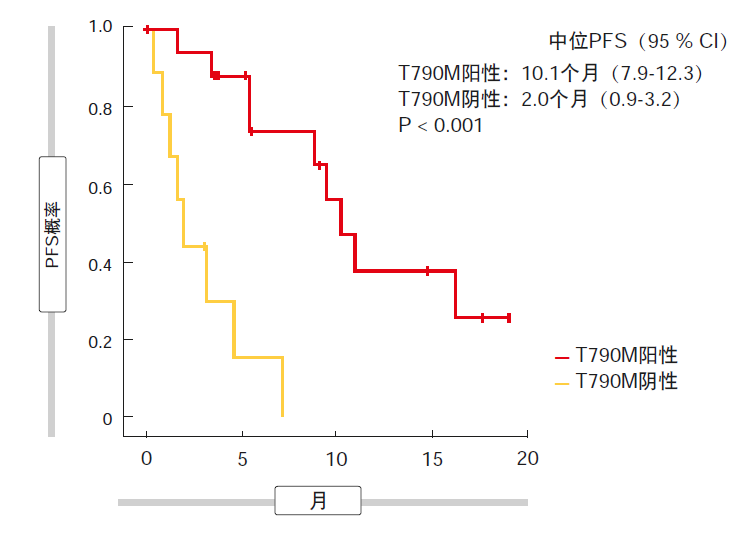
单组II期TREM试验在至少一种EGFR TKI治疗后发生进展的T790M阳性和T790M阴性患者中评估了奥希替尼的活性[4]。纳入了34名脑转移患者。结果表明,奥希替尼在CNS疾病患者中的疗效与在无CNS疾病患者中相似,而T790M阴性患者的获益似乎显著更低。总体而言,75 %的患者出现疾病控制,但这一比例在T790M阳性队列中明显高于T790M阴性组(88 %与38 %)。这两个队列中的PFS分别为10.1个月和2.0个月(P<0.001;图1),
而脑转移患者与无脑转移患者之间没有显著的PFS差异(7.2个月与9.7个月;P = 0.300)。
图1: 脑转移患者中的奥希替尼:根据T790M突变状态的无进展生存期
阿法替尼治疗后T790M突变的发生率
在对厄洛替尼和吉非替尼一线治疗产生获得性耐药的患者中,T790M突变显示出49 %至69 %的发生率[5-7]。然而,缺乏阿法替尼耐药机制的相关数据,尤其是在高加索患者中。现有证据表明,T790M突变的发生也是阿法替尼耐药的主要机制,其发生率为48 %至68 % [7, 8]。
在其单中心回顾性分析中,Hochmair等人评估了在阿法替尼治疗期间发生进展的患者中EGFR T790M突变的发生率,以及该组患者对奥希替尼的应答[9]。在AURA3研究中,奥希替尼在第一代或第二代EGFR TKI疗法失败后作为二线治疗显示出有利结果,但是仅7%入组该试验的患者曾接受过一线阿法替尼[10]。同时,在处方出具先阿法替尼随后奥希替尼用药顺序的患者中,新出现的数据显示出有利的临床结果。根据对LUX-Lung 3、6和7试验的回顾性分析,阿法替尼治疗失败后奥希替尼治疗的中位持续时间为20.2个月,并且中位OS尚未达到[11]。
一致的突变率与优异的缓解
该分析纳入了48名在采用阿法替尼治疗初始达到≥ 3个月的疾病控制后发生进展的患者。在75 %的患者中,阿法替尼用于一线治疗条件,而19 %和6 %的患者分别接受TKI作为二线或三线药物。测试显示,56 %(n = 27)的患者发生了EGFR T790M突变,这与可从先前分析获得的发生率[7, 8],以及厄洛替尼或吉非替尼治疗期间发展的患者中的T790M突变率一致[5-7]。
在34名患者中进行额外的组织重新活检,以确认液体活检结果,得到两次测试之间的一致率为91 %。T790M突变的出现似乎与基线特征或诸如对阿法替尼的缓解持续时间等其他参数不相关。对于在二线或三线接受阿法替尼治疗的患者,T790M突变何时出现尚不清楚,因为测试仅在阿法替尼治疗失败后进行。
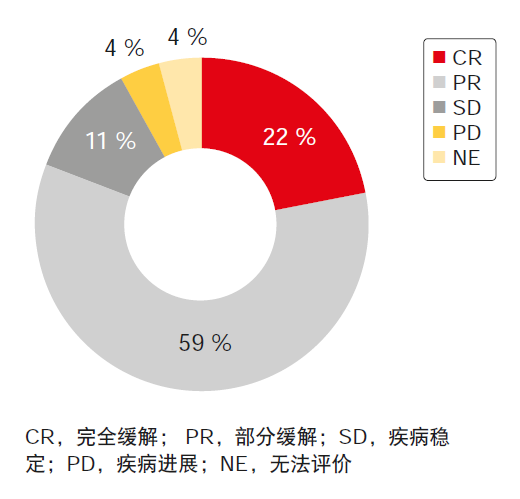
在发生T790M突变的27名患者中,采用奥希替尼治疗得到高达81%的ORR,其中22%的患者达到CR(图2)。在分析时对奥希替尼的应答持续时间相关数据尚不成熟。11名(41%)患者正在进行奥希替尼治疗。采用阿法替尼和奥希替尼序贯治疗的中位时间为25.0个月。
图2: 采用阿法替尼治疗初始达到≥ 3个月的疾病控制后发生T790M突变的患者对奥希替尼的应答
对奥希替尼的耐药机制
基于III期FLAURA试验,奥希替尼是用于转移性EGFR突变阳性NSCLC一线治疗的新兴治疗标准[12]。然而,对奥希替尼的获得性耐药代表了一种挑战,甚至形势更为严峻,因为迄今为止其尚未得到系统地表征。了解对第三代EGFR TKI的耐药机制对于未来开发新一代EGFR TKI以及药物联合使用而言至关重要。
因此,Puri等人回顾性分析了51名转移性NSCLC和T790M突变患者的基因组谱,以鉴定对奥希替尼耐药的潜在机制[13]。在51名患者中,35名曾接受过奥希替尼治疗;如所预期的,这些患者显示出OS显著长于未接受过奥希替尼的16名患者构成的治疗组(25.8个月与4.34个月;p = 0.019)。根据对奥希替尼治疗期间产生疾病进展的10名患者的基因组谱分析,诸如C797S或C797G突变、EGFR T790M丢失和EGFR扩增等EGFR依赖性机制最为常见(80%)。此外,EGFR非依赖性机制发生率为60%。这些包括HER2和MET扩增、辅助途径(例如,MAPK/ERK途径)激活,以及其他机制(例如,RET NCOA4融合、MYC扩增)。每名患者在基因组测试时均显示出多种耐药机制。
T790M丢失并不表示重新致敏
Oxnard等人也侧重描述对奥希替尼的耐药机制[14]。科学家们出于验证目的使用来自AURA试验的血浆对患者进行肿瘤和血浆基因型分型,这些患者在对先前EGFR TKI治疗产生获得性耐药后接受单药奥希替尼治疗T790M阳性NSCLC。在奥希替尼治疗期间发生进展的33名患者中,11名保留T790M,22名丢失T790M。仅在保留T790M突变的患者中检测到被视作奥希替尼耐药性肿瘤特征的EGFR C797S突变。在丢失T790M的患者中,出现了竞争性耐药机制,包括组织学转化成SCLC、MET扩增或PIK3CA突变。T790M丢失的患者显示出对奥希替尼的早期耐药性;其中,至治疗失败的中位时间为6.9个月。相比之下,之后在治疗过程中经常观察到由于C797S突变引起的耐药性。同时,从基线血浆基因型分型中难以预测T790M突变丢失。T790M丢失患者的相对T790M等位基因分数仅略低于保留T790M的患者。
作者得出结论认为,T790M丢失并不表示对第一代EGFR TKI治疗的重新致敏,但通常意味着竞争性耐药突变的过度生长。需要留意的罕见遗传耐药机制的范围包括KRAS突变、RET融合和EGFR融合。在进展时重新测试T790M可能有助于阐明耐药性生物学。作者建议,在早期耐药的情况下考虑奥希替尼联合替代途径抑制剂
(例如,MET抑制剂)的试验;对于具有后期耐药性的患者,由于可能怀疑保留EGFR依赖的耐药性,对奥希替尼加额外EGFR抑制剂进行研究可能是合适的。
参考文献
- Tan WL et al., Clinical outcomes of patients with EGFR T790M+ NSCLC on osimertinib. WCLC 2017, P3.01-017
- Zhu L et al., The feasibility of osimertinib treatment on brain metastases in NSCLC patients after 1st generation EGFR-TKI resistance: a preliminary study. WCLC 2017, P1.01-046
- Kim JH et al., Efficacy of osimertinib for CNS metastases in advanced NSCLC: data from a Korea single center in ASTRIS, a real world treatment study. WCLC 2017, P3.01-028
- Zwicky Eide IJ et al., Osimertinib in relapsed EGFR-mutated non-small cell lung cancer patients with brain metastases: results from the TREM-Study. WCLC 2017, P2.03-035
- Yu HA et al., Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013; 19: 2240-2247
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3: 75ra26
- Yang JC-H et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017; 35: 1288-1296
- Wu SG et al., The mechanism of acquired resistance to irreversible EGFR tyrosine kinase inhibitor-afatinib in lung adenocarcinoma patients. Oncotarget 2016; 7: 12404-12413
- Hochmair MJ et al., Prevalence of EGFR T790M mutation in NSCLC patients after afatinib failure, and subsequent response to osimertinib. WCLC 2017, P2.03-025
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376: 629-640
- Sequist LV et al., Subsequent therapies post-afatinib among patients with EGFR mutation-positive NSCLC in LUX-Lung (LL) 3, 6 and 7. ESMO 2017 Congress, abstract 1349P
- Ramalingam SS et al., Osimertinib vs. standard-of-care EGFR-TKI as first-line treatment in patients with EGFRm advanced NSCLC: FLAURA. ESMO 2017 Congress, abstract LBA2_PR
- Puri S et al., Genomic profiling of EGFR T790M mutated non-small cell lung cancer to evaluate the mechanisms of resistance to osimertinib. WCLC 2017, MA 12.05
- Oxnard GR et al., Osimertinib resistance mediated by loss of EGFR T790M is associated with early resistance and competing resistance mechanisms. WCLC 2017, OA 09.02
More posts
化疗:新方法、新治疗条件
现有指南推荐,在有淋巴结受累的完全切除NSCLC患者(II-IIIA期)中进行术后铂类化疗[1]。然而,生存结果仍然有限,且依从性低于其他肿瘤的辅助疗法。不同化疗方案之间并无直接比较。对参与DNA修复的基因表达进行的分析可用于使最佳化疗药物和时间表的选择个体化。
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据
恶性胸膜间皮瘤(MPM)是一种侵袭性肿瘤,如果不进行治疗,则中位生存期为7-9个月[1]。不可切除MPM患者的前线标准治疗包括使用顺铂(cisplatin)和培美曲塞的联合双重疗法,该疗法产生约1年的中位OS。
以靶向方式治疗鳞状细胞癌
在具有鳞状细胞癌(SCC)组织学亚型的NSCLC患者中不对EGFR突变状态进行常规检查,这是由于EGFR突变在这些肿瘤患者中的发生率较低并且对第一代EGFR TKI治疗的临床应答较差。
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息
复发性小细胞肺癌(SCLC)患者仅具有有限的治疗选择。CheckMate 032试验在接受过至少一种先前铂类化疗方案的SCLC患者的PD-L1未选择队列中评估了伴或不伴抗CTLA-4抗体易普利姆玛(ipilimumab)的抗PD-1抗体纳武单抗(nivolumab)。
进一步采取抗EGFR药物治疗:多线
获得性耐药通常伴随着一线EGFR TKI疗法,而门控T790M突变是最常见的机制。第三代不可逆EGFR TKI 奥希替尼已被许可用于治疗已证实其肿瘤携带这种突变的患者。Tan等人提供的回顾性数据显示出多线奥希替尼在52名患者中的活性,这52名患者在新加坡参与了早期使用项目。
“我们正朝着更好地控制肺癌稳步迈进”
在某种意义上,协作是多学科团队合作的另一种表述,但多学科这一术语并不一定局限于医生。它还包括护理人员和其他人员,诸如包括康复团队和患者权利倡导者在内的维持治疗队伍。同时,这一概念的本质为在整体治疗计划中,以患者为中心。团队成员合作,为患者提供最优异、最先进的治疗。