EGFR 突变及其它突变背景下的液体活检
与组织活检和重新活检相比,液体活检具有多个优势,包括最小侵入性, 随时间推移进行连续测量以监测肿瘤反应的机会,以及在影像学检测前检测血浆中的耐药突变[1]。治疗失败的重要因素——肿瘤异质性问题也得到考虑。驱动突变可以得到高灵敏、高特异地鉴定,从而改善个性化药物的递送。虽然标准化、不同技术验证以及与组织分子分布结果一致性等有争议问题仍然存在,但液体活检已经成为管理晚期 NSCLC 患者的一种替代工具。
血浆和组织之间的高一致率
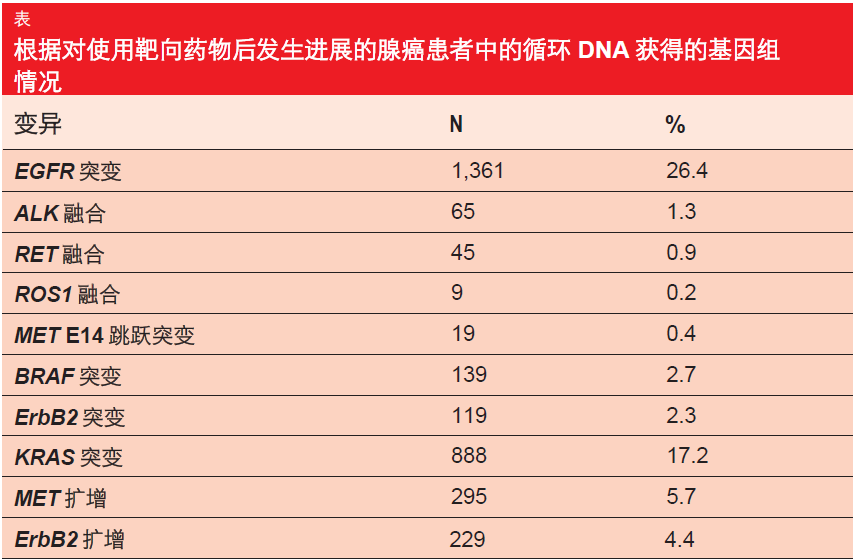
在 WCLC 上提出的将液体活检确认为新兴标准的几个分析中,其中一个由M a c k 等人提 出,他 们 评估了Guardant360 组的群体规模基因组学 (与癌症基因组图谱相比)、临床准确度和临床效用[2]。Guardant360 检测允许基于循环 肿瘤 D N A (ctDNA)针对 73 种基因中的关键外 显子进行数字测序。该队列包括 8,388 名 III/ IV 期腺癌(n = 4,142)或NSCLC-NOS(n = 4,246)患者,共采集了 9,202 个样品。在初始诊断和 ctDNA 收集之间间隔 177 天的中位时间跨度。在一个患者子集中能够获取组织信息。应当注意,这并非随机患者截面,因为该分析富集了使用靶向 药物后发生进展的患者。他们通常正在接受二线或后线治疗。
变异的总检测率为 87 %,中位数为每一样品 3 个变异( 范围, 0-93)。在血浆中检测到的突变与组织中报告的突变具有类似的频率和分布,这也适用于所有谱系的肿瘤中存在的截断突变。根据 Guardant360,ctDNA 融合模式反映了肿瘤组织。在腺癌患者中,26.4 %的病例中发现了EGFR 突变(表)。外显子 19 缺失占 EGFR 驱动突变的多数(52 %),其次是 L858R 突变(34 %)和外显子 20 插入(4 %)。
已知驱动突变的相互排斥达到了统计学上高度显著的程度。例如,当 存在 EGFR 突变时,不存在 KRAS 突变,并且反之亦然。重叠的情况可能是由于继发耐药突变的出现。
生物标志物产率增加 65 %
在一组由 543 个标志物阳性病例组成的可获取组织信息的子集中确定了临床准确度。这里,根据突变类型,阳性预测值范围在 92 %和 100 %之间。所有具有 KRAS 、BRAFV600E 和 MET E14 跳跃突变阳性血浆样品的患者在其肿瘤组织中也存在这些突变。对于 ALK、RET 和 ROS1 融合,92 %的患者没有显示出阳性组织结果;这些很可能是假阴性。40 %的 ALK 融合病例和 50 %的 EGFR 阳性病例在进展时具有一个潜在可操作的耐药靶点。总之,血浆分析提供了额外益处,因为 ctDNA 新一代测序令生物标志物产率增加达 65 %。这对应于 252 个额外的 可操作生物标志物。在 29 %的基因型不明或组织不可评估的病例中检测到致癌驱动因素。
Santos 等人还使用 Guardant360 检测在 100 例连续 IV 期或复发性腺癌患者中进行了液体活检评估[3]。为了与受试者的液体活检结果进行比较, 从每个受试者处获得或回收组织分子分布结果。研究人员发现,两种方法之间关于畸变类型一致性最高的是 EGFR 突变(68 %)。即使循环 DNA 检测在肿瘤组织检测后数月甚至数年进行,情况仍是如此。在诊断或肿瘤活检时没有进行液体活检。
液体活检的异常识别率高于组织检测。根据液体活检,46 %的 EGFR 畸变患者具有可操作突变。 35 名 EGFR 变异患者中有 16 名具有仅由液体活检确定的突变或变异;在这 16 名 病例中有 5 名完全通过使用液体活检确定了可操作 EGFR 突变体。
T790M 突变检测
在 TIGER-X I/II 期试验中,进行并分析了尿液和血浆的组合 EGFR 突变检测[4]。TIGER-X 招募了 548 名已接受过 EGFR 导向 TKI 治疗的具有激活 EGFR 突变的患者。他们接受了不再处 于 临 床 开 发 的 EGFR TKI rociletinib 。在这项试验中, 提交了 540 个组织样品、482 个血浆样品和 213 个尿液样品用于治疗前 EGFR 检测。该分析包含 174 个匹配组织、血浆和尿液样品。
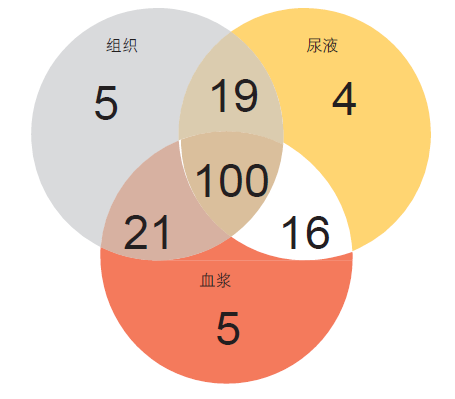
已经证实非侵入性尿液和血浆 T790M 检测具有高灵敏度。对于血浆和尿液检测而言,灵敏度超过 80 %。组合检测甚至出现更高的比率,其灵敏度达到 96.6 %。对于 174 个匹配的 组织、血浆和尿液样本而言,任何一个样本类 型的 T790M 阳 性率为 97.7 %。组合尿液和血浆检测比单独 组织检测确定了更多的 T790M 阳性病例(图)。不管 T790M 突变是通过液体活检或是组织活检检测到的,采用 rociletinib 观察到的反应率相似。
此外,分析显示,在具有胸外病灶(M1b)患者的血浆中比在只有胸内(M1a/M0)疾病患者的血浆中更容易检测到 T790M 突变。然而,不论疾病状态如何,组合尿液和血浆检测均高度灵敏。在 M1a/M0 和 M1b 疾病患者中的灵敏度分别为 90.7 % 和 % 。作者得出结论认为,在EGFR-TKI 耐药性 NSCLC 患者中, 包括具有胸外转移的患者,尿液和血浆的组合分析应先于组织检测予以考虑。
图:组合使用尿液和血浆检测提高T790M检测率(170个T790M阳性病例)
参考文献
- Burrell RA & Swanton C, Tumour heterogeneity and the evolution of polyclonal drug resistance. Mol Oncol 2014; 8(6): 1095-1111
- Mack PC et al., Clinical utility of circulating tumor DNA (ctDNA) analysis by digital next generation sequencing of over 5,000 advanced NSCLC patients. WCLC 2016, OA06.01
- Santos ES et al., Report on liquid biopsies from advanced lung adenocarcinoma patients and correlation with their tumor biopsy profiles. WCLC 2016, OA10.07
- Wakelee HA et al., A highly sensitive nextgeneration sequencing platform for detection of NSCLC EGFR T790M mutation in urine and plasma. WCLC 2016, MA08.01
More posts
改变实践的肺癌分期细分完善
第 8 版 TNM 分类已于近期开始实施。与 2009 年发布的第七版 相比, 对肺癌分期做出了几项重要调整,目的在于改善预测和研究。来自西班牙巴塞罗那塔拉萨 Mútua Terrassa 大学医院胸外科的医学博士 Ramón Rami-Porta 认为,“研究对于可用各种治疗选择进行治疗的小型肿瘤而言尤为重要”。新版本以大量患者为基础,为其稳健性提供了支持。
采用尼达尼布(nintedanib)抗血管生成:在间皮瘤中的活性和潜在生物标志物
恶性胸膜间皮瘤通常具有不良的患者预后, 因为其往往在确诊时已属晚期。唯一获批的治疗方案由培美曲塞和顺铂的组合构成,其产生约为 1 年的中位 OS 。随机化、双盲、安慰剂对照、II 期 LUME-Meso 试验测试了口服多激酶抑制剂尼达尼布用于间皮瘤的治疗。尼达尼布以 VEGF1-3、FGFR1-3 和 PDGFRα/β 以 及 Src 和 Abl 激酶介导的促血管生成通路为靶标; 这些都参与间皮瘤的发病机理 。
哪类人群适合免疫疗法?
当我们考虑对于 NSCLC 的免疫疗法时应该认识到,大约有 20%的经治疗患者出现反应。为了使治疗针对于更有可能获得反应的患者,生物标志物可能颇有价值。根据免疫组织化学, 在临床实践中确立的一种生物标志物 是肿瘤上的 PD-L1 表达。目前,存在不同的方法来评估 PD-L1 表达,但它们看起来在慢慢合并;因此,或许我们终将基于免疫组织化学而拥有一种相当可靠的读出方法。
免疫疗法:新型抗 PD-L1 抗体与各种组合方案
与抗 PD-1 抗体相比,针对 PD-L1 的抗体的优点在于它们在不影响 PD- 1/PD-L2 通路的同时可以抑制 PD-1/PD-L1 相互作用,从而潜在地维持外周免疫平衡。OAK 是首个在晚期 NSCLC 中评估抗 PD-L1 药物的随机化 III 期试验。患有局部晚期或转移性 NSCLC 的患者接受每 3 周一次 1200 mg atezolizumab 或多西他赛治疗。在试验之前,他们已接受过一线或两线化疗,包括至少一种铂基方案治疗。
EGFR 突变及其它突变背景下的液体活检
与组织活检和重新活检相比,液体活检具有多个优势,包括最小侵入性, 随时间推移进行连续测量以监测肿瘤反应的机会,以及在影像学检测前检测血浆中的耐药突变[1]。治疗失败的重要因素——肿瘤异质性问题也得到考虑。驱动突变可以得到高灵敏、高特异地鉴定,从而改善个性化药物的递送。虽然标准化、不同技术验证以及与组织分子分布结果一致性等有争议问题仍然存在,但液体活检已经成为管理晚期 NSCLC 患者的一种替代工具。
ALK 阳性NSCLC 的新兴治疗:全新选择与挑战并存
使用 ALK 酪氨酸激酶抑制剂(TKI) 克唑替尼(crizotinib)的治疗已被确立为具有 ALK 重排晚期 NSCLC 患者的标准一线选择。在克唑替尼出现前,先用铂-培美曲塞双药治疗,随后采用培美曲塞维持是非鳞状 NSCLC 的护理标准。然而,在对克唑替尼产生初始反应后,由于多种机制而总是会出现获得性耐药,这些机制中可能包括 ALK 酪氨酸激酶结构域中的继发突变。