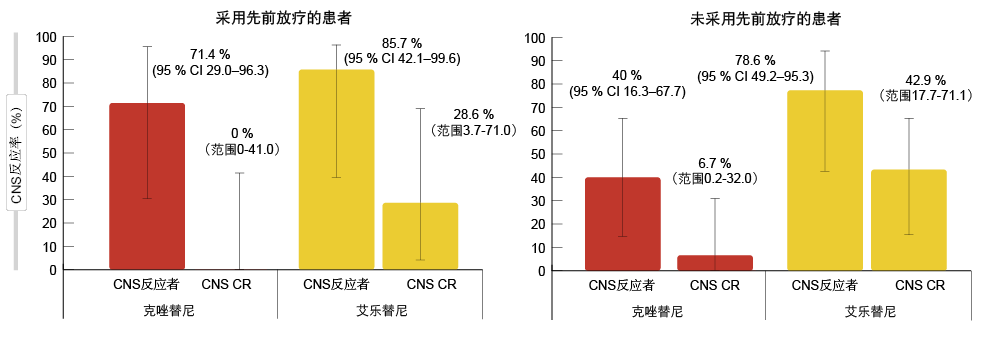ALK阳性NSCLC:克唑替尼和艾乐替尼的更新数据
PROFILE 1014是用以确定ALK抑制剂克唑替尼在ALK阳性肺癌患者一线治疗中作用的首个研究。其在一线环境下,在ALK阳性局部晚期复发或转移性非鳞状NSCLC患者中比较了每日两次250 mg克唑替尼(n = 172)与培美曲塞加顺铂(n = 171)。达到主要疗效终点(即克唑替尼相比化疗在PFS方面的优势),并且HR值为0.454(克唑替尼与化疗的中位PFS分别为10.9个月与7.0个月;p < 0.0001)[1]。采用克唑替尼的ORR显著高于化疗(74%与45%;p < 0.001)。当时,在数据截止时两组均未达到中位OS。
PROFILE 1014中的长期OS优势
在两组约46个月的中位随访期之后,Mok等人介绍了更新的OS和安全性分析[2]。根据这些数据,克唑替尼相比化疗将死亡风险降低了24%(HR,0.76),尽管这一差异不具有统计显著性(p = 0.0978)。克唑替尼尚未达到中位OS,并具有45.8个月的较低边际,这与化疗所获得的47.5个月的中位OS相似。四年OS率为56.6%与49.1%。这是迄今为止任何TKI疗法在IV期NSCLC患者中所得到的最高4年生存率之一。
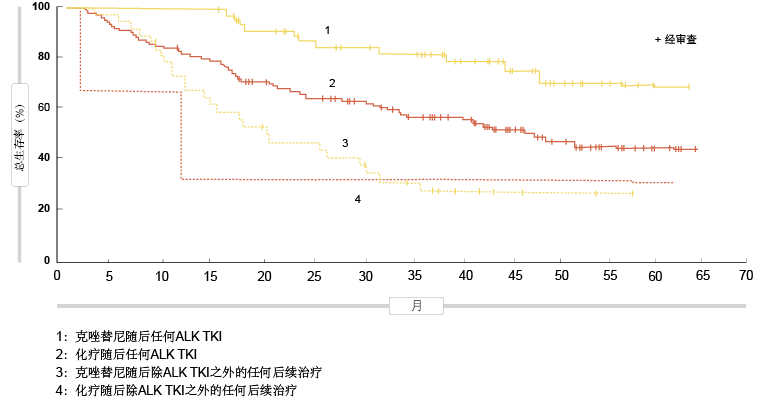
由于在PROFILE 1014中允许交叉,因此被随机分配到化疗组并接受后续克唑替尼TKI治疗的患者比例相当大。使用针对交叉调整的秩保持结构失效时间模型(RPSFTM),据估计如果未进行交叉,OS的HR将为0.346(中位OS,59.8个月与19.2个月)。关于后续治疗的影响,结果显示,接受克唑替尼随后接受另一ALK TKI治疗的患者具有最长的OS,而被随机分配到化疗随后未接受ALK TKI或其他治疗的患者表现最差(图1)。采用长期克唑替尼治疗未显示意料不到的毒性。
图1: 各种治疗顺序对总生存率的影响
ALEX:一对一比较
然而,由于采用第一代ALK抑制剂克唑替尼进行治疗的患者发生进展不可避免,因此可以使用进一步的靶向选项。第二代ALK抑制剂艾乐替尼已在两项关键的II期试验中显示出对先前采用克唑替尼进行治疗患者的全身和CNS疗效[3, 4]。基于这些研究,艾乐替尼被批准用于治疗对克唑替尼发生进展或不耐受的ALK阳性NSCLC患者。
在一线环境下,在ALEX试验中比较艾乐替尼与克唑替尼,研究这两种药物在ALK阳性IIIB / IV期NSCLC患者中的全身和CNS疗效。总体而言,303名患者参加了ALEX,其中152名和151名患者分别接受每日两次600 mg艾乐替尼和每日两次250 mg克唑替尼。达到ALEX研究的主要终点:与克唑替尼相比,艾乐替尼显著改善PFS(未达到与11.1个月;HR,0.47;p < 0.001)[5]。
CNS是ALK阳性NSCLC患者转移和疾病进展的常见部位。多达30 %的患者在初始诊断时就已经具有CNS病灶[6],而在多达50 %接受克唑替尼的患者中,CNS是发生进展的首个部位[7,8]。无症状脑转移患者允许纳入ALEX试验中,而无论其是否被给予治疗。所有患者在进入研究前和此后每8周均进行脑成像。在2017年ESMO大会上,Gadgeel等人介绍了在约18个月的中位随访期之后ALEX试验的CNS疗效结果[9]。
跨越多个CNS终点的活性
在总研究群体中,122名个体在基线时患有CNS疾病。这里,64名被随机分配至接受艾乐替尼,58名被随机分配至接受克唑替尼。各组中约60 %在进入研究前未接受过任何脑转移治疗。与克唑替尼相比,艾乐替尼在具有
(未达到与7.4个月;HR,0.40;p < 0.0001)和不具有(未达到与14.8个月;HR,0.51;p = 0.0024)基线CNS转移的患者中均显著改善PFS。还在具有基线CNS转移的患者中通过先前放疗对PFS进行了评估。无论是否给予放疗,艾乐替尼均引起显著的PFS延长(HR分别为0.34和0.44)。
在基线时具有和不具有CNS转移的患者中,与采用克唑替尼相比,采用艾乐替尼在第一次进展时发生CNS进展的频率较低。这也适用于具有基线病灶的患者,并且与先前放疗无关。ALEX试验的关键次要终点是发生CNS进展的时间。基于竞争风险分析,其显示艾乐替尼显著延迟在基线时具有(采用艾乐替尼和克唑替尼在12个月时累积发生率分别为16.0%与58.3%;病因特异性HR,0.18; p < 0.0001)和不具有(12个月时累积发生率分别为4.6%与31.5%;病因特异性HR,0.14; p < 0.0001)CNS转移患者的CNS进展。这表明,艾乐替尼对CNS进展的发生具有预防作用。此外,就CNS进展累积发生率而言,采用和未采用先前放疗的患者均可从艾乐替尼治疗中获益(HR分别为0.11和0.22)。
颅内反应方面的优势
在采用和未采用先前放射且在基线时具有可测量CNS疾病的患者中分别评估根据RECIST得到的CNS反应。在接受过放疗的患者中,艾乐替尼的CNS ORR为85.7%,CNS的完全缓解发生率为28.6%(图2)。对于克唑替尼,这些比率分别为71.4%和0%。未采用先前放射的患者显示出对于艾乐替尼的CNS总体反应率和完全反应率分别为78.6%和42.9%,对于克唑替尼则分别为40.4%和6.7%。在采用和未采用先前放射的患者中,采用艾乐替尼获得的反应持续时间也超过了采用克唑替尼所观察到的相应结果。
在基线时患有可测量和不可测量CNS疾病患者的CNS反应产生相似的结果。未采用先前放疗的群组表现最好;这里,CNS总体反应率和完全缓解率分别为74.4%和61.5%。对于克唑替尼,这些百分比分别为24.3%和10.8%。此外,在采用和未采用先前放疗的患者中,艾乐替尼在反应持续时间方面表现更好。
在ALEX试验中,还通过使用RANO标准来评估疗效。分析显示,根据RECIST和RANO标准生成的数据是一致的。根据RANO标准,采用艾乐替尼在12个月时CNS进展的累积发生率相比于克唑替尼显著降低(8.0%与2.2%;病因特异性HR,0.18;p < 0.0001)。这些发现连同全身结果一起强化了以艾乐替尼作为先前未经治疗的晚期ALK阳性NSCLC患者的治疗新标准。
图2: ALEX试验中患有可测量CNS疾病患者的CNS反应:采用(左)和未采用(右)先前放射的患者
ALUR:艾乐替尼与化疗
直到最近,仍没有研究在克唑替尼治疗失败的ALK阳性NSCLC患者中对艾乐替尼与标准化疗进行直接比较。随机化III期ALUR试验填补了这一空白。该研究招募的患者曾接受过克唑替尼和一种线的铂类化疗。根据研究人员的选择,患者被随机分配为接受每日两次600 mg艾乐替尼(n = 72)或者采用培美曲塞或多西他赛进行化疗(n = 35)。
根据研究人员评估,达到主要终点,即ITT群体中的PFS,并且HR为0.15 [10]。中位PFS为9.6个月与1.4个月(p < 0.001)。所有亚组从艾乐替尼治疗中的PFS获益明显优于化疗。类似地,根据独立审查委员会(IRC)的分析显示出艾乐替尼的明显优势,中位PFS为7.1个月与1.6个月(HR,0.32;p < 0.001)。对于总体反应率的差异观察到相似的效应程度;由研究人员评估的该数值分别为37.5%与2.9%,由IRC评估的该数值分别为36.1%与11.4%。根据研究人员评估,获得的疾病控制率为80.6%与28.6%,反应持续时间为9.3个月与2.7个月。
CNS反应仅限于艾乐替尼组
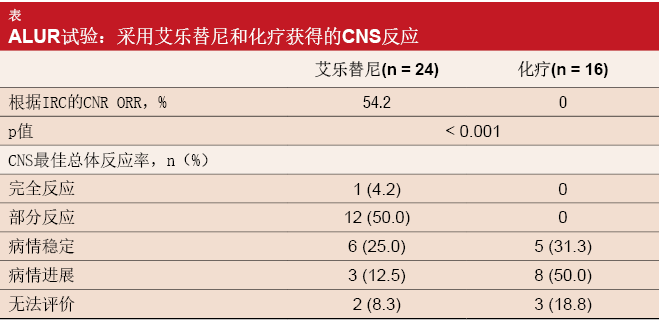
在ALUR中,各组中约70 %的患者在进入研究时具有CNS转移。由IRC评估的具有可测量CNS病灶患者在基线时的CNS总体反应率被定义为该试验的关键次要终点。艾乐替尼就这一结果提供了显著获益,因为54.2%的实验组患者对治疗产生反应(表)。1名患者出现CR,12名患者出现PR。相比之下,对照组包含的所有患者均未经历任何CNS缓解(p < 0.001)。
采用艾乐替尼的治疗中位时间比采用化疗多3倍(分别为20周与6周)。尽管接受更长时间的治疗,但采用艾乐替尼的所有等级AE发生频率比采用化疗更低(77.1%与85.3%)。这也适用于3-5级AE(27.1%与41.2%)。此外,在导致治疗中止的AE(5.7%与8.8%)和导致剂量减少的AE(4.3%与11.8%)方面,艾乐替尼治疗显示出优势。总体而言,ALUR试验结果进一步证实了先前所证明的艾乐替尼对ALK阳性晚期或转移性NSCLC患者的益处。
参考文献
- Solomon BJ et al., First-line crizotinib versus chemotherapy in ALK-positive lung cancer. N Engl J Med 2014; 371: 2167-2177
- Mok TS et al., Overall survival (OS) for first-line crizotinib versus chemotherapy in ALK+ lung cancer: updated results from PROFILE 1014 ESMO 2017, abstract LBA50
- Ou et al., Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer: a phase II global study. J Clin Oncol 2016; 34(7): 661-668
- Shaw A et al., Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial. Lancet Oncol 2016; 17(2): 234-242
- Peters S et al., Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer. N Engl J Med 2017; 377(9): 829-838
- Johung KL et al., Extended survival and prognostic factors for patients with ALK-rearranged non-small-cell lung cancer and brain metastasis. J Clin Oncol 2015; 34(2): 123-129
- Weickhardt AJ et al., Local ablative therapy of oligoprogressive disease prolongs disease control by tyrosine kinase inhibitors in oncogene-addicted non-small-cell lung cancer. J Thorac Oncol 2012; 7(12): 1807-1814
- Yoshida et al., Clinical impact of crizotinib on central nervous system progression in ALK-positive non-small lung cancer. Lung Cancer 2016; 97:43-47
- Gadgeel S et al., Alectinib vs. crizotinib in treatment-naïve ALK+ NSCLC: CNS efficacy results from the ALEX study. ESMO 2017, abstract 12980_PR
- Novello S et al., Primary results from the phase III ALUR study of alectinib versus chemotherapy in previously treated ALK+ non-small-cell lung cancer (NSCLC). ESMO 2017, abstract 12990_PR
More posts
ALK阳性NSCLC:克唑替尼和艾乐替尼的更新数据
PROFILE 1014是用以确定ALK抑制剂克唑替尼在ALK阳性肺癌患者一线治疗中作用的首个研究。其在一线环境下,在ALK阳性局部晚期复发或转移性非鳞状NSCLC患者中比较了每日两次250 mg克唑替尼(n = 172)与培美曲塞加顺铂(n = 171)。达到主要疗效终点(即克唑替尼相比化疗在PFS方面的优势),并且HR值为0.454(克唑替尼与化疗的中位PFS分别为10.9个月与7.0个月;p
转化导致SCLC的特征和结果
在获得对EGFR TKI疗法的耐药性时,少量但显著比例的EGFR突变腺癌转化为SCLC [1]。此外,报道存在自始携带EGFR突变的SCLC病例 [2]。由于SCLC转化EGFR突变肺癌的临床特征和临床进程在很大程度上尚不可知,Marcoux等人回顾性分析了2006年至2017年间16名EGFR突变SCLC患者的记录[3]。根据这一分析,肿瘤维持其初始EGFR突变,并与T790M相互排斥。这也适用于之前呈T790M阳性的病例。与自始SCLC相同,EGFR突变SCLC转化的肿瘤通常携带TP53、RB1和PIK3CA突变。
获得前所未有规模的恶性间皮瘤结果
恶性胸膜间皮瘤(MPM)是一种罕见、侵袭性且预后不良的癌症。虽然使用铂类和培美曲塞化疗联合或不联合贝伐单抗(bevacizumab)是一线治疗标准,但迄今为止尚未确定批准的二线策略。吉西他滨(gemcitabine)或长春瑞滨(vinorelbine)常常用于这种情况,但它们仅显示出有限的活性。 然而,在MPM患者中评估免疫疗法有理有据。这些肿瘤的炎症表型暗示了T细胞的参与,并且MPM细胞在相当大比例的病例中表达PD-L1。此外,PD-L1表达与MPM的更差预后相关。
专访:生存期受到多条治疗线的影响
FLAURA是阳性试验,因为其结果表明奥希替尼优于吉非替尼和厄洛替尼。现在我们必须考虑将其纳入可用于EGFR突变肺癌一线治疗的多重选择中。除了奥希替尼之外,还有第一代TKI厄洛替尼和吉非替尼以及第二代TKI阿法替尼,但或许不久之后还可能有达克米替尼(dacomitinib),这些数据在最近一期ASCO会议上已有介绍。 在开始治疗EGFR突变肺癌患者之前,有必要考虑总体顺序。
EGFR突变肺癌:排序根据新数据作为主要话题
第一代表皮生长因子受体酪氨酸激酶抑制剂(EGFR TKI)厄洛替尼和吉非替尼以及第二代EGFR TKI阿法替尼(afatinib)是EGFR突变NSCLC患者的推荐一线选择。然而,无论初始反应程度如何,超过60 %的患者产生T790M耐药突变。对于激活EGFR突变和EGFR T790M耐药突变都具有选择性的第三代EGFR TKI奥希替尼最近在美国和欧洲被批准用于治疗晚期T790M阳性NSCLC患者。在两个关键的II期AURA延伸和AURA2研究中,T790M阳性NSCLC患者在先前EGFR TKI治疗发生疾病进展后就ORR和PFS而言获益于奥希替尼治疗。
早期NSCLC切除后基于CT随访的随机化结果
关于早期NSCLC术后的最佳随访,ESMO指南建议每六个月进行患者监控,持续2-3年,门诊包括病史和身体检查,优选在第12和24个月进行对比度增强螺旋胸部CT。此后,应进行包括病史、身体检查和胸部CT在内的年度门诊,以检测第二原发肿瘤(SPC)。然而,这些建议并不基于随机试验,因此仅具有低至中等水平的证据。 多中心III期IFCT-0302试验是关于NSCLC术后随访的首个大型随机化研究,也是评估胸部CT作用的首个随机化试验。