化疗:新方法、新治疗条件
SCAT:使用BRCA1定制辅助化疗
现有指南推荐,在有淋巴结受累的完全切除NSCLC患者(II-IIIA期)中进行术后铂类化疗[1]。然而,生存结果仍然有限,且依从性低于其他肿瘤的辅助疗法。不同化疗方案之间并无直接比较。
对参与DNA修复的基因表达进行的分析可用于使最佳化疗药物和时间表的选择个体化[2]。其中,BRCA1基因具有重要意义,因为其在同源重组途径中起作用,并作为对顺铂和抗微管药物产生应答的差异调节剂。BRCA1基因具有预后和预测相关性;低水平表明低风险和顺铂敏感性,而高水平表明高风险和顺铂耐药性,这意味着患者对紫杉烷类化疗敏感。
随机化SCAT试验测试BRCA1指导的治疗方法,该试验包括切除NSCLC R0 pN1/pN2的患者[3]。对照组接受多西他赛加顺铂,而随机分配到试验组的患者根据BRCA1表达水平进行治疗。低BRCA1表达的患者接受吉西他滨(gemcitabine)/顺铂,中等水平的患者接受顺铂/多西他赛,而高水平的患者接受单独多西他赛。每21天给药四个周期。术后8周内开始化疗。符合方案治疗人群包含对照组102名患者和试验组354名患者。OS为主要终点。
多西他赛单药用于高表达患者中疗效充分
低水平的BRCA1表达与女性、从不吸烟状态、腺癌组织学亚型和纵隔淋巴结受累显著相关。另一方面,更高的水平与男性、鳞状组织学亚型以及目前或过去吸烟状态相关。
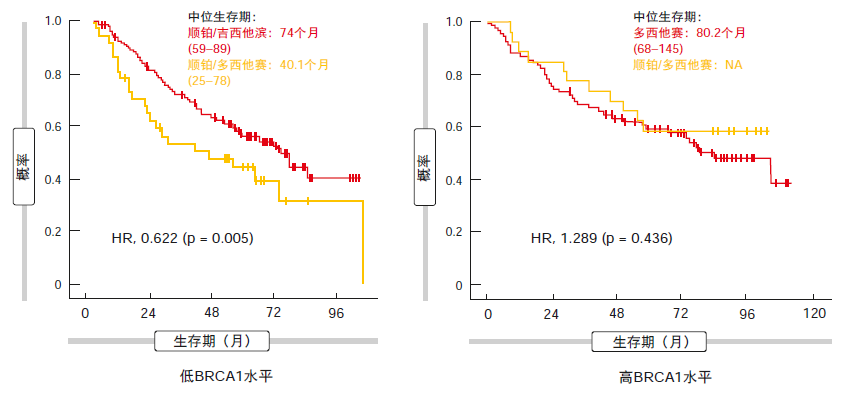
基于初步分析,根据BRCA1水平对辅助化疗进行定制并未导致试验组与对照组之间产生显著的OS差异(82.4与69.3个月;HR,0.946)。两组中的5年存活率均超过50 %(分别为56 %和54 %)。试验组的中位OS变化不明显,范围为74-80.5个月。相比之下,在对照队列中接受治疗的患者在表达高BRCA1水平时表现最差(OS,40.1个月),而中高水平患者的结果明显改善(分别为未达到和82.4个月)。在多变量Cox分析中,发现BRCA1水平在对照组中具有预后作用。
当根据BRCA1亚组在两个治疗组之间进行分析时,与顺铂/多西他赛相比,低表达水平的患者显示获益于顺铂/吉西他滨(74与40.1个月;HR,0.622;图)。然而,对于BRCA1高表达组,试验方案与对照方案之间无差异,即单独使用多西他赛达到的存活率与多西他赛/顺铂队列中的OS结果相似。试验组中未使用顺铂组对计划治疗的依从性显著改善。未使用顺铂治疗的患者显示出更低的非癌相关死亡率的趋势。总体而言,作者得出结论认为,在高BRCA1表达水平的患者中可评估不含铂组分的紫杉烷类辅助治疗。其中,应该有可能避免短期和长期的铂毒性。
图: SCAT试验:根据治疗组间BRCA1亚组的无进展生存期分析
白蛋白结合型紫杉醇(nab-paclitaxel)出人意料的良好二线活性
在晚期NSCLC的二线治疗条件下需要有效且可耐受的化疗选择。随机化开放多中心II期ABOUND.2L+试验在已接受一次铂类化疗但未接受先前紫杉烷类治疗的161名晚期非鳞状NSCLC患者中比较了单药白蛋白结合型紫杉醇与白蛋白结合型紫杉醇加口服阿扎胞苷(azacitidine)(CC-486)[4]。80名患者在21天周期的第1天和第8天接受100 mg/m2剂量的白蛋白结合型紫杉醇单药治疗,而80名患者联合使用白蛋白结合型紫杉醇(在21天周期的第8和15天)和CC-486(在21天周期的第1至14天口服200mg)进行治疗。
该研究没有达到其主要终点,因为白蛋白结合型紫杉醇加CC-486并未证明在PFS方面的优效性。对照组患者表现良好,出人意料,与试验组相比,甚至出现更好的PFS(4.2个月与3.2个月;HR,1.3)。OS(13.6与8.1个月;HR,1.5)和ORR(15.0 %与13.6 %)也是如此。定义为CR、PR和SD组合的疾病控制率分别为67.5 %和65.4 %。根据生活质量分析,白蛋白结合型紫杉醇使呼吸系统症状、症状负荷指数和总体生活质量评分结果得以改善。两种方案均耐受良好。两组中≥ 3级不良事件(AE)均保持在个位数范围内。
在招募所有患者后,建议研究者停止CC-486治疗。虽然联合治疗没有带来任何附加获益,但是单药白蛋白结合型紫杉醇有望成为治疗晚期非鳞状NSCLC的二线药物。正在进行中试验的结果将进一步提供对白蛋白结合型紫杉醇在该治疗条件下作用的见解。
免疫疗法加化疗
在2016年3月的ABOUND.2L+试验中设立了第三治疗组,目的在于研究在白蛋白结合型紫杉醇的基础上添加使用抗PD-L1抗体durvalumab[5]。79名晚期非鳞状或鳞状NSCLC患者在21天周期的第1天和第8天接受白蛋白结合型紫杉醇100 mg/m2,并在21天周期的第15天接受durvalumab 1,125 mg。约三分之一的患者显示出鳞状组织学亚型。与ABOUND.2L+试验中的另外两组相同,允许先前接受一种铂类化疗,虽然不允许先前接受紫杉烷,但患者在入选试验前可接受过免疫检查点抑制剂治疗。11.4%的人群属于这种情况。PFS定义为主要终点。
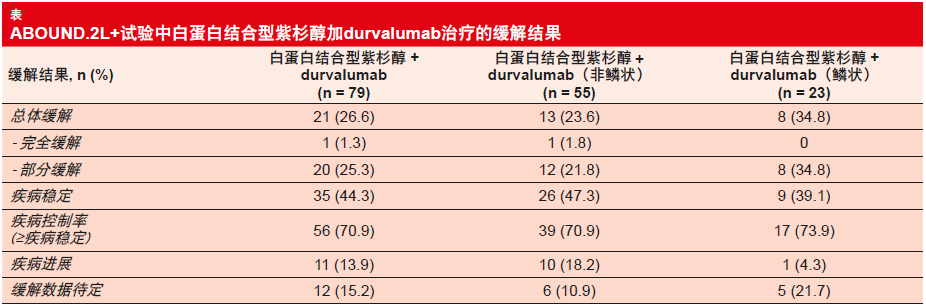
紫杉醇加durvalumab的联合治疗达到4.5个月的中位PFS。尚未达到中位OS。有些出乎意料的是,与检查点抑制剂初治组相比,在招募前接受过免疫检查点抑制剂治疗的患者出现更优的PFS(6.9与4.4个月),但由于经预先治疗的患者人数较少,因此必须慎重考虑这些结果。此外,具有鳞状组织学亚型的患者比具有非鳞状组织学亚型的患者达到更长的PFS(5.9与4.2个月)。总人群中的ORR为26.6 %(表),相比二线治疗条件下其他治疗所达到的结果更具优势。再次,亚组分析显示鳞状NSCLC患者中的结果比非鳞状肿瘤患者中的结果相对更好(34.8 %与23.6 %)。总体而言,试验产生了值得称赞的70.9 %的DCR。
毒性证明是可预测的,其中周围感觉神经病变、呼吸困难、中性粒细胞减少和贫血是最常见的AE。未发生发热性中性粒细胞减少。作者得出结论认为,白蛋白结合型紫杉醇和durvalumab的联合在晚期NSCLC患者的二线或三线治疗中表现出具有可控毒性的抗肿瘤活性。这些数据进一步支持使用白蛋白结合型紫杉醇作为NSCLC患者中免疫检查点抑制剂的化疗搭配。
使用白蛋白结合型紫杉醇治疗鳞状细胞癌
由于鳞状细胞肺癌的治疗选择仍然有限,因此Paik等人介绍的II期试验目前正在未经治疗的IV期鳞状NSCLC患者中测试白蛋白结合型紫杉醇加吉西他滨。WCLC上介绍的发现显示,与铂类方案相比,白蛋白结合型紫杉醇加吉西他滨具有前景光明的疗效并且耐受良好[6]。共招募21名患者并采用两种给药方案之一进行治疗。
ORR定义为试验的主要目的。在分析时,ORR为58 %,其中缓解持续时间为7.5个月。PFS为6.1个月,并且OS为13.9个月。相比之下,已经成为标准一线药物近20年的铂类化疗药物引起30 %-40 %的ORR,中位PFS为4-5.7个月,并且中位OS为9-11.5个月[7-9]。
AE以疲劳、水肿、周围神经病变和恶心为主,其中大部分为1级。严重AE包括白细胞减少、腹泻和肺部感染。试验正在逐步进行,重点在于PD-L1阴性患者。
包含奈达铂(nedaplatin)的辅助性双重化疗
奈达铂是日本开发的一种顺铂衍生物。前瞻性多机构II期研究在34名经过根治性手术(包括肺叶切除术和淋巴结清除术)的IBC-IIIA期NSCLC患者中评估了多西他赛与奈达铂的联合化疗在辅助治疗中的可行性[10]。在4个周期的第1天,分别以60 mg/m²和80 mg/m²给予多西他赛和奈达铂。可行性
(即完成4个周期的患者比例)定义为主要终点,而毒性和无复发生存期(RFS)为次要终点。
结果表明,使用多西他赛加奈达铂的辅助化疗对完全切除NSCLC患者是可行且可耐受的。总体而言,76.5 %的患者完成了所有4个周期。分析时尚未达到中位RFS,而5年RFS率为65.8 %。血液和非血液AE的发生率低于在ANITA试验中测试的顺铂加长春瑞滨(vinorelbine)的联合化疗[11]。
参考文献
- Postmus PE et al., Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (Suppl 4): iv1-iv21
- Karachaliou N et al., Using genetics to predict patient response to platinum-based chemotherapy, Exp Rev Prec Med Drug Develop 2017; 2(1): 21-32
- Massuti B et al., SCAT phase 3 trial: adjuvant CT based on BRCA1 levels in NSCLC N+ resected patients. Final survival results. A Spanish Lung Cancer Group trial. WCLC 2017, PL 02.04
- Morgensztern D et al., nab-Paclitaxel ± CC-486 as second-line treatment of advanced NSCLC: results from the ABOUND.2L+ study. WCLC 2017, MA 03.01
- Govindan R et al., nab-paclitaxel + durvalumab as second- or third-line treatment ad advanced NSCLC: results from ABOUND.2L+. WCLC 2017, MA 03.01
- Paik PK et al., A phase II trial of albumin-bound paclitaxel and gemcitabine in patients with untreated stage IV squamous cell lung cancers. WCLC 2017, P1.03-028
- Scagliotti GV et al., Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer. J Clin Oncol 2008; 26(21): 3543-3551
- Socinski MA et al., Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer: final results of a phase III trial. J Clin Oncol 2012; 30(17): 2055-2062
- Thatcher N et al., Necitumumab plus gemcitabine and cisplatin versus gemcitabine and cisplatin alone as first-line therapy in patients with stage IV squamous non-small-cell lung cancer (SQUIRE): an open-label, randomised, controlled phase 3 trial. Lancet Oncol 2015; 16(7): 763-774
- Teramoto K et al., A phase II study of adjuvant chemotherapy with docetaxel plus nedaplatin for completely resected non-small-cell lung cancer. WCLC 2017, P1.03-37
- Douillard JY et al., Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-IIIA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): a randomised controlled trial. Lancet Oncol 2006; 7(9): 719-727
More posts
化疗:新方法、新治疗条件
现有指南推荐,在有淋巴结受累的完全切除NSCLC患者(II-IIIA期)中进行术后铂类化疗[1]。然而,生存结果仍然有限,且依从性低于其他肿瘤的辅助疗法。不同化疗方案之间并无直接比较。对参与DNA修复的基因表达进行的分析可用于使最佳化疗药物和时间表的选择个体化。
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据
恶性胸膜间皮瘤(MPM)是一种侵袭性肿瘤,如果不进行治疗,则中位生存期为7-9个月[1]。不可切除MPM患者的前线标准治疗包括使用顺铂(cisplatin)和培美曲塞的联合双重疗法,该疗法产生约1年的中位OS。
以靶向方式治疗鳞状细胞癌
在具有鳞状细胞癌(SCC)组织学亚型的NSCLC患者中不对EGFR突变状态进行常规检查,这是由于EGFR突变在这些肿瘤患者中的发生率较低并且对第一代EGFR TKI治疗的临床应答较差。
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息
复发性小细胞肺癌(SCLC)患者仅具有有限的治疗选择。CheckMate 032试验在接受过至少一种先前铂类化疗方案的SCLC患者的PD-L1未选择队列中评估了伴或不伴抗CTLA-4抗体易普利姆玛(ipilimumab)的抗PD-1抗体纳武单抗(nivolumab)。
进一步采取抗EGFR药物治疗:多线
获得性耐药通常伴随着一线EGFR TKI疗法,而门控T790M突变是最常见的机制。第三代不可逆EGFR TKI 奥希替尼已被许可用于治疗已证实其肿瘤携带这种突变的患者。Tan等人提供的回顾性数据显示出多线奥希替尼在52名患者中的活性,这52名患者在新加坡参与了早期使用项目。
“我们正朝着更好地控制肺癌稳步迈进”
在某种意义上,协作是多学科团队合作的另一种表述,但多学科这一术语并不一定局限于医生。它还包括护理人员和其他人员,诸如包括康复团队和患者权利倡导者在内的维持治疗队伍。同时,这一概念的本质为在整体治疗计划中,以患者为中心。团队成员合作,为患者提供最优异、最先进的治疗。