Análisis mutacional: en vías de perfeccionamiento de los estándares
LCMC II
El Lung Cancer Mutation Consortium (LCMC) es un consorcio de varias insti- tuciones para el estudio de las mutacio- nes conductoras del adenocarcinoma de pulmón. La pluralidad de centros cola- boradores permite identificar cifras rela- tivamente elevadas de pacientes con al- teraciones infrecuentes y raras, facilita el análisis de sus características clínicas y sienta las bases para la realización de ensayos de tratamientos dirigidos.
El LCMC II, que es la segunda ronda del LCMC, comenzó en 2012 [1]. La pri- mera ronda, el LCMC I, se inició en 2009 y demostró que la elaboración de perfi- les genómicos puede rendir frutos, como actividad de una pluralidad de instituciones, en beneficio de los pa- cientes. En el LCMC II participaron 16 centros y se analizaron 14 alteraciones génicas. Al final del proyecto, todos los centros habían finalizado la transición a la secuenciación de próxima generación para la identificación de mutaciones, que era una de las metas del LCMC II.
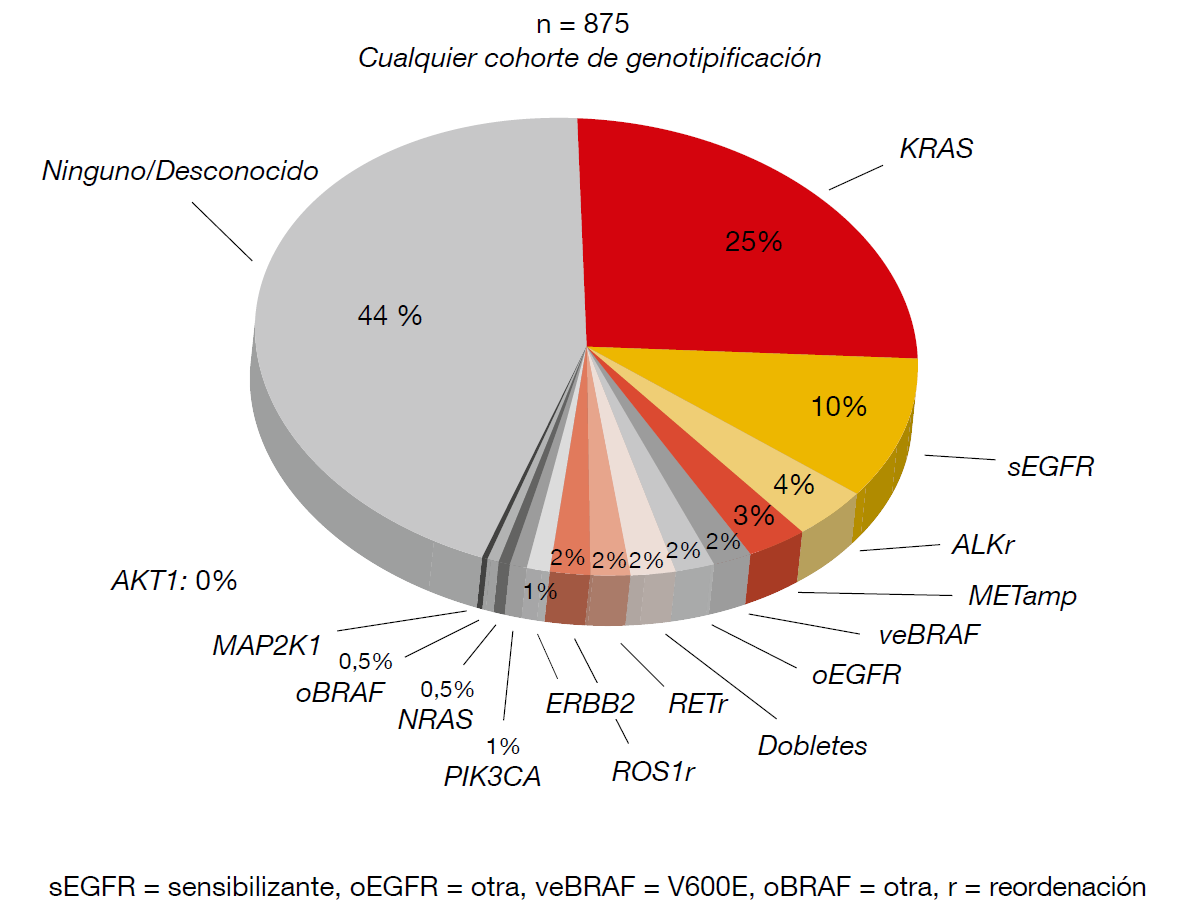
Los genes estudiados en el LCMC II fueron mutaciones puntuales en AKT1, BRAF, EGFR, HER2, KRAS, MAP2K1 (MEK), PIK3CA y NRAS, así como reor- denaciones en ALK, RET y ROS1, y otras alteraciones, como METamp, PTENexp y METexp. Participaron en el proyecto pacientes con adenocarcinoma de pul- món en estadio IV. Los resultados de los análisis génicos se transfirieron a la base de datos virtual del LCMC y a los médicos tratantes, que pudieron usar- los para seleccionar tratamientos de referencia o para recomendar ensayos clínicos con agentes concretos o trata- mientos no previstos en las fichas técni- cas. Los resultados así obtenidos con los pacientes volvieron a transferirse des- pués a la base de datos del LCMC. Se realizaron genotipos en 875 pacientes; 242 tenían alteraciones conductoras. Finalmente, se administró tratamiento dirigido a 131 pacientes.
Mejor supervivencia con el análisis genómico ampliado
La figura muestra la distribución de las mutaciones definidas en el LCMC II. No se incluyen la pérdida de PTEN y la ex- presión de MET; se daban en el 15 % y el 59 % de los casos, respectivamente. Como ya se ha descrito previamente, fue infrecuente la superposición de al- teraciones (4,1 % del total de casos).
Se observaron en el LCMC II muchas de las asociaciones ya conocidas con distintos pronósticos, como los benefi- cios resultantes del tratamiento con in- hibidores de tirosina cinasa del EGFR en la población con mutaciones en el EGFR. Además, como era de esperar, se correlacionaron entre sí el tabaquismo y determinadas alteraciones génicas. Si se considera la totalidad de mutaciones conductoras, el tratamiento dirigido lo- gró mejorar la supervivencia. En con- junto, no influyeron en los efectos del tratamiento dirigido las mutaciones concomitantes en TP53, PTEN y/o PI- K3CA. En cambio, se identificaron algu- nos moduladores. En el grupo de pa- cientes EGFR positivos a los que se trató con inhibidores de tirosina cinasa, la presencia de TP53 tuvo efectos modula- dores sobre los beneficios del trata- miento dirigido. La probabilidad de su- pervivencia fue mayor cuando no había mutación. Se demostró que las muta- ciones en KRAS implican un peor pronóstico en personas que nunca han sido fumadores.
Los autores concluyeron que las pruebas moleculares ampliadas y los tratamientos dirigidos asociados confieren beneficios de supervivencia, si bien es importante el aspecto relativo a los sistemas de análisis que se empleen. Puede haber amplias variaciones entre las tasas de mutaciones según que se utilicen unos u otros sistemas de análisis. Por ejemplo, lo más probable es que se produzca una infraobservación del estado de la mutación en TP53, lo que limita la capacidad para identificar a los pacientes afectados y desarrollar opciones de tratamiento. Según evolucionen los análisis y tratamientos, cabe esperar nuevas mejoras.
Figura: Frecuencia de las mutaciones observadas en el LCMC II en 875 pacientes con adenocarcinoma
de pulmón.
Las células tumorales circulantes reflejan la realidad
La secuenciación de próxima generación (SPG) del ADN tumoral circulante (ADNtc) permite establecer un perfil no invasivo de los tumores sólidos. Hasta la fecha, los estudios de biopsias líquidas se han visto limitados a cohortes de mo- desto tamaño y a estudios de casos. Ahora, el análisis genómico a gran es- cala ha establecido que los patrones de alteraciones genéticas que se detectan con biopsias líquidas pueden reflejar con bastante precisión cambios que se identifican en las biopsias tumorales tradicionales [2]. Se obtuvieron mues- tras de sangre de más de 15.000 pacien- tes con cánceres avanzados de 50 tipos distintos. El 37 % de los pacientes tenían cáncer de pulmón. Los perfiles genómi- cos somáticos se realizaron con una prueba SPG muy exacta y de amplia cobertura del ADNtc dirigida a 70 genes. Es uno de los mayores estudios de genó- mica del cáncer jamás realizados.
Salvo en el caso de las mutaciones de resistencia, como la mutación T790M del EGFR, las frecuencias específicas de los distintos tipos de cáncer y los patro- nes de exclusividad mutua entre las principales alteraciones conductoras (evaluadas en el ADNtc) remedan en gran medida los patrones de alteracio- nes tisulares. Si el ADNtc era positivo para las anomalías clave en EGFR, BRAF, KRAS, ALK, RET y ROS1, se hallaron las mismas mutaciones en el tejido en el 94 al 100 % de los casos. La mayoría de las alteraciones del ADNtc se detectaron a niveles muy bajos. La mitad se obser- varon a frecuencias inferiores al 0,4 % del ADN total circulante. La precisión de la biopsia líquida siguió siendo alta in- cluso a esos bajos niveles. En general, el análisis del ADNtc reveló posibles op- ciones de tratamiento dirigido en casi dos tercios de los pacientes evaluados.
En el subgrupo del CPNM se detecta- ron 51 casos de aberraciones conducto- ras mediante la SPG del ADNtc, además de los ya detectados con la genotipifi- cación tisular. El rendimiento de los bio- marcadores aumentó, por consiguiente, en un 42 %. En general, este análisis ilustra que la detección plasmática de mutaciones puede mejorar o comple- mentar el análisis tisular.
El ADNtc como marcador pronóstico
Lin y cols. expusieron la hipótesis de que las alteraciones específicas de tu- mores del ADNtc cuantifican la hetero- geneidad tumoral y pueden servir de método no invasivo para determinar el pronóstico y la recurrencia en pacientes con CPNM en estadio III irresecable que se tratan con intención curativa mediante radioquimioterapia [3]. La heterogeneidad tumoral se correla- ciona con resistencia terapéutica y mal pronóstico. Los investigadores evalua- ron el ADNtc en 156 pacientes con CPNM irresecable en tratamiento con radioterapia (XRT) o quimiorradiotera- pia. Se extrajo sangre antes, durante y después del tratamiento. Se usó una prueba de SPG para detectar variantes de nucleótidos aislados en 70 genes y amplificaciones en 16 genes, además de ciertas fusiones e indels.
Según el análisis intermedio, se ha- llaron en los puntos temporales estable- cidos cuatro patrones principales de alteraciones del ADNtc: alteraciones es- pecíficas persistentes durante la XRT (n = 9), ausencia de alteraciones en la muestra post-XRT (n = 14), niveles mayores que en el momento basal (n = 10) y alteraciones fluctuantes durante el tratamiento (n = 11). No se observaron asociaciones significativas entre la SLP/ SG y estos patrones de alteraciones del ADNtc. Lo mismo puede decirse de la SLP/SG y los cambios porcentuales de los niveles de ADNtc entre antes y des- pués de la XRT. Los resultados, no obs- tante, están limitados por el tamaño de la muestra.
En todo caso, la presencia de muta- ciones específicas parece estar correla- cionada con el pronóstico. La reapari- ción de las mutaciones conductoras tras el tratamiento se asoció a una SLP me- nor. Las mutaciones en APC/ARID1A presentes en la muestra de sangre post- XRT se correlacionaron con una SLP menor después de ajustar para la histo- logía tumoral y el estadio. Del mismo modo, las mutaciones en NF1 detecta- das en las muestras post-XRT se asocia- ron a una SG menor después de ajustar para la histología tumoral y el estadio. Podría ser necesario el análisis final de la cohorte mayor para alcanzar la signi- ficación en relación con otros patrones pronósticos.
REFERENCES
- Aisner DL et al., Expanded genomic testing in lung adenocarcinomas expands the survival be- nefit. J Clin Oncol 34, 2016 (suppl; abstr 11510)
- Zill OA et al., Somatic genomic landscape of over 15,000 patients with advanced-stage can- cer from clinical next-generation sequencing analysis of circulating tumor DNA. J Clin Oncol 34, 2016 (suppl; abstr LBA11501)
- Lin SH et al., Circulating tumor DNA as a non-invasive tool to identify patients at risk for recurrence after chemoradiotherapy in stage III non-small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 8553)
More posts
Análisis mutacional: en vías de perfeccionamiento de los estándares
El Lung Cancer Mutation Consortium (LCMC) es un consorcio de varias insti- tuciones para el estudio de las mutacio- nes conductoras del adenocarcinoma de pulmón. La pluralidad de centros cola- boradores permite identificar cifras rela- tivamente elevadas de pacientes con al- teraciones infrecuentes y raras, facilita el análisis de sus características clínicas y sienta las bases para la realización de ensayos de tratamientos dirigidos.
Exploración de los agentes establecidos y los nuevos agentes dirigidos sobre el EGFR
El ensayo de fase IIb LUX-Lung 7 fue una comparación directa del bloqueante de la familia ErbB de segunda generación afatinib y el inhibidor de tirosina cinasa del EGFR reversible de primera generación gefitinib en pacientes con adenocarcinoma de pulmón avanzado (estadio IIIB/IV) EGFR positivo no tratados previamente.
Resultados similares con cuatro pautas de quimioterapia adyuvante basada en cisplatino
El ensayo de fase III E1505 se diseñó para investigar la adición de bevacizumab a la quimioterapia adyuvante en pacientes con CPNM en estadios iniciales totalmente resecado.Se basó en la premisa de que los beneficios de la quimioterapia adyuvante basada en cisplatino son pequeños en esta población. El estudio E1505 contó con 1501 pacientes con CPNM en estadio IB totalmente resecado.
Mejora de la SLP con el tratamiento local en el CPNM oligometastásico
Los datos indican la existencia de un CPNM de fenotipo “metastásico limitado”. Sin embargo, el tipo de tratamiento óptimo y la utilidad del tratamiento local agresivo siguen siendo discutibles en estos pacientes. Gómez y cols., han presentado el primer ensayo prospectivo y aleatorizado que aborda esta cuestión.
CPNM localmente avanzado: vinorelbina oral presenta un mejor perfil de seguridad que etopósido
El ensayo RENO de fase II, aleatorizado, multicéntrico y abierto, se efectuó con el objetivo de encontrar una pauta de quimioterapia normalizada en el contexto de la quimiorradioterapia del CPNM localmente avanzado. En total, 134 pacientes con CPNM en estadio III inoperable recibieron vinorelbina oral más cisplatino o etopósido más cisplatino.
Las nuevas estrategias están ofreciendo esperanza a los pacientes con CPM
Durante los últimos 30 a 40 años solo se han hecho avances poco importantes en el tratamiento del cáncer de pulmón microcítico (CPM), que representa del 10 % a 15 % de los casos de cáncer de pulmón.El CPM es radiosensible, pero aproximadamente el 70 % de los pacientes presenta enfermedad extendida que no puede incluirse en un único campo de radioterapia.