EGFR突变肺癌:活性和耐药性方面新发现
厄洛替尼(erlotinib)作为新辅助策略
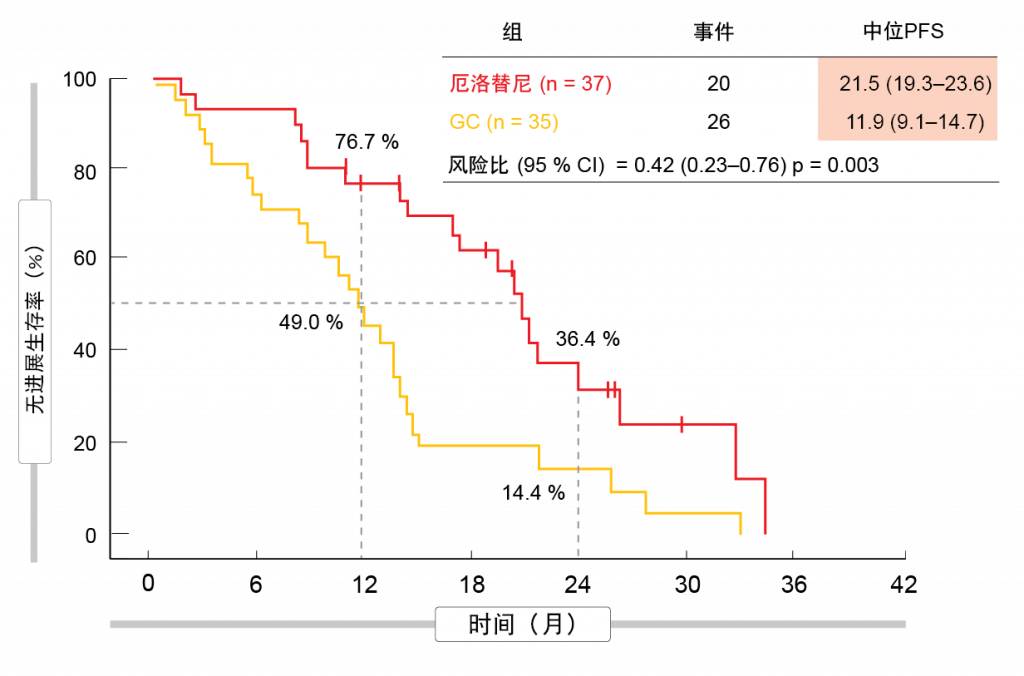
在IIIA-N2期NSCLC患者中,当前的多模式治疗选择包括根治性放化疗、手术后辅助化疗或者新辅助治疗后手术切除。标准一线EGFR酪氨酸激酶抑制剂(TKI)厄洛替尼已被证明在IIIA-N2期NSCLC的新辅助治疗条件下具有可行性[1]。因此,开放标签随机化II期CTONG-1103试验在局部晚期EGFR突变NSCLC患者中比较了厄洛替尼与顺铂(cisplatin)类化疗作为新辅助治疗/辅助治疗[2]。在手术前,将患者随机分配为150 mg/d厄洛替尼达42天 (n = 37)或每周3次吉西他滨(gemcitabine)+顺铂达2个周期(n = 35)。 手术后,实验组患者继续接受 150 mg/d厄洛替尼达12个月,而对照组患者再接受2个周期的化疗。ORR构成主要终点。 新辅助治疗厄洛替尼确实增加了ORR,但未达到显著程度(54.1 %与34.3 %;p = 0.092)。手术结果在数值上有利于厄洛替尼:实验组患者接受手术治疗的比例更高(83.8 %与68.6 %; p = 0.129),并且厄洛替尼治疗组的完全切除率更高(73.0%与62.9%; p = 0.358),淋巴结分期下降也是如此(10.8 %与2.9 %;p = 0.185)。可获得50个手术切除的样本。在两组中,未发生病理上的完全缓解,但使用厄洛替尼组更常获得主要病理缓解(10.7 %与0 %)。厄洛替尼导致PFS显著改善, 而PFS被定义为次要终点(21.5 与11.9个月;HR,0.42;p = 0.003;图1)。在分析时,OS数据尚未达到成熟。术后并发症在两组之间均衡发生,与新辅助疗法/辅助疗法相关联的不良事件与先前报道一致。正如作者所总结,该方案需要在新辅助条件下进一步探索。
图1: 新辅助条件下的厄洛替尼与化疗:EGFR TKI治疗观察到的无进展生存率优势
一线吉非替尼(gefitinib)联合化疗
单药EGFR TKI治疗已成为晚期EGFR突变NSCLC患者的标准一线策略,但据推测,添加化疗可能进一步改善结果。III期NEJ009试验在总计342名先前未经治疗的IIIB/IV期非鳞状EGFR突变NSCLC患者中测试了卡铂加培美曲塞(pemetrexed)和吉非替尼与单独吉非替尼的比较[3]。在实验组中,给予吉非替尼加化疗达4至6个周期,然后用吉非替尼加培美曲塞维持治疗直至进展。对照组患者持续接受吉非替尼治疗;当发生进展时,方案建议改用铂类疗法。 与吉非替尼单药治疗相比,组合产生显著优效的PFS(20.9与11.2个月;HR,0.490;p < 0.001)。对于PFS2,未观察到显著差异,其被定义为对照组中至第二次进展的时间与实验组中至第一次进展的时间的比较。此外,组合还提供了显著延长的OS(50.9与38.8个月;HR;0.72;p = 0.02)。组合的ORR较高(84.0 %与68.0 %)。对第一次和第二次疾病进展时的临床状态的评估表明,当计划的方案失败时,组合组中的患者表现状态优于单药治疗组。 毫不奇怪,血液学毒性更常见于组合组,但两组中均少有患者因毒性中止治疗(11.2 %与9.4 %)。生活质量分析表明,在研究过程中两组之间没有差异。研究人员认为,吉非替尼联合卡铂和培美曲塞是晚期EGFR突变NSCLC患者的一线治疗的有效选择。
LUX-Lung 8的最终分析:鳞状NSCLC中的阿法替尼(afatinib)
基于开放标签III期LUX-Lung 8试验,阿法替尼已被批准用于治疗在铂类化疗期间或之后发生进展的鳞状组织学IIIB/IV期肺癌患者。LUX-Lung 8对阿法替尼与厄洛替尼进行比较的主要分析显示实验组在PFS(2.6与1.9个月;HR,0.81; p = 0.0103)和疾病控制率(50.5 %与 39.5 %;p = 0.002)方面有显著改 善[4]。与ErbB野生型肿瘤相比,ErbB突变阳性肿瘤患者的PFS和OS获益更为明显[5]。 在2018年ESMO大会上介绍的LUX-Lung 8试验的最终分析证实了这些结果[6]。阿法替尼的更新OS显著长于厄洛替尼(7.8与6.8个月;HR,0.84; p = 0.0193)。实验组中有21名患者具有长期疾病控制(≥ 12个月的治疗)。在该组中,某些遗传异常,特别是ErbB家族中的异常,比在总体阿法替尼治疗人群中更加常见。这些患者的中位治疗时间为19.0个月;中位PFS和OS分别为12.9和27.5个月。部分缓解达到29 %。 长期治疗耐受性良好,具有可预测的耐受性特征,其可通过维持治疗和耐受性指导的剂量减少来控制。根据作者的结论,这些数据表明阿法替尼可作为化疗期间进展的肺鳞状细胞癌患者,特别是那些具有ErbB家族遗传异常的患者的治疗选择。
GIDEON和NEJ027
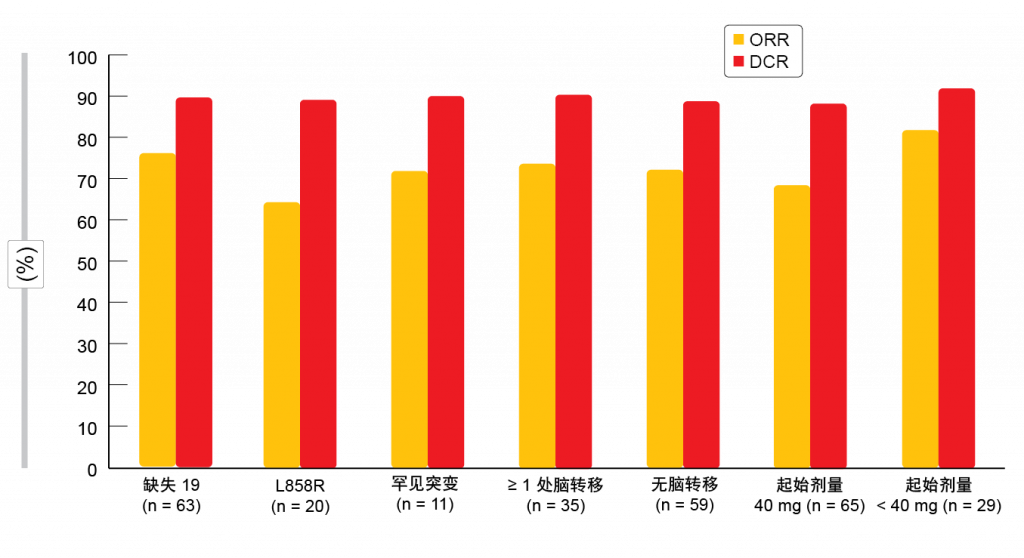
Brueckl等人报告了GIDEON的第一次中期分析,GIDEON是在德国进行的一项前瞻性非干预性研究,旨在研究一线阿法替尼在常规临床治疗中的活性和耐受性[7]。在151名接受治疗的患者中,大多数(72.8 %)以≥ 40 mg的阿法替尼剂量开始治疗;其中61.8 %具有剂量减少。在以< 40 mg开始的患者组中,46.2 %具有剂量减少,而33.3 %经历剂量增加。阿法替尼的安全性特征与临床试验确定的已知安全性特征一致。 尽管有相对较高比例的患者具有脑转移(约30%)和罕见EGFR突变 (约13 %),但结果证实了阿法替尼在常规条件下的临床数据。中位PFS为12.9个月,其中12个月PFS率为54.6 %。 73%的患者具有缓解,90 %的患者获得疾病控制。ORR和疾病控制率(DCR)均与EGFR突变类型、基线脑转移的存在和起始剂量无关(图2)。阿法替尼在临床试验方面代表性不足的老年人群中被证明是有效的。年龄 < 75岁和≥ 75岁的患者通过治疗在中位PFS方面获得同等获益(分别为12.2和14.2个月)。初步OS分析显示,整体中位OS超过33个月。预计将在2019年得到GIDEON试验的最终结果。 同样,开放标签单组II期NEJ027研究确定了阿法替尼在EGFR突变晚期NSCLC老年患者(≥ 75岁)中的疗效和安全性(n = 37)[8]。ORR和DCR分别为75.7 %和89.2 %。中位PFS为14.3个月,64.3 %的患者在1年内无进展。OS随访正在进行;1年生存率为83.6 %。分别有78.9 %和73.7 %有必要进行剂量减少和临时中止。总体而言,患者以28.4 mg的平均日剂量治疗368.0天。
图2: 在非干预性GIDEON研究中用一线阿法替尼获得的总缓解率和疾病控制率
奥希替尼(osimertinib):来自FLAURA的耐药性数据…
在III期FLAURA研究中,与吉非替尼和厄洛替尼相比,第三代CNS活性EGFR TKI奥希替尼作为晚期EGFR突变NSCLC患者的一线治疗显示出优异的功效[9]。迄今为止,关于一线奥希替尼的获得性耐药机制的公开数据有限。然而,增加对此方面的了解对于为未来治疗发展提供信息至关重要。在2018年ESMO大会上,Ramalingam等人介绍了在FLAURA期间发生进展或中止治疗的患者的血浆样本中检测到的对一线奥希替尼获得性耐药的候选机制[10]。该分析集中于可在循环肿瘤DNA(ctDNA)中检测到的基因组改变。未捕捉包括SCLC转化和蛋白质表达变化在内的非遗传耐药机制。此外,在血浆分析中可能未充分介绍扩增事件。 使用新一代测序(NGS)分析在基线处和在进展或中止时获得的成对血浆样本。在272名具有成对NGS数据的患者中,分别有129名和91名接受对照物EGFR TKI和奥希替尼治疗的患者在其基线血浆样本中具有EGFR突变,因此被纳入分析。这表明,正如预期,对照物治疗组中最常见的获得性耐药机制是EGFR T790M突变(47 %)。此外,存在MET扩增(4%)和HER2扩增 (4 %)。PIK3CA突变的发生率为3 %。 2 %的患者发生RET融合基因异常。 在奥希替尼治疗期间,没有患者显示出T790M介导的获得性耐药的证据。最常见的机制包括MET扩增 (15 %)和EGFR C797S突变(7 %)。 3 %的患者发生其他继发性EGFR突变,如L718Q。PIK3CA突变的发生率为7 %, HER2扩增的发生率为2 %,HER2突变的发生率为1 %,BRAF和KRAS突变的发生率均为3 %。共有10 %观察到细胞周期相关基因的各种改变。约14 %的患者具有并发的候选耐药性突变,这表明不止一种途径参与耐药性发展。 总体而言,这些结果并未表明在一线治疗环境中导致侵袭性疾病生物学的奥希替尼耐药性的新机制。然而,需要基于组织的测试来理解耐药性异常的全部情况。因此,正在进行的研究将针对一线奥希替尼的耐药机制进行组织分析。
…和来自AURA3的耐药性数据
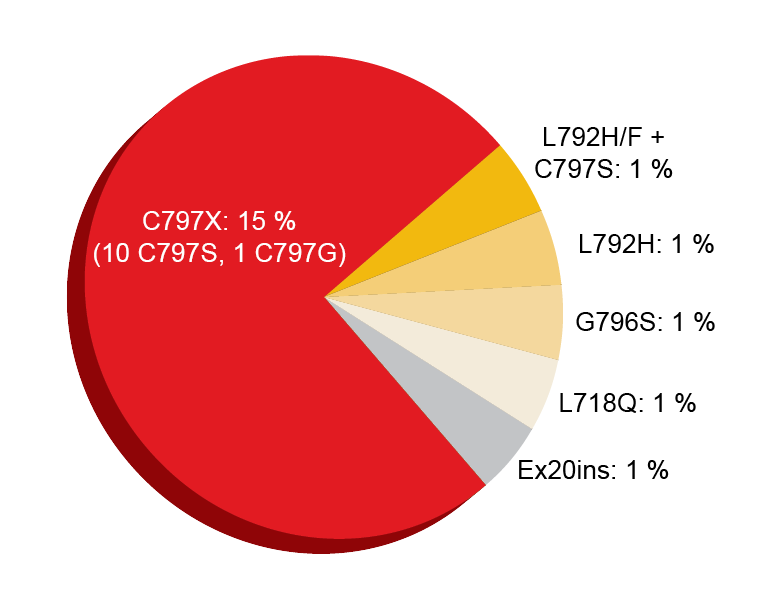
在随机化AURA3试验中获得了奥希替尼治疗患者的获得性耐药机制的类似数据[11]。AURA3确定了在一线EGFR TKI治疗发生进展后的T790M阳性晚期NSCLC患者中奥希替尼相对于化疗的优效性[12]。在AURA3试验期间,在对奥希替尼治疗发生进展的患者中研究了血浆ctDNA基因组谱,其中重点在于获得性突变。而对于FLAURA分析,收集来自基线和进展/中止时间的成对血浆样本并使用NGS进行评估。奥希替尼和化疗组分别包括73名和24名患者。同样,该分析未捕捉耐药性的非遗传机制,并且很可能未完全反映扩增事件。 在进展/中止时,49 %的样本中发生了T790M耐药性突变缺失,这与之前的研究一致[13-15]。已经观察到携带T790M的克隆的消除经常与其他竞争性耐药机制的出现同时发生。在21 %的患者中观察到获得性EGFR突变,最常见的是C797S突变(图3)。所有获得性EGFR突变患者均保留T790M。MET扩增在约19%的情况下出现,并且与EGFR C797S突变(7 %)以及EGFR G796S突变和HER2扩增(1 %)同时发生。T790M的缺失和保留都在MET扩增样品中大量存在。细胞周期基因改变的发生率为12 %。在5 %的患者中鉴别出HER2扩增,在3 %的患者中鉴别出致癌融合,并在3%的患者中鉴别出BRAFV600E突变。该分析在19 %的患者中发现多于一种耐药性相关改变。 根据候选耐药机制初步评估无进展生存期。然而,由于这些机制的异质性,每种事件的数量很少。与T790M保留(7.06个月)相比,T790M缺失显示出与稍短的中位PFS(5.54个月)的相关性。 作者在结论中指出,在确定后续治疗时,可靶向改变的重叠具有临床意义。目前正在研究奥希替尼耐药性的新机制和适当的治疗策略。例如,一项前瞻性单组II期研究将在奥希替尼治疗失败后的患者中评估阿法替尼和贝伐珠单抗(bevacizumab)的组 合[16]。据推测,该方案可能克服包括罕见EGFR突变和MET扩增在内的与奥希替尼治疗失败有关的耐药机制。
图3: AURA3中在奥希替尼治疗后出现的获得性 EGFR突变
一线nazartinib:II期结果
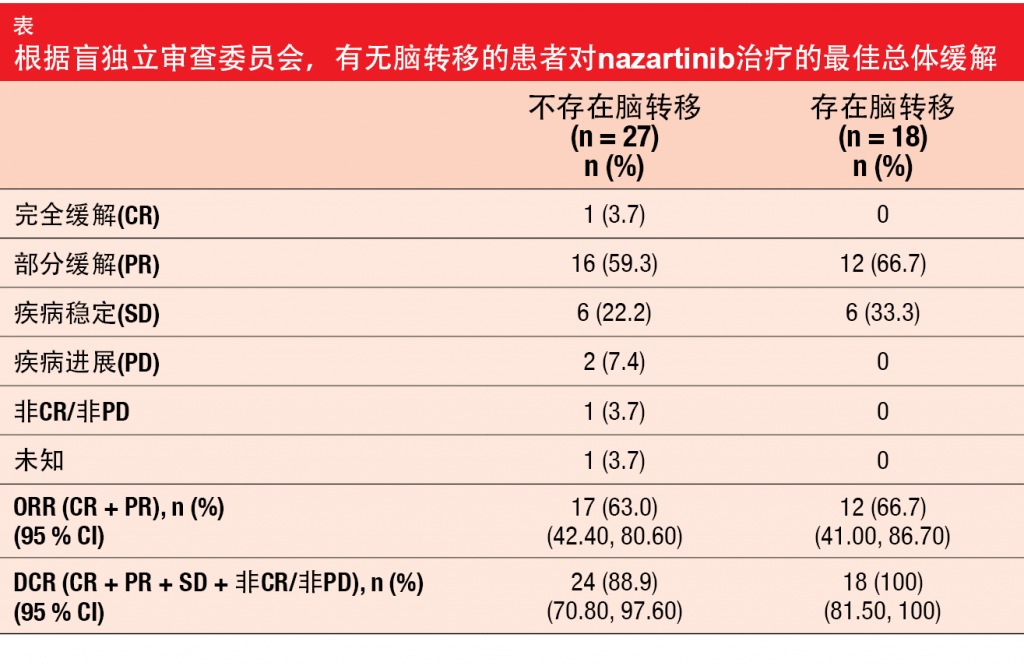
与奥希替尼相同,nazartinib是一种口服型第三代EGFR TKI,其在选择性地靶向激活EGFR突变以及诸如T790M等抗性突变的同时仍保留野生型EGFR。在接受过≤ 3种前线全身治疗的晚期EGFR突变NSCLC患者中进行的I/II期多中心研究将每日150 mg确定为推荐的II期剂量[17]。尽管较高比例的患者在基线时具有脑转移,但研究在初治患者中进行的II期部分的初步结果显示出喜人的疗效[18]。在2018年ESMO大会上,Tan等人报告了在45名EGFR突变、局部晚期或转移性NSCLC患者中使用每日150 mg nazartinib作为一线治疗直至进展获得的主要疗效和安全性结果[19]。允许经过治疗的稳定脑转移。 根据盲独立审查确认的ORR为64.4 %,包括一例确认的完全缓解和28例确认的部分缓解。疾病控制达到 93.3 %。大多数患者的目标病灶减小。在数据截止时,PFS和缓解持续时间数据仍不成熟。 此外,nazartinib在基线处具有CNS病灶的患者中显示出活性。在有无脑转移的患者中确认的ORR分别为66.7 %和63 %,DCR分别为100 %和 88.9 %(表)。在18名具有基线脑部病灶的患者中,52.9 %的具有脑部非目标病灶的患者观察到病灶缺失或正常化。具有脑部目标病灶的患者获得相比基线38.5 %的大小减小。仅有两名患者经历伴有新CNS转移的脑部进展。Nazartinib显示出可耐受的安全性特征。
参考文献
- Zhong W et al., Phase II study of biomarker-guided neoadjuvant treatment strategy for IIIA-N2 non-small cell lung cancer based on epidermal growth factor receptor mutation status. J Hematol Oncol 2015; 8: 54
- Zhong WZ et al., Erlotinib versus gemcitabine plus cisplatin as neoadjuvant treatment for stage IIIA-N2 EGFR-mutation positive non-small-cell lung cancer (EMERGING-CTONG 1103): multicentre phase 2 randomized study. ESMO 2018, abstract LBA48_PR
- Seike M et al., Phase III study of gefitinib (G) versus gefitinib + carboplatin + pemetrexed (GCP) as 1st-line treatment for patients with advanced non-small cell lung cancer (NSCLC) with EGFR mutations (NEJ009). ESMO 2018, abstract 1382PD
- Soria JC et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16(8): 897-907
- Goss GD et al., Association of ERBB Mutations With Clinical Outcomes of Afatinib- or Erlotinib-Treated Patients With Lung Squamous Cell Carcinoma: Secondary Analysis of the LUX-Lung 8 Randomized Clinical Trial. JAMA Oncol 2018; 4(9): 1189-1197
- Goss GD et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung: final analysis of the global phase III LUX-Lung 8 trial. ESMO 2018, abstract 1442P
- Brueckl WM et al., Effectiveness of afatinib in clinical practice – first results of the GIDEON trial: a prospective non-interventional study in EGFR-mutated NSCLC in Germany. ESMO 2018, abstract 1449P
- Aiba T et al., A phase II study of first-line afatinib for patients aged 75 or older with EGFR mutation-positive advanced non-small cell lung cancer: North East Japan Study Group Trial NEJ027. ESMO 2018, abstract 1445P
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378: 113-125
- Ramalingam SS et al., Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the double-blind, randomised phase III FLAURA study. ESMO 2018, abstract LBA50
- Papadimitrakopoulou V et al., Analysis of resistance mechanisms to osimertinib in patients with EGFR T790M advanced NSCLC from the AURA3 study. ESMO 2018, abstract LBA51
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376: 629-640
- Oxnard GR et al., Assessment of resistance mechanisms and clinical implications in patients with EGFR T790M-positive lung cancer and acquired resistance to osimertinib. JAMA Oncol 2018 Aug 2. doi: 10.1001/jamaoncol.2018.2969. [Epub ahead of print]
- Lin CC et al., Outcomes in patients with non-small-cell lung cancer and acquired Thr790Met mutation treated with osimertinib: a genomic study. Lancet Res Med 2018; 6(2): 107-116
- Le X et al., Landscape of EGFR-dependent and -independent resistance mechanisms to osimertinib and continuation therapy post-progression in EGFR-mutant NSCLC. Clin Cancer Res 2018 Sep 18. pii: clincanres.1542.2018. doi: 10.1158/1078-0432.CCR-18-1542. [Epub ahead of print]
- Hata A et al., Afatinib plus bevacizumab combination after osimertinib failure for advanced EGFR-mutant non-small cell lung cancer: a multicentre prospective single arm phase II study (ABCD study). ESMO 2018, abstract 1501TiP
- Tan DS et al., Updated results of a phase 1 study of EGF816, a third-generation, mutant-selective EGFR tyrosine kinase inhibitor (TKI), in advanced non-small cell lung cancer (NSCLC) harboring T790M. J Clin Oncol 34, 2016 (suppl; abstr 9044)
- Kim DW et al., Preliminary Phase II results of a multicenter, open-label study of nazartinib (EGF816) in adult patients with treatment-naïve EGFR-mutant non-small cell lung cancer (NSCLC). J Clin Oncol 36, 2018 (suppl; abstr 9094)
- Tan DSW et al., Phase II results for single-agent nazartinib (EGF816) in adult patients (Pts) with treatment-naïve EGFR-mutant non-small cell lung cancer (NSCLC). ESMO 2018, abstract LBA61
More posts
专访:支持EGFR TKI治疗用药顺序的若干原因
支持EGFR TKI治疗用药顺序的若干原因 EGFR突变NSCLC患者的理想用药顺序将是怎样? 有若干原因支持阿法替尼后奥希替尼的用药顺序。原因之一在于在第一代或第二代EG
EGFR突变肺癌:活性和耐药性方面新发现
EGFR突变肺癌:活性和耐药性方面新发现 厄洛替尼(erlotinib)作为新辅助策略 在IIIA-N2期NSCLC患者中,当前的多模式治疗选择包括根治性放化疗、手术后辅助
检查点抑制在所有治疗线中表现优异
检查点抑制在所有治疗线中表现优异 新辅助疗法:NEOSTAR 患有早期和局部晚期(I-IIIA期)非小细胞肺癌(NSCLC)的患者通常需要接受手术,但长期结果仍有待改善。单
序言
序言 Sanjay Popat, PhD, FRCP 英国伦敦皇家马斯登医院胸内科肿瘤顾问医师 亲爱的同事们, ESMO大会代表了欧洲主办的国际顶级肿瘤学活动。本年度的会