Mutaciones inductoras poco frecuentes: resultados alentadores en pequeñas poblaciones de pacientes
Además de mutaciones de fusión de ALK y mutaciones de EGFR, los estudios de los perfiles genéticos de pacientes con CPNM han identificado otras mutaciones que se podrían utilizar para otros tratamientos dirigidos. Entre ellas, los reordenamientos ROS1 y RET ocurren en el 1 % a 2 % de los pacientes con CPNM.
Actualización de PROFILE 1001
Se sabe que crizotinib no solo va dirigido a ALK, sino también a ROS1, entre otros. Los pacientes con CPNM avanzado ROS1-positivo están siendo tratados con 250 mg dos veces al día en el estudio en fase I abierto PROFILE 1001 en curso. Los datos iniciales confirman que el tratamiento dirigido a ROS1 es una estrategia viable en el CPNM con reordenamiento de ROS1 [1]. En 2016 se aprobó crizotinib para el tratamiento de los pacientes con CPNM metastásico/avanzado ROS1-positivo en los Estados Unidos y en Europa. Shaw y cols. presentaron los resultados actualizados de seguridad y actividad antitumoral de la fase de expansión de PROFILE 1001 [2]. En este análisis se incluyó a 53 pacientes. La población contenía tres pacientes con CPNM ALK-negativo, que de forma retrospectiva se determinó que era ROS1-positivo. El adenocarcinoma era la histología más frecuente del CPNM (96,2 %), y la mayoría de los pacientes (75,5 %) no tenían antecedentes de tabaquismo.
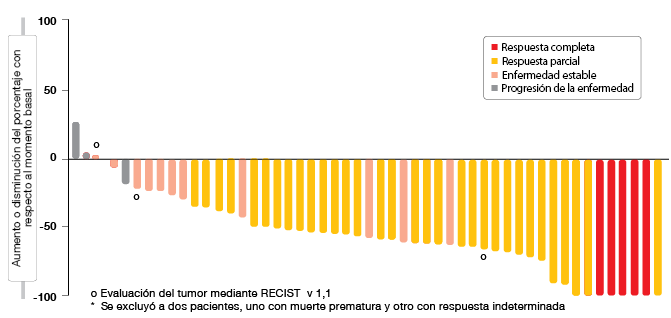
Según el análisis, el tratamiento con crizotinib obtuvo una TRO clínicamente significativa, del 69,8 %. Los pacientes experimentaron respuestas rápidas, con una mediana del tiempo hasta la respuesta de 7,9 semanas, que correspondía a la fecha aproximada de la primera exploración del tumor durante el tratamiento. Las respuestas fueron duraderas y constantes en diversas características demográficas y basales de los pacientes. Casi todos los pacientes experimentaron cierto grado de reducción del tumor durante el estudio (Figura). Crizotinib fue en general bien tolerado, con un perfil de seguridad concordante con el observado en el CPNM ALK-positivo.
Figura: PROFILE 1001: mejor variación porcentual con respecto al momento basal en el tamaño de las lesiones de referencia obtenida con crizotinib en pacientes con CPNM* y reordenamiento ROSl
CPNM RET-positivo: Datos japoneses sobre vandetanib
Se están realizando ensayos clínicos en Japón y los Estados Unidos de pacientes con mutaciones de fusión RET para evaluar fármacos específicos, como vandetanib, alectinib y cabozantinib.
Vandetanib es un ITK oral del receptor que potencialmente inhibe RET, EGFR y VEGFR. Horiike y cols. llevaron a cabo un ensayo multicéntrico en fase II con vandetanib 300 mg/día en pacientes con CPNM avanzado, no epidermoide, con reordenamiento RET [3]. Los pacientes habían recibido antes al menos una quimioterapia. La TRO según el Comité de revisión radiológica independiente se definió como el criterio de valoración principal: De 1.536 pacientes sometidos al proceso de selección, 34 (2 %) tenían fusión RET. De ellos, 19 pacientes constituyeron la población por IT. En este grupo, la TRO fue del 47 % con vandetanib, y se logró el control de la enfermedad en el 90 % de los pacientes. Las respuestas se mantuvieron durante 5,6 meses. La mediana de la SSP fue de 4,7 meses, y el 47 % de los pacientes estaban vivos al cabo de 1 año.
Según análisis exploratorios de subgrupos, el tipo de fusión RET constituyó una diferencia, ya que los pacientes con CCDC6-RET (n = 6) parecieron beneficiarse en mayor medida del tratamiento con vandetanib que los pacientes con KIF5B-RET (n = 10) en lo que respecta a la TRO (83 % y 20 %, respectivamente), la mediana de la SSP (8,3 y 2,9 meses) y la SG al cabo de 1 año (67 % y 42 %). El perfil de seguridad se correspondió con la experiencia previa con vandetanib. Los principales AA fueron la hipertensión arterial, la diarrea y la erupción acneiforme.
Los autores llegaron a la conclusión de que vandetanib tiene actividad antitumoral clínica en pacientes con CPNM avanzado y reordenamiento RET, aunque ahora se requieren amplios programas de detección sistemática. Uno de estos programas es un proyecto nacional de cribado genómico denominado LC-SCRUM-Japan. Este programa se inició en Japón en conjunción con este estudio e implica la identificación de los reordenamientos RET utilizando RT-PCR múltiple y un análisis de FISH con sondas de separación. Hasta agosto de 2016 estaban participando más de 200 centros y 14 empresas farmacéuticas en el LC-SCRUM-Japan.
Lenvatinib en tumores RET-positivos
El inhibidor oral de multicinasas lenvatinib va dirigido a VEGFR, FGFR y PDGFR-α, así como a los protoncogenes RET y KIT. En 2015 se aprobó lenvatinib para el tratamiento del cáncer tiroideo diferenciado resistente al yodo radiactivo. Dado que la cinasa RET es un objetivo de lenvatinib, este parecería ser una opción terapéutica para los pacientes con adenocarcinoma de pulmón RET-positivo.
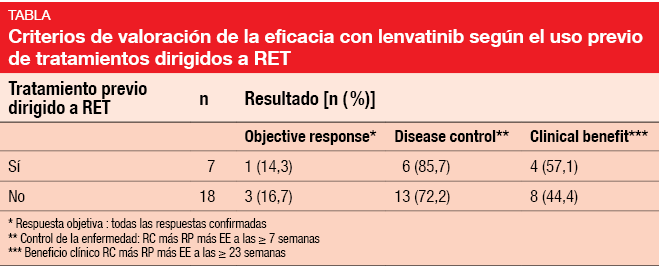
De hecho, un estudio preliminar de la eficacia en fase II, abierto e internacional, presentado en el Congreso de la ESMO demostró una prometedora actividad clínica de lenvatinib 24 mg/día en 25 pacientes con CPNM RET-positivo [4]. Los pacientes habían recibido anteriormente un máximo de tres tratamientos sistémicos; se procedió a incluir caso por caso a los pacientes con más de tres tratamientos. La TRO se definió como el criterio de valoración principal y se observó en el 16 %; todas las respuestas fueron respuestas parciales confirmadas. Se logró el control de la enfermedad (RC más RP más EE a las ≥ 7 semanas) en el 76 % y un efecto clínico beneficioso (RC más RP más EE a las ≥ 23 semanas) en el 48 %. El tumor se redujo en la mayoría de los pacientes. Es importante señalar que los pacientes mostraron similares TRO, tasas de control de la enfermedad y tasas de beneficio clínico con independencia de que hubieran recibido antes tratamiento dirigido al RET con cabozantinib o vandetanib (Tabla). La mediana de la SSP fue de 7,3 meses.
En la mayoría de los pacientes, los efectos tóxicos de lenvatinib se pudieron tratar modificando las dosis. Los AA más frecuentes fueron hipertensión arterial, náuseas, disminución del apetito, diarrea, proteinuria y vómitos. Estos datos respaldan la realización de nuevos estudios con lenvatinib en el tratamiento del adenocarcinoma de pulmón RET-positivo.
BIBLIOGRAFÍA
- Shaw AT et al., Crizotinib in ROS1-arranged non-small-cell lung cancer. N Engl J Med 2014; 371: 1963-1971
- Shaw AT et al., Crizotinib in advanced ROS1-rearranged non-small cell lung cancer (NSCLC): updated results from PROFILE 1001. ESMO 2016, abstract 1206PD
- Horiike A et al., Phase 2 study of vandetanib in patients with advanced RET-rearranged non-small cell lung cancer (NSCLC). ESMO 2016, abstract 1203PD
- Velcheti V et al., Phase 2 study of lenvatinib in patients with RET fusion-positive adenocarcinoma of the lung. ESMO 2016, abstract 1204PD