Tratamiento dirigido al EGFR: en el momento adecuado en el paciente adecuado
Cerca del 11 % de los pacientes de raza blanca con CPNM tienen tumores con mutaciones de EGFR [1], que se producen en los exones 18, 19, 20 y 21 del gen EGFR. Entre las mutaciones habituales se encuentran las deleciones de marco de lectura en el exón 19 y la mutación puntual Leu858Arg en el exón 21 (L858R) [2]. Se sabe que las inserciones en el exón 20 intervienen en la resistencia [3]. Se dispone de pocos datos sobre las otras mutaciones menos frecuentes.
Las mutaciones activadoras de EGFR sensibilizan a los tumores pulmonares a los tratamientos con inhibidores de la tirosina cinasa (ITK) de EGFR. El bloqueante irreversible de la familia ErbB denominado afatinib y los ITK reversibles del EGFR gefitinib y erlotinib han sido aprobados como tratamiento de primera línea para pacientes con CPNM avanzado con mutación EGFR-positiva. El estudio en fase IIB LUX-Lung 7 es el primer ensayo prospectivo, internacional y aleatorizado en el que se comparan dos tratamientos dirigidos al EGFR (afatinib, gefitinib) de forma directa en este contexto. Se aleatorizó a 319 pacientes con adenocarcinoma de pulmón en estadio IIIB/IV y mutación de EGFR que no habían recibido antes ningún tratamiento por enfermedad avanzada o metastásica para recibir afatinib 40 mg/día o gefitinib 250 mg/día. Según el análisis principal, cuando se comparó con gefitinib, afatinib mejoró significativamente los criterios de valoración principales de la SSP (hazard ratio [HR], 0,73; p = 0,017) y el tiempo hasta el fracaso del tratamiento (TTF; HR, 0,73; p = 0,007) [4]. En correspondencia, la TRO fue significativamente superior en el grupo de afatinib (p = 0,008).
LUX-Lung 7: Análisis de la SG y otros resultados actualizados
En el Congreso de la ESMO, Paz-Ares y cols. presentaron el análisis principal de la SG en LUX-Lung 7, que mostró una diferencia de 3 meses entre estos dos ITK a favor de afatinib (27,9 frente a 24,5 meses), aunque esta diferencia no alcanzó significación estadística (HR, 0,86; p = 0,2580) [5]. La mayoría de los subgrupos especificados de antemano obtuvieron un efecto beneficioso mayor en la SG con afatinib que con gefitinib. La mediana de la SG con afatinib fue similar en todos los subgrupos de edad. Asimismo, los análisis de la SG según el subtipo de mutación fueron favorables a afatinib tanto en los pacientes con deleción 19 como en los pacientes con mutación L858R, aunque sin alcanzar significación estadística. El 46 % del grupo de afatinib y el 56 % del grupo de gefitinib recibieron posteriormente ITK de EGFR. En los pacientes tratados con un ITK de EGFR subsiguiente de tercera generación, la mediana de la SG fue similar con afatinib y gefitinib.
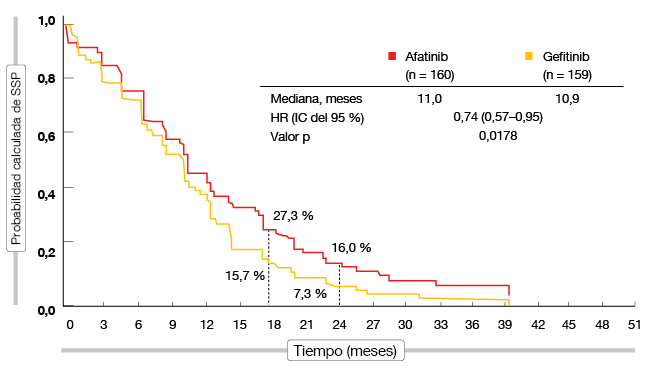
Los resultados actualizados de la SSP y la TRO fueron concordantes con los datos iniciales. Con respecto a gefitinib, afatinib mejoró significativamente la SSP ([11,0 frente a 10,9 meses; HR, 0,74; p = 0,0178; Figura) y la TRO (73 % frente al 56 %; p = 0,002). A los 24 meses, las tasas de SSP fueron del 16,0 % y del 7,3 %. En los pacientes con la mutación L858R, la TRO fue significativamente favorable a afatinib (69 % frente al 42 %; p = 0,003), mientras que en los pacientes con deleción 19, afatinib tuvo una ventaja numérica en la TRO (75 % frente al 66 %; p = 0,150). Los AA fueron previsibles y tratables, y ambos ITK mostraron tasas igualmente bajas de suspensión del tratamiento. Los datos actualizados de calidad de vida se mantuvieron semejantes entre los grupos. Los investigadores llegaron a la conclusión de que los datos globales, que eran muy positivos en múltiples criterios de valoración clínicamente relevantes, indican que afatinib es una opción terapéutica más eficaz que gefinitb en el contexto de primera línea.
Figura: Supervivencia sin progresión según la revisión independiente de los datos con afatinib comparado con gefitinib en el LUX-Lung 7
TTF en LUX-Lung 7
Schuler y cols. publicaron los resultados referentes al criterio de valoración coprincipal del tiempo hasta el fracaso del tratamiento (TTF), elegido para reflejar la práctica clínica real y las directrices de tratamiento [6]. El TTF se definió como el tiempo transcurrido desde la aleatorización hasta el momento de suspensión del tratamiento por cualquier causa, como progresión de la enfermedad, toxicidad del tratamiento y muerte. Los pacientes podían continuar con el tratamiento después de la progresión si el médico lo consideraba beneficioso. El 35 % de los pacientes del grupo de afatinib y el 29,6 % de los del grupo de gefitinib que obtuvieron un efecto clínico beneficioso continuaron el tratamiento con el ITK después de la progresión radiológica, con medianas de 2,7 y 2,0 meses de duración, respectivamente.
En la población global de LUX-Lung 7, afatinib se caracterizó por un TTF superior en comparación con gefitinib (13,7 frente a 11,5 meses; HR, 0,73; p = 0,0073). Estos efectos beneficiosos en el TTF fueron en general constantes en los subgrupos especificados de antemano (es decir, tipo de mutación EGFR, presencia de metástasis cerebrales, estado funcional basal del ECOG, sexo, edad, origen étnico, antecedentes de tabaquismo). El porcentaje de pacientes sin fracaso del tratamiento fue significativamente mayor en el grupo de afatinib a los 24 meses (25 % frente al 13 %) y a los 30 meses (15 % frente al 5 %).”
Estos resultados son complementarios de los referentes a la SSP y la TRO en LUX Lung 7. Según los autores, la mejora del TTF con afatinib demuestra su tolerabilidad general y la naturaleza tratable de los AA asociados e indica que este fármaco puede aportar efectos beneficiosos clínicos adicionales a los pacientes que continúan con el tratamiento después de la progresión radiológica de la enfermedad.
Estratificación VeriStrat® de los pacientes tratados con afatinib
En el estudio en fase III, internacional y abierto LUX-Lung 8, se comparó afatinib con erlotinib en pacientes con CPNM epidermoide en estadio IIIB/IV que había progresado después de quimioterapia doble con platino como tratamiento de primera línea. En este ensayo, afatinib mejoró significativamente la SG, la SSP y la tasa de control de la enfermedad (TCE) en comparación con erlotinib [7].
Goss y cols. evaluaron el valor predictivo de la prueba de proteína sérica VeriStrat® en LUX-Lung 8, utilizando la SG como variable principal de la eficacia [8]. VeriStrat® se puede utilizar para identificar las respuestas de los pacientes al tumor mediante la medición de varias proteínas reactantes de fase aguda en la sangre. En este análisis se clasifica a los pacientes según un algoritmo diferenciado de clasificación que distingue entre ‘bueno’ (VS-G) y ‘malo’ (VS-P). Se analizaron los resultados clínicos con respecto al estado Veristrat® del paciente en la población global y en los subgrupos predefinidos. Se obtuvieron resultados de 675 muestras de pacientes. De ellos, 412 y 263 entraron en las categorías de VS-G y VS-P, respectivamente.
Se ha demostrado que el análisis VeriStrat® tiene un pronunciado efecto de estratificación independiente en estos pacientes tratados con afatinib. En el grupo de VS-G, en comparación con erlotinib, afatinib produjo mejorías significativas de la SG (11,5 frente a 8,9 meses; HR, 0,79) y SSP (3,3 frente a 2,0 meses; HR, 0,73). En el grupo de VS-P, por otra parte, la SG y la SSP no mostraron diferencias significativas entre estos dos ITK. Los pacientes que recibieron afatinib experimentaron efectos beneficiosos significativos en la SG y la SSP en el grupo de VS-G frente al grupo de VS-P (p < 0,0001 para cada uno). El análisis multivariante demostró que VeriStrat ®era un factor de predicción independiente de la SG y la SSP en estos pacientes tratados con afatinib, con independencia del estado funcional del ECOG, de la mejor respuesta al tratamiento de primera línea, de la etnia y de la edad. Sin embargo, no hubo una interacción significativa entre la clasificación VeriStrat® y el grupo de tratamien-
to en lo que respecta a la SG o la SSP.
Datos de la práctica real sobre afatinib en líneas posteriores
El programa de uso compasivo (NPU), que se inició en mayo de 2010, proporciona datos de la vida real sobre el uso de afatinib en la práctica clínica global [9]. Los criterios de elegibilidad eran CPNM avanzado o metastásico, progresión después del efecto clínico beneficioso con erlotinib/gefitinib o presencia de una mutación activadora de EGFR/HER2, agotamiento de todas las demás opciones de tratamiento y falta de elegibilidad para la incorporación activa a ensayos con afatinib.
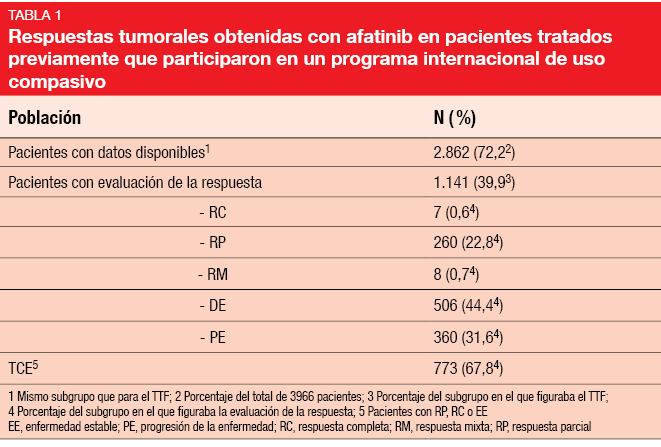
Hasta enero de 2016 se disponía de datos de 3966 pacientes con CPNM procedentes de 41 países de seis continentes. Los pacientes habían recibido antes numerosos tratamientos. Cerca del 50 % recibió afatinib como tratamiento de cuarta línea o posterior.
La mediana del TTF fue de 4,4 meses en todos los pacientes con datos disponibles. Se obtuvieron datos semejantes sobre el TTF en los pacientes con cualquier mutación de EGFR, mutaciones de EGFR frecuentes o poco frecuentes y mutaciones de HER2. La TRO fue del 23,4 % en todos los pacientes, con una TCE del 67,8 % (Tabla 1). Hay que destacar que los pacientes con cualquier mutación de EGFR y los pacientes con mutaciones de EGFR frecuentes y poco frecuentes mostraron TRO semejantes. Se observaron tasas de respuesta del 19 % y del 35 % en los pacientes con CPNM que albergaban las mutaciones T790M y de inserción en el exón 20, respectivamente. En el programa NPU no se obtuvieron datos nuevos o inesperados sobre la seguridad.
Efectos en pacientes con enfermedad leptomeníngea
El sistema nervioso central (SNC) es un foco de recidiva frecuente en los pacientes con CPNM, probablemente por la escasa penetración de los fármacos en el SNC. Se observó que las tasas de concentración en el líquido cefalorraquídeo (LCR) de los ITK de EGFR gefitinib y erlotinib eran bajas [10]. Sin embargo, el análisis combinado de los pacientes con metástasis cerebrales en los ensayos LUX-Lung 3 y 6 indica que afatinib actúa en el cerebro [11].
Como señalaron Tamiya y cols. en su ensayo multicéntrico y prospectivo en el que participaron 11 pacientes con CPNM EGFR-positivo y carcinomatosis leptomeníngea [12], el tratamiento con afatinib en la dosis diaria recomendada de 40 mg tiene una mediana de penetración en el líquido cefalorraquídeo (LCR) mayor que la publicada anteriormente. Las medianas de las concentraciones en sangre y LCR fueron de 88,2 ng/ml y 1,4 ng/ml, respectivamente, y la mediana de la tasa de penetración en el LCR, del 1,65 %. En conjunto, las medianas de la SSP y SG fueron de 2,0 y 3,8 meses, respectivamente. En particular, los pacientes portadores de mutaciones de EGFR poco frecuentes parecieron obtener un efecto beneficioso con afatinib en lo que respecta a los criterios de valoración clínicos.
IMPRESS: el mantenimiento de gefitinib tiene efectos perjudiciales
Después de la progresión durante el tratamiento con ITK del EGFR, se señaló que el mantenimiento de este tratamiento en combinación con quimioterapia doble a base de platino era beneficioso debido a la posible heterogeneidad del tumor en el momento de la resistencia. Esto motivó el diseño del ensayo IMPRESS. IMPRESS fue el primer estudio multinacional y aleatorizado en fase III en el que se investigó la aplicación continua de gefitinib más quimioterapia comparación con la quimioterapia sol en pacientes con CPNM avanzado y mutación de EGFR que habían adquirido resistencia al tratamiento de primera línea con gefitinib después de la respuesta inicial. El análisis principal ya había demostrado la ausencia de diferencias estadísticamente significativas entre las dos estrategias en lo que respecta a la SSP, la TRO y la TCE [13].
En concordancia con el análisis preliminar de la SG, los datos finales de la SG demostraron una inferioridad significativa de la combinación de gefitinib [14]. La mediana de la SG fue de 13,4 meses en el grupo de gefitinib y de 19,5 meses en el grupo de control, lo que se tradujo en un aumento del riesgo de mortalidad de casi el 50 % con la adición de gefitinib (HR, 1,44; p = 0,016). Además, en todas las categorías de subgrupos el resultado estuvo a favor del tratamiento exclusivo con quimioterapia. Una mayor proporción de los pacientes del grupo de quimioterapia sola recibieron ITK de EGFR después de suspenderla, lo que podría haber contribuido a su supervivencia más prolongada.
Análisis exploratorios de biomarcadores en plasma indicaron que esta disminución de la SG asociada al mantenimiento de gefitinib se debe a un estado T790M-positivo. En el subgrupo con T790M-positivo, la mediana de la SG fue de 10,8 y 14,1 meses con gefitinib y con quimioterapia sola, respectivamente (HR, 1,49). No obstante, los resultados del subgrupo de T790M-negativo no fueron concluyentes. Aquí es preciso ser cautos, porque el estado de T790M según el ADN tumoral circulante no siempre es informativo. Los autores llegaron a la conclusión de que es necesario suspender este tratamiento con ITK de EGFR de primera generación en el momento de la progresión radiológica de la enfermedad debido al riesgo de disminución de la supervivencia observado con la continuación del tratamiento. En los pacientes con estado de T790M positivo se debe valorar el tratamiento con ITK de EGFR de tercera generación.
Actividad de gefitinib y erlotinib en mutaciones poco frecuentes
En un metanálisis se investigó la eficacia de los ITK de EGFR de primera generación gefitinib y erlotinib en pacientes con mutaciones de EGFR poco frecuentes (S768I, L861Q, G719X, R705K y otras) [15]. De los 6404 pacientes de los 13 ensayos incluidos, 466 (7,3 %) fueron diagnosticados de mutaciones EGFR poco frecuentes. Estos pacientes habían recibido gefitinib y erlotinib como cualquier línea de tratamiento.
En la síntesis de grupo único, las TRO globales de las mutaciones poco frecuentes y frecuentes fueron del 34 % y del 71 %, respectivamente. Las comparaciones directas indicaron respuestas significativamente menores en los pacientes con mutaciones poco frecuentes (razón de posibilidades, 0,30). Asimismo demostraron una menor tasa de SSP a los 6 meses (razón de posibilidades, 0,44; p < 0,001). No obstante, las TRO fueron todavía elevadas, sobre todo en mutaciones complejas, es decir, mutaciones en dos o más lugares mutantes poco frecuentes (64,2 %). Los autores afirmaron, por tanto, que los ITK de EGFR de primera generación siguen siendo una opción para el tratamiento de los pacientes con mutaciones poco frecuentes, aunque es necesario meditar la decisión. Las eficacias relativas relacionadas con cada lugar de mutación merecen futuros estudios con muestras de mayor tamaño.
Mutaciones de EGFR: características en una amplia cohorte francesa
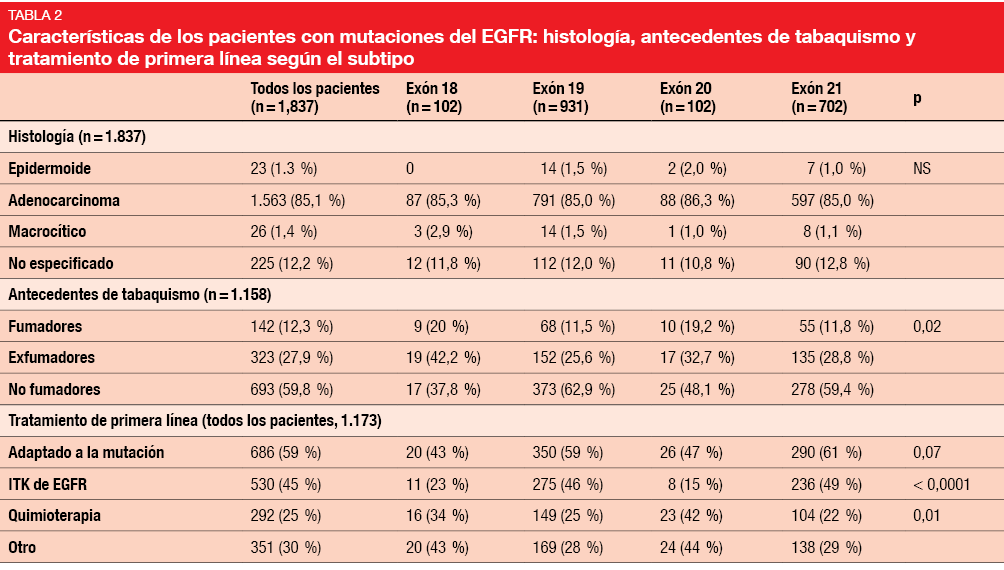
Dado que las diferentes propiedades moleculares de los subtipos de mutación de EGFR podrían afectar a las respuestas del EGFR a los ITK y a los resultados de los pacientes, en un estudio complementario observacional del programa nacional francés “Biomarkers France” se evaluaron las características de los tumores de pulmón no microcíticos que portan mutaciones de EGFR basándose en 18.679 análisis que representaban a 17.664 pacientes [16]. Después de excluir el EGFR natural y la mutación T790M, se analizó a 1.837 pacientes con mutaciones de EGFR.
El 52 % y el 38 % tenían mutaciones en el exón 19 y el exón 21, respectivamente. Se observaron mutaciones en el exón 18 y el exón 20 en el 5 % cada una. Dos tercios de los pacientes eran mujeres, y el 85,1 % tenía un adenocarcinoma (Tabla 2). El 60 % de los pacientes con mutaciones en el exón 19 y en el exón 21 no habían fumado nunca, pero estas proporciones fueron menores en las poblaciones con mutaciones no frecuentes. Los pacientes con mutaciones en el exón 19 y el exón 21 tuvieron más probabilidades de recibir tratamiento con ITK de EGFR de primera línea que los otros dos grupos.
BIBLIOGRAFÍA
- Barlesi F et al., Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016; 387(10026): 1415-1426
- Riely GJ et al., Update on epidermal growth factor receptor mutations in non-small cell lung cancer. Clin Cancer Res 2006; 12(24): 7232-7241
- Beau-Faller M et al., Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol 2014; 25(1): 126-131
- Park K et al., Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17: 577-589
- Paz-Ares L et al., Afatinib versus gefitinib in patients with EGFR mutation-positive NSCLC: overall survival data from the phase IIb trial LUX-LUNG 7. ESMO 2016, LBA43
- Schuler M et al., Time-to-treatment failure with first-line afatinib versus gefitinib in patients with EGFR mutation-positive advanced NSCLC: randomised phase IIb LUX-Lung 7 trial. ESMO 2016, abstract 1230P
- Soria JC et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16: 897-907
- Goss GD et al., Evaluation of VeriStrat®, a serum proteomic test, in the randomised, open-label, phase III LUX-Lung 8 trial of afatinib versus erlotinib for the second-line treatment of advanced squamous cell carcinoma of the lung. ESMO 2016, abstract 1238P
- Cappuzzo D et al., Global named patient use programme of afatinib, an oral ErB family blocker, in heavily pretreated advanced NSCLC patients who progressed following prior therapies, including erlotinib or gefitinib. ESMO 2016, abstract 1236P
- Togashi Y et al., Cerebrospinal fluid concentration of gefitinib and erlotinib in patients with non-small cell lung cancer. Cancer Chemother Pharmacol 2012; 70: 399-405
- Schuler M et al., First-Line Afatinib versus Chemotherapy in Patients with Non-Small Cell Lung Cancer and Common Epidermal Growth Factor Receptor Gene Mutations and Brain Metastases. J Thorac Oncol 2016; 11: 380-390
- Tamiya A et al., Afatinib efficacy and cerebrospinal fluid concentration in NSCLC patients with EGFR mutations developing leptomeningeal carcinomatosis. ESMO 2016, abstract 1241P
- Soria JC et al., Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS): a phase 3 randomised trial. Lancet Oncol 2015; 16(8): 990-998
- Soria JC et al., Gefitinib/chemotherapy versus chemotherapy in EGFR mutation-positive NSCLC after progression on first-line gefitinib (IMPRESS study): final overall survival analysis. ESMO 2016, abstract 1201O
- Zhang Y et al., Efficacy of first-generation EGFR-TKIs in patients with NSCLC harbouring EGFR uncommon mutations: a pooled analysis. ESMO 2016, abstract 1231P
- Leduc C et al., Clinical and molecular characteristics of non-small cell lung cancer (NSCLC) harbouring EGFR mutations. ESMO 2016, abstract 1202O
REFERENCES
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- Chen L et al., Metastasis is regulated via microRNA-200/ZEB1 axis control of tumour cell PD-L1 expression and intratumoral immunosuppression. Nat Commun 2014; 5: 5241
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer (NSCLC): clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Kwiatkowski DJ et al., Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): interim analysis and biomarker data from a multicenter study (LCMC3). J Clin Oncol 37, 2019 (suppl; abstr 8503)
- Provencio M et al., Neo-adjuvant chemo-immunotherapy for the treatment of stage IIIA resectable non-small-cell lung cancer (NSCLC): a phase II multicenter exploratory study. Final data of patients who underwent surgical assessment (NADIM). J Clin Oncol 37, 2019 (suppl; abstr 8509)
- Kenmotsu H et al., Randomized phase III study of pemetrexed/cisplatin versus vinorelbine/cisplatin for completely resected non-squamous non-small-cell lung cancer. The JIPANG study. J Clin Oncol 37, 2019 (suppl; abstr 8501)
- Tang W et al., EGFR inhibitors as adjuvant therapy for EGFR mutation positive non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 8508)
- Khalil M et al., The tumor microenvironment in EGFR-driven loco-regional lung adenocarcinoma can predict higher risk of recurrence. J Clin Oncol 37, 2019 (suppl; abstr 8521)
- Chaft JE et al., Randomized phase II study of adjuvant afatinib for 3 months versus 2 years in patients with resected stage I-III EGFR mutant NSCLC. J Clin Oncol 37, 2019 (suppl; abstr 8507)
- Moding EJ et al., ctDNA for personalization of consolidation immunotherapy in localized non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 2547)
© 2019 Springer-Verlag GmbH, Impressum