免疫チェックポイント遮断:治療成功の成功のカギを握る要素
PD-L1発現以外にもさまざまな臨床的要素が、免疫チェックポイント阻害の有効性の予測因子として検討されている。特に、非小細胞がんでは非喫煙とPD-1経路遮断に対する反応の低さとに関連性があることを複数の解析が示している[1,2]。非喫煙者または軽度喫煙者の肺がんは一般に低TMBを示すことが一つの説明となる[3]。喫煙曝露が大きくなるにつれて、メガベースあたりの突然変異の数も同様に増加する。TMBは、免疫チェックポイント阻害薬の独立した予測バイオマーカーとして確立しており、高TMBのほうが高い効果がみられる[4,5]。
レトロスペクティブ・レビューでは、Gainor らは進行非小細胞肺がんとPD-L1高発現(TPS≧50%)を有する非喫煙者または軽度喫煙者のPD-(L)1阻害の役割を探った[6]。これは今日まで明らかにされていない。というのも、無作為化試験への非喫煙者・軽度喫煙者の登録が少ないことや、一次治療としてのPD-L(1)阻害薬の臨床試験では、遺伝子サブセット(EGFRやALK遺伝子変異)は通常除外されてしまうためである。全体で、4施設にてチェックポイント阻害剤で治療された283人の患者を評価した。そのうち69人は、非喫煙者または軽度喫煙者であり、33人は非喫煙者(生涯に喫煙したタバコの本数が100本以下)、軽度喫煙者は36人であった(1年で10箱未満の喫煙;中央値1.13)。患者の大部分は、一次治療にPD-(L)1阻害剤を投与された。
喫煙習慣がもたらすDORの影響
非喫煙者または軽度喫煙者における最も一般的な発がん性ドライバー遺伝子変異には、KRAS、EGFRの遺伝子変異ならびにMET エクソン14スキップ変異がある。PD-L1発現は、非喫煙者または軽度喫煙者と重度喫煙者では変わりはなかった。TMBは喫煙状況に基づいて評価された。TMBは予想通り、非喫煙者と軽度喫煙者(4.1 mut / Mb; p = 0.002)よりも、重度喫煙者(8.2 mut / Mb)において高く、TMB中央値は非喫煙者または軽度喫煙者では同等であった。
抗PD-(L)1治療の抗腫瘍活性において、非喫煙者、軽度喫煙者、重度喫煙者の間で統計的に大きなORRの差はなかった(31.9 % vs 39.6 %; p = 0.386)。 ベースラインで測定可能な疾患を有する24人の非喫煙者では、ORRは統計的に有意ではなかったが、数値的に25%低かった。治療は複数の発がん性ドライバー変異に対して効果があったものの、EGFR遺伝子変異非小細胞肺がんを有する患者の場合、8人の患者のうち1人のみ(12.5%)、KRAS遺伝子変異を有する患者の場合は、11人のうち4人(36.3%)であった。しかし、今回は治験患者数が少ないことから、これらの結果は慎重に検討されるべきである。TMBは、非喫煙者と軽度喫煙者のチェックポイント阻害剤に影響しなかった。PFS解析では、重度喫煙者に有利な傾向がわずかにみられた(非喫煙者と軽度喫煙者4.8 ヶ月vs 3.29 ヶ月;HR, 1.32; p = 0.105)。
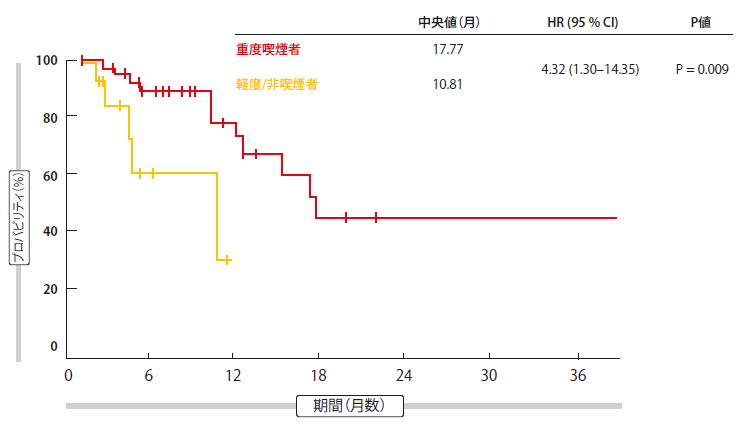
しかし、非喫煙者・軽度喫煙者と比較して、ORRは同等であったにかかわらず、重度喫煙者のDORに有意な改善が観察さたのは目を引く結果である(17.77ヶ月vs. 10.81 ヶ月; HR 4.32; p = 0.009;図1)。著者らは、奏効の持続性と初期効果を左右する免疫学的特徴は全く異なるとまとめた。PD-(L)1単剤療法のDORがより短いことを考えると、化学療法+PD-1の併用は、PD-L1高発現の非喫煙者と軽度喫煙者において考慮されるべきである。
図1:重度喫煙者vs 軽度/非喫煙者における有意に延長された奏効期間
ベースラインとしてのステロイド使用効果
コルチコステロイドは、がん治療によく使用されており、多くのがん関連症状の急速な軽減をもたらし、免疫関連のAE治療の主流となっている。この場合、ステロイドは免疫チェックポイント遮断の活性を減少させるようにはみえない。しかし、ベースラインでステロイドを受けた患者のPD-(L)1阻害剤の有効性は、免疫療法を調べる臨床試験に適格でなかったため、未知であった。
Arbour らは、ベースラインでステロイド(プレドニゾン10mg以上または同等の薬剤治療1日目)を受けている患者のPDK-1阻害剤の有効性を評価する目的で、Memorial Sloan Kettering Cancer Center(MSKCC)およびGustave Roussy Cancer Center(GRCC)においてそれぞれ455人と185人の患者のデータのレトロスペクティブ・レビューを行った[7]。この2施設では、PD-(L)1-阻害療法の開始時に合計90人の患者がステロイドで治療された。
2つの独立したコホートにて活性減少
データは、低ORRなどPD-(L)1遮断にに対するベースラインのステロイド治療の有害な影響を明らかに示した。MSKCCコホートでは、ステロイド群では6%、非ステロイド群では19%に完全および部分奏効がみられた(p = 0.02)。GRCCコホートでも、同様、8 % vs 18 %(p = 0.2)であった。ベースラインとしてステロイドを受けている患者の低PFSアウトカムは、両方のコホートにおいて観察された(MSKCC:HR, 1.7; p <0.0001; GRCC:HR, 1.5; p <0.0001)。同様に、PD-(L)1遮断療法の開始時からのOSは、両施設のステロイド群で有意に低いものであった(MSKCC: HR, 2.1; p <0.0001; GRCC:HR, 2.0; p < 0.001)。両コホートのプールデータを用いたサブグループ解析は、ほぼすべてのサブグループにおいてベースラインとしてステロイド投与を受けている患者のPFSおよびOSアウトカムを悪化させたと示している。もちろん、ステロイドは、脳転移または全身状態の悪い患者のための一時緩和目的で頻繁に使用される。しかし、多変量解析によれば、ベースラインのステロイド使用によるPFSおよびOSのへの悪影響は、陰性の予後変数を調整した後も残っていた。
試験担当医らは、観察された影響が予測できるのか、予後に影響を及ぼすのかは未だ不確実であると指摘した。このような結果をもとに、PD-(L)1阻害療法が計画されている患者にはステロイドの慎重投与を推奨した。がん治療のための非ステロイド使用の検討も検討余地に入るが、医学的に必要と判断されたステロイドは控えられるべきではない(例えば、脳転移の治療のためなど)。この解析では、PD-1阻害剤の単剤療法を取り入れた患者を組み入れたため、化学療法およびチェックポイント阻害剤との併用の影響は不明である。
長期奏効を予測する特徴
抗PD-(L)1療法で得られた奏効は、選択症例では長く続くかもしれないが、長期奏効(LTR)を予測できる特徴はまだ明らかではない。このため、Rizvi らは、
2011年から2016年までMSKCCで抗PD-(L)1療法を受けた進行性非小細胞肺がん患者766人を解析した[8]。
LTRは、18ヶ月以上持続するPFSとして定義され、62人の患者にみられた(総コホートの8%)。これらのうち、47人(76%)が完全または部分奏効を達成し、15人(24%)の疾患が安定した。解析の時点で、68%は無増悪のままで
あった。
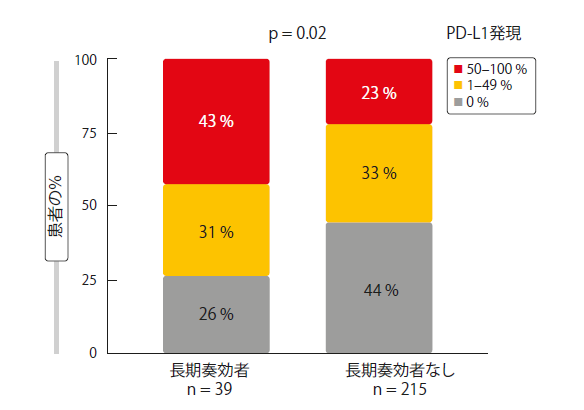
LTRの典型的な特徴 を同定した。長期奏効者(LTR)は、LTRでない患者よりも有意に高いTMBを有し(12.24 vs. 6.34 mut/Mb; p < 0.001)、PD-L1高発現の患者の割合はより高いものであった(p = 0.02; 図 2)。さらに、喫煙経験者はLTR患者の大多数を占めていたが、非喫煙者ではそうではなかった。 非LTR患者では、よりバランスがとれていた。解析では、この点で両群の間に有意な差が生じた。(p = 0.03)EGFR遺伝子変異はLTRと負の関連を示した。長期奏効者にEGFR遺伝子変異を有している者はおらず、非LTR患者では12%であった。(p = 0.002)
長期および短期奏効者の直接比較により、PD-L1発現ではなく、TMBが両群で有意に異なることが明らかになった。また、奏効の深さはLTRと相関するが腫瘍負荷とは相関しないことが示された。ベースラインでの腫瘍負荷は、長期および短期の奏効者において同様であった。
持続奏効を予測する特徴は、バイオマーカーが焦点を当てている初期奏効を予測する特徴と実際には異なることがあると結論付けた。
図2:LTR患者におけるPD-L1高発現のより高い割合
参考文献
- Borghaei H et al., Nivolumab versus docetaxel in advanced non-squamous non-small cell lung cancer.N Engl J Med 2015; 373(17): 1627-1639
- Gainor JF et al., EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis.Clin Cancer Res 2016; 22(18): 4585-4593
- Gibbons DL et al., Smoking, p53 mutation, and lung cancer.Mol Cancer Res 2014; 12(1): 3-13
- Rizvi H et al., Molecular determinants of response to anti-programmed cell death (PD)-1 and anti-programmed death-ligand 1 (PD-L1) blockade in patients with non-small-cell lung cancer profiled with targeted next-generation sequencing.J Clin Oncol 2018; 36(7): 633-641
- Hellmann M et al., Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden.N Engl J Med 2018; 378(22): 2093-2104
- Gainor JF et al., Response and durability of checkpoint blockade in never- or light-smokers with NSCLC and high PD-L1 expression.J Clin Oncol 36, 2018 (suppl; abstr 9011)
- Arbour KC et al., Deleterious effect of baseline steroids on efficacy of PD-(L)1 blockade in patients with non-small cell lung cancer.J Clin Oncol 36, 2018 (suppl; abstr 9003)
- Rizvi H et al., Clinical and molecular features predicting long-term response (LTR) to anti-PD-(L)1 based therapy in patients with NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 9022)
More posts
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング 肺がんの早期発見は、未だ医学において解決されていない。低線量コンピュータ断層撮影法(LDCT)は、高
小細胞がんの治療に関する最新ベンチマーク
小細胞がんの治療に関する最新ベンチマーク KEYNOTE-158 進展型小細胞肺がん(ED-SCLC)は一次治療によく反応するが、早期再発も多く起こり、予後は不良である。今
16 ALK陽性疾患:治療の可能性が広がる
16 ALK陽性疾患:治療の可能性が広がる ALEX試験で確認されたアレクチニブのCNSおよび非CNSの有効性 ALK陽性進行非小細胞肺がん患者の標準治療には、第1世代AL
「シーケンシングの課題」
「シーケンシングの課題」 インタビューカナダ、バンクーバー Barbara Melosky、MD、FRCPC、University of British Columbia
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ エルロチニブ+ベバシズマブ EGFR TKI治療は、進行性EGFR遺伝子変異陽性の非小細胞肺がん患者のための標準
免疫チェックポイント遮断:治療成功の成功のカギを握る要素
免疫チェックポイント遮断:治療成功の成功のカギを握る要素 PD-L1発現以外にもさまざまな臨床的要素が、免疫チェックポイント阻害の有効性の予測因子として検討されている。特に