免疫疗法:再次处于进步前沿
PACIFIC:
III期NSCLC中的durvalumab
约三分之一的非小细胞肺癌(NSCLC)患者会出现III期局部晚期疾病。对于具有良好表现状态且不可切除肿瘤的患者,治疗标准为铂类双化疗伴随并行放疗。由于多年来对于该种环境没有发生重大进展,因此对于延长生存期的新型治疗途径存在显著的未满足需求。考虑到检查点抑制剂在转移性疾病中的功效,启动了全球性双盲PACIFIC试验作为首个随机化III期研究,用于评估III期、局部晚期、不可切除NSCLC患者的免疫检查点阻断。
PACIFIC在接受至少两个周期的根治性铂类伴随放化疗后未进展的患者中评估PD-L1抑制剂durvalumab。他们被随机分为接受每2周10 mg/kg durvalumab,长达12个月(n = 476)或接受安慰剂(n = 237)。这些患者是在PD-L1表达状态方面没有任何限制的全体参与人群。每组中的一半患者分别具有鳞状和非鳞状组织学。大多数患者在放化疗结束时获得部分反应(PR)或病情稳定(SD)。通过盲独立中央审查(BICR)使用RECIST v1.1的无进展生存期(PFS)和总生存率(OS)构成了共同主要终点。
超过11个月的PFS差异
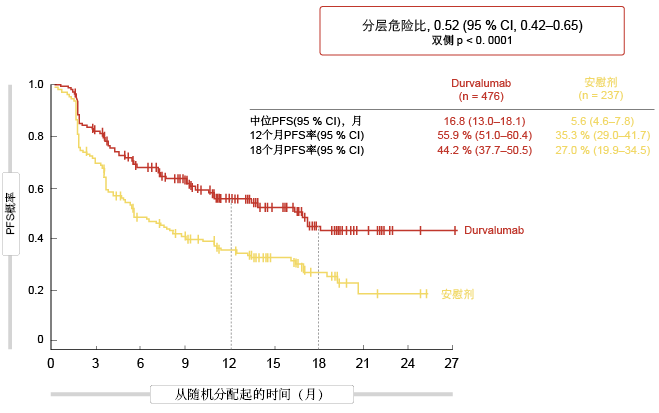
在14.5个月的中位随访期后,在2017年ESMO大会上提出的PFS计划中期分析结果表明,durvalumab是III期环境下有希望的治疗选择[1]。与安慰剂相比,durvalumab表现出统计学显著且强健的PFS获益,其中位数提高了超过11个月(16.8与5.6个月;HR,0.52;p < 0.0001;图1)。PFS曲线在治疗启动后第二个月期间开始分离。无论组织学、放化疗治疗的最佳反应和PD-L1表达状态等特征如何,所有预先设定的亚组均获益于durvalumab治疗,且具有相似的量级。
同样地,durvalumab组的客观反应率(ORR)也获得了临床上有意义程度上的改善(28.4%与16.0%;p< 0.001)。这也适用于反应持续时间
(未达到与13.8个月;HR,0.43)。相应地,任何位点处的新病灶(包括脑转移)在实验组中比安慰剂组中发生的频率均更低(20.4%与32.1%),并且根据BICR达到远端转移或死亡的时间显著延长(23.2与14.6个月;HR,0.52;p < 0.0001)。
durvalumab显示出良好的安全特性,与更晚期疾病的先前报告一致。咳嗽、局限性肺炎、发热、肺炎、皮疹和甲状腺功能减退是最常见的不良事件(AE)。放化疗治疗后未出现新的安全性信号。对于局限性肺炎/放射性肺炎来说,durvalumab组与安慰剂组之间的差异很小(任何级别,33.9%与24.8%)。由于AE停止治疗的患者分别为15%与10%。在24.2%与8.1%的患者中观察到任何级别的免疫相关AE,其中3/4级别事件的比例较低(3.4%与2.6%)。该研究仍未得出OS,因为OS的最终分析将在达到目标死亡人数后进行。
图1: PACIFIC试验中使用durvalumab与安慰剂的无进展生存期
在PD-L1阴性患者中确定atezolizumab活性
随机化OAK [2]和POPLAR [3]试验显示,无论PD-L1表达或组织学如何,在二线及以上使用抗PD-L1抗体atezolizumab治疗与多西他赛(docetaxel)相比均引起临床相关的OS改善。根据OAK的初步分析,atezolizumab和多西他赛的中位OS分别为13.8和9.6个月(HR,0.73;p = 0.0003)[2]。OAK结果的一个明显特征是,atezolizumab改善所有PD-L1表达亚组的OS,包括根据SP142测定PD-L1状态为阴性的患者。在这一组中,OS的HR为0.75,与0.73的总体HR相似,atezolizumab和多西他赛的中位OS分别为12.6与8.9个月。
OAK试验的回顾性探索分析证实,无论PD-L1状态如何,atezolizumab都能在所有患者中提供生存获益,并且无论使用哪种测定都在具有PD-L1阴性肿瘤的患者中表现出OS改善[4]。为此,研究人员比较了两种FDA批准的PD-L1免疫组织化学(IHC)诊断测定SP142和22C3。使用22C3测定回顾性地分析了参与OAK的400名患者的肿瘤的PD-L1表达。将这些结果与原始SP142分析中400个肿瘤生成的PD-L1评分进行了比较。
研究人员发现,绝大多数(77%)SP142 PD-L1阴性患者根据22C3测定也是PD-L1阴性的。根据任一测定,atezolizumab显著改善具有PD-L1阴性肿瘤患者的生存率(使用SP14 2和22C3的HR分别为0.55和0.61)。两种测定均界定为PD-L1阴性的肿瘤患者使用atezolizumab与多西他赛相比显示出改善的OS(9.9与7.7个月;HR,0.63;p=0.0347)。这种OS获益与总体OAK试验结果一致。
基于血液的新型肿瘤突变负荷测定
基于OAK和POPLAR研究的另一分析证明,肿瘤突变负荷(TMB)可在血液中衡量(bTMB),并且bTMB与从免疫检查点抑制剂治疗中获得的PFS改善相关[5]。Gandara等人测试了基于血液的新型bTMB衡量测定,并评估了bTMB和atezolizumab疗效之间的联系。TMB先前在肿瘤组织中测量时显示与NSCLC中atezolizumab的疗效相关[6],但是由于用于分子检测的组织在约三分之一新诊断的NSCLC患者中不足,因此需要替代的诊断材料来源。
使用基于394个基因的下一代测序测定对来自POPLAR和OAK的血浆样品的bTMB进行回顾性评估。来自POPLAR的273个样品中的211个和来自OAK的797个样品中的583个可以进行生物标志物评估,并且构成了该研究的生物标志物可评估群体(BEP)。提取了循环无细胞DNA。计数了具有≥0.5%等位基因频率的所有碱基取代,同时去除了种系多态性和预测的驱动突变。整体而言,这些结果构成了bTMB评分。
在POPLAR研究中,在若干bTMB水平上均观察到PFS和OS增加,但在bTMB≥16的水平处进行的测定最佳(PFS的HR为0.57,OS的HR为0.56)。基于这些数据,在OAK试验中选择bTMB≥16进行验证性分析。bTMB≥16的群体占BEP的27%。
更高的bBMT预测更大的PFS获益
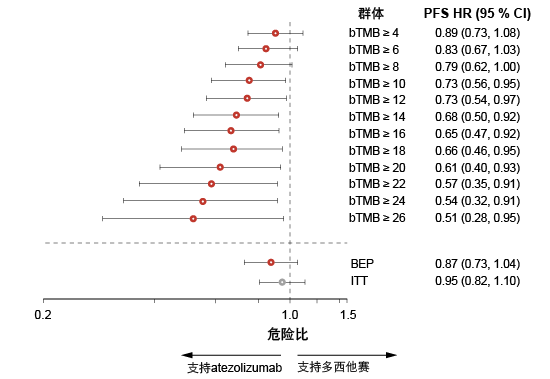
在OAK试验中无总体PFS改善之后,bTMB≥16的亚组使用atezolizumab与多西他赛相比显示出PFS获益。然而,未观察到任何预后作用,因为与bTMB < 16的患者相比,bTMB ≥ 16组中多西他赛治疗的患者未经历任何PFS改善。对于OS,在bTMB ≥ 16和< 16组中相比多西他赛atezolizumab占据优势的危险比类似(分别为0.64和0.65)。这一结果可能反映了进展后后续治疗的影响,尤其是在多西他赛队列中。bTMB≥16亚组使用atezolizumab和多西他赛的中位OS分别为13.5与6.8。探索性分析发现,随着bTMB分界点的提高,PFS获益呈线性增长(图2)。对于OS,这种效果有所减轻。根据对基线特征与bTMB亚组之间相关性的分析,较高的bTMB评分与吸烟有关。如通过最长直径或转移性位点数之和所测量,bTMB和临床肿瘤体积之间也可能存在关联。
基于组织的TMB测定与bTMB相比产生了64%的正百分比一致性(PPA)和88%的负百分比一致性(NPA)(Spearman相关性,0.59)。相对较低的PPA可能受到诸如肿瘤异质性、不同计算方法和不同样本采集时间等因素的影响。当使用相同的循环肿瘤DNA时,PPA和NPA得到改善,并支持使用bTMB ≥ 16的分界点。另一个问题与bTMB ≥ 16与PD-L1表达之间的潜在相关性有关。这里,重叠不显著,229名患者中仅30名同时显示出bTMB ≥ 16评分和通过IHC测量的最高水平PD-L1表达。
正如作者所总结,bTMB对于缺乏用于分子测试足够组织的高达30%的患者可能特别有用。在一线环境下使用bTMB测定的前瞻性研究正在进行中。
图2: OAK中随着bTMB分界点不断提高的atezolizumab增量PFS获益
CheckMate 017和057的三年随访
基于全球随机化开放标签的CheckMate 017 [7]和CheckMate 057 [8] III期试验,抗PD-1抗体纳武单抗已在许多国家被批准用于在化疗期间或之后治疗具有晚期NSCLC和疾病进展的患者。CheckMate 017在鳞状组织学患者中研究了纳武单抗,而CheckMate 057则包括非鳞状NSCLC患者。与多西他赛相比,两项试验在纳武单抗组中均显示出显著改善的OS和良好的安全特性。Felip等人基于至少三年的随访,提供了来自CheckMate 017和CheckMate 057的更新疗效和安全性数据[9]。
纳武单抗继续表现出长期获益,两项试验中的OS和PFS曲线均稳定。CheckMate 017中的3年OS率对于纳武单抗和多西他赛分别为16%与6%。在CheckMate 057中,该值为18%与9%。众所周知,PD-L1表达预测了包含在CheckMate 057中非鳞状组的OS获益,而该效果在具有鳞状组织学的CheckMate 017群体中较不明显。三年PFS率在CheckMate 017中为12%与不可计算,而在CheckMate 057中为10%与<1 %。
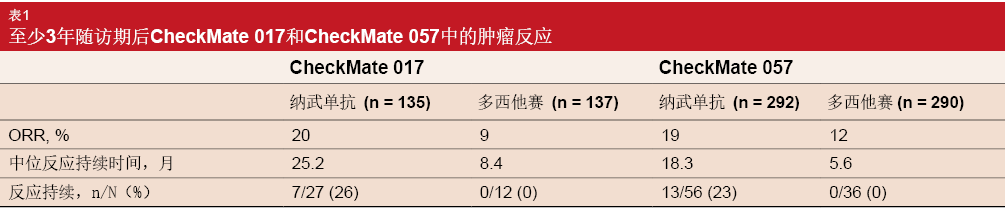
在反应者中,用纳武单抗治疗的患者比多西他赛组中患者经历更长的中位反应持续时间。在CheckMate 017和CheckMate 057中对纳武单抗产生反应的患者分别有26%和23%存在持续的肿瘤反应(表1)。在两项试验的多西他赛组中均未观察到持续反应。长期随访显示,纳武单抗不具有新的安全性信号,治疗相关AE的比率与过去相似。
老年人中的纳武单抗数据
来自正在进行的大型CheckMate 171研究的初步结果支持将纳武单抗作为先前经历过治疗的晚期鳞状NSCLC患者的治疗选择,包括年龄 ≥ 70岁或ECOG表现状态(PS)为2的患者[10]。大多数肺癌患者在高龄获得诊断,并因此频繁出现并发症。然而,关于这些患者中治疗选择的数据有限,因为他们在随机化临床试验中通常人数不足。单组II期CheckMate 171研究正在探索在铂类化疗进展后接受纳武单抗单药治疗的具有大量预先治疗的患者(n = 809)中的安全性和生存率结果,包括年龄 ≥ 70岁的患者(n = 279)和具有ECOG PS 2的患者(n = 98)。
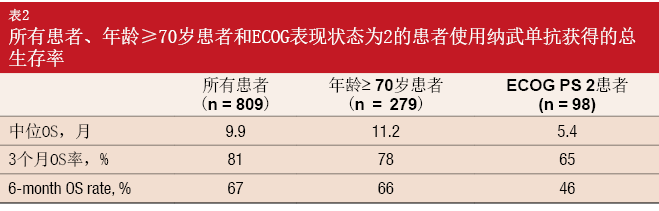
分析显示,总人群和≥ 70岁患者中预计中位OS以及第3个月和6个月的OS率相类似(表2)。ECOG PS 2患者的结果稍差。总人群、≥70岁患者和ECOG PS 2患者在第9周的PR率分别为14 %、14 %和11 %。纳武单抗的安全特性在这三组中类似,包括3/4级治疗相关AE率、所有级别AE率和导致停药AE率。
纳武单抗应使用多久?
使用PD-(L)1抑制剂治疗的最佳持续时间仍是重要问题。虽然大多数纳武单抗数据都是基于治疗直至发生疾病进展或不可接受毒性,但I期CheckMate 003研究的结果表明,约2年的纳武单抗单药治疗足以向先前接受过治疗的NSCLC患者提供长期临床获益[11]。CheckMate 153是评估PD-(L)1抑制剂治疗持续时间的首个随机化研究[12]。该研究比较了持续给予纳武单抗与限于一年的纳武单抗治疗。具有至少一次先前系统治疗的鳞状或非鳞状组织学晚期或转移性NSCLC患者符合资格。允许0-2的ECOG表现状态,以及经治疗的CNS转移。这是具有大量预先治疗的队列;每组中的四分之一已经接受过至少三次先前治疗,并且三分之一已经接受过两次治疗。
所有患者(n = 220)均接受1年的纳武单抗标准剂量(每2周3mg/kg)治疗。之后,他们被随机分为接受持续纳武单抗治疗或治疗中止,并有机会在进展时接受再次治疗。疗效分析中仅包含在随机分配时达到疾病控制
(即完全反应[CR]、PR、SD)的患者。这适用于持续组中的76名患者和中止组中的87名患者。
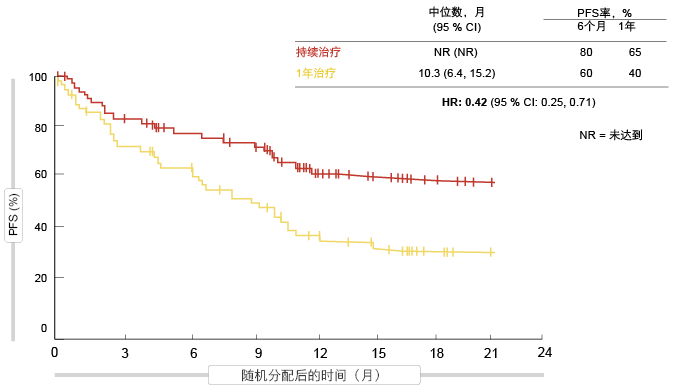
结果支持持续治疗
在该组中,就随机分配以后的PFS而言,患者均从持续接受纳武单抗中获得了显著更大的获益(未达到与10.3个月;HR,0.42;图3)。在一年时,PFS率为65%与40%。此外,接受持续纳武单抗治疗显示出更大活性,而与随机分配时的反应状态无关:对于CR或PR患者,中位PFS为未达到与10.6个月(HR,0.45),而对于SD患者,中位PFS为未达到与9.6个月(HR,0.44)。即使在调整性别、组织学、最佳总体反应和PD-L1状态后,多变量分析也倾向于接受持续纳武单抗治疗(HR,0.43)。接受持续纳武单抗治疗的OS更长,但未达到统计学显著的程度。
在随机分配为治疗中止的患者中,43名患者随后经历疾病进展。其中34名使用纳武单抗重新治疗。重新治疗的中位持续时间为3.8个月(范围为0.1-17.5个月)。虽然一些患者经历治疗获益,但是大多数患者显示出目标病灶大小增加。关于随机分配后的安全性,持续治疗组与1年治疗组相比,治疗相关(严重)AE的发生率普遍较高。一年后很少发生新发事件。在任一试验组中都未报告治疗相关死亡事件,总体队列中也未出现新的安全性信号。
图3: 1年后持续使用纳武单抗与中止:无进展生存期
KEYNOTE-021的更新结果
KEYNOTE-021研究的G队列是一项开放标签的随机化II期试验,研究与单独培美曲塞(pemetrexed)/卡铂(carboplatin)相比抗PD-1抗体派姆单抗(pembrolizumab)与培美曲塞/卡铂化疗的组合。招募先前未经治疗的晚期非鳞状NSCLC患者。根据10.6个月的中位随访期后进行的初步分析,基于派姆单抗的组合在ORR(55%与29%;p = 0.0016)和PFS(HR,0.53;p = 0.010)方面具有显著改善[13]。在该时间点,OS的HR为0.90。在2017年ASCO大会上介绍的更新分析显示,ORR和PFS获益得到维持,而死亡风险降低(OS的HR为0.69;p = 0.13)[14]。主要和次要分析均显示该组合具有可控的安全特性。
在2017年ESMO大会上,Borghaei等人介绍了18.7个月中位随访期后的更新结果[15]。同样,ORR和PFS的显著改善得到维持。ORR为56.7%与31.7%。与预先设定的分析相比,观察到三例额外反应,一例在实验组中,两例在对照组中。每组中均出现一例CR。两组均尚未达到中位反应持续时间;50%与40%的患者显示出持续反应。派姆单抗和仅化疗组的PFS分别为19.0和8.9个月(HR,0.54)。对于OS,尽管对照组中有相当大比例的患者在交叉范围之内以及之外接受过抗PD-(L)1治疗(意向治疗人群的63%),但增量获益继续增加(HR,0.59)。然而,由于患者人数较少,因此OS差异不具有统计显著性。
同样,与上次更新相比,毒性变化有限。各组中均存在一例额外AE导致治疗中止。毒性特征与预期一致。未发生具有可能免疫病因的5级AE。
超进展的发生率和影响
在早期试验中用免疫疗法治疗的131名晚期癌症患者中,9 %的患者出现了免疫疗法背景下的超进展疾病(HPD)[16]。Lahmar等人报告,在89名NSCLC患者中,10%的患者出现肿瘤体积增加> 50% [17]。在五家法国机构中进行的回顾性研究在接受免疫疗法的晚期NSCLC患者组成的大型队列中评估了HPD发生率、其预后价值及其与临床特征的相关性[18]。在免疫疗法开始之前需要进行两次CT扫描,在治疗期间需要进行一次扫描; 基线CT扫描与治疗开始之间的间隔必须≤ 6周。根据RECIST1.1集中评估CT扫描。365名获得筛查的患者中纳入了242名(66%)。
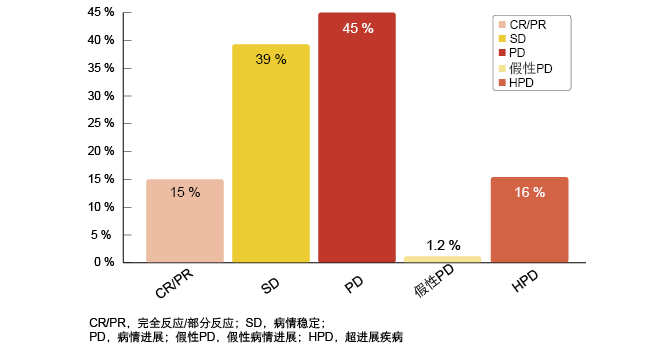
根据这一分析,使用免疫疗法加速了36 %患者中的肿瘤生长,而64%的患者显示消退或SD。40名患者
(16%)发生HPD(图4),其被定义为治疗开始前后肿瘤生长率差异> 50%。1.2%的患者发生假性进展。
根据进展状态对临床特征进行分析显示,在治疗开始前存在超过两个转移位点的情况下,HPD的风险增加。HPD被认为是负面预后因素:对于经历非HPD进展的患者,中位OS为5.7个月,而发生HPD患者的中位OS仅为3.3个月(HR,0.39;p=0.011)。
图4: 免疫疗法治疗的肺癌患者的反应模式
参考文献
- Paz-Ares L et al., PACIFIC: a double-blind, placebo-controlled phase III study of durvalumab after chemoradiation therapy in patients with stage III, locally advanced, unresectable NSCLC. ESMO 2017, abstract LBA1_PR
- Rittmeyer A et al., Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017; 389(10066): 255-265
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387(10030): 1837-1846
- Gadgeel S et al., Clinical efficacy of atezolizumab in PD-L1 selected subgroups defined by SP142 and 22C3 IHC assays in 2L+ NSCLC: results from the randomised OAK trial. ESMO 2017, abstract 1296O
- Gandara DR et al., Blood-based biomarkers for cancer immunotherapy: tumour mutational burden in blood (bTMB) is associated with improved atezolizumab efficacy in 2L+ NSCLC (POPLAR and OAK). ESMO 2017, abstract 1295O
- Kowanetz M et al., Tumor mutation burden (TMB) is associated with improved efficacy of atezolizumab in 1L and 2L+ NSCLC patients. WCLC 2016, abstract OA20.01
- Brahmer J et al., Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015; 373: 123-135
- Borghaei H et al., Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373: 1627-1639
- Felip E et al., Three-year follow-up from CheckMate 017/057: nivolumab versus docetaxel in patients with previously treated advanced non-small cell lung cancer. ESMO 2017, abstract 1301PD
- Popat S et al., Nivolumab in previously treated patients with metastatic squamous NSCLC: results of a European, single-arm, phase 2 trial (CheckMate 171) including patients aged ≥ 70 years or with poor performance status. ESMO 2017, abstract 1303P
- Brahmer J et al., AACR Annual Meeting 2017, abstract 8356
- Spigel DR et al., CheckMate 153: randomised results of continuous vs. 1-year fixed-duration nivolumab in patients with advanced non-small cell lung cancer. ESMO 2016, abstract 1297O
- Langer CJ et al., Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol 2016; 17: 1497-1508
- Papadimitrakopoulou P et al., First-line carboplatin and pemetrexed (CP) with or without pembrolizumab (pembro) for advanced nonsquamous NSCLC: updated results of KEYNOTE-021 cohort G. J Clin Oncol 2017; 35 (suppl; abstr 9094)
- Borghaei H et al., Updated results from KEYNOTE-021 cohort G: a randomised, phase 2 study of pemetrexed and carboplatin with or without pembrolizumab as first-line therapy for advanced nonsquamous non-small-cell lung cancer. ESMO 2017, abstract LBA49
- Champiat S et al., Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1. Clin Cancer Res 2017; 23(8): 1920-1928
- Lahmar J et al., Immune checkpoint inhibitors induce paradoxical progression in a subset of non-small cell lung cancer (NSCLC). Ann Oncol 2016; 27 (suppl_6): 1222P
- Ferrara R et al., Hyperprogressive disease (HPD) is frequent in non-small cell lung cancer (NSCLC) patients treated with anti PD-1/PD-L1 monoclonal antibodies (IO) and predicts poor survival. ESMO 2017, abstract 1306PD
More posts
ALK阳性NSCLC:克唑替尼和艾乐替尼的更新数据
ALK阳性NSCLC:克唑替尼和艾乐替尼的更新数据 PROFILE 1014是用以确定ALK抑制剂克唑替尼在ALK阳性肺癌患者一线治疗中作用的首个研究。其在一线环境下,在A
转化导致SCLC的特征和结果
转化导致SCLC的特征和结果 在获得对EGFR TKI疗法的耐药性时,少量但显著比例的EGFR突变腺癌转化为SCLC [1]。此外,报道存在自始携带EGFR突变的SCLC病
获得前所未有规模的恶性间皮瘤结果
获得前所未有规模的恶性间皮瘤结果 恶性胸膜间皮瘤(MPM)是一种罕见、侵袭性且预后不良的癌症。虽然使用铂类和培美曲塞化疗联合或不联合贝伐单抗(bevacizumab)是一线
专访:生存期受到多条治疗线的影响
专访:生存期受到多条治疗线的影响 Nicolas Girard, MD, PhD 法国巴黎居里研究所,居里-蒙苏里胸部研究所 在EGFR突变晚期NSCLC患者中探究奥希替
EGFR突变肺癌:排序根据新数据作为主要话题
EGFR突变肺癌:排序根据新数据作为主要话题 EGFR TKI失败后使用奥希替尼的长期结果 第一代表皮生长因子受体酪氨酸激酶抑制剂(EGFR TKI)厄洛替尼和吉非替尼以及
早期NSCLC切除后基于CT随访的随机化结果
早期NSCLC切除后基于CT随访的随机化结果 关于早期NSCLC术后的最佳随访,ESMO指南建议每六个月进行患者监控,持续2-3年,门诊包括病史和身体检查,优