探析既定和新型 EGFR 靶向药物
LUX-Lung 7 中的患者自报结果与剂量调整
IIb 期 LUX-Lung 7 试验是在初治EGFR-突变阳性晚期(IIIB/IV 期)肺腺癌患者中,针对第二代 ErbB 家族阻断剂阿法替尼(afatinib)与第一代可逆 EGFR TKI 吉非替尼(gefitinib)进行的一对一比较。根据初步分析,用阿法替尼治疗的患者与接受吉非替尼的患者相比,获得了显著的 PFS、 ORR 和治疗失败前时间获益[1]。OS数据目前尚不成熟。
在 ASCO 大会上,由 Hirsh 等人介绍了患者自报结果(PRO),以及有关阿法替尼剂量调整对 PFS、AE 控 制和 PRO 的影响的事后分析[2]。根据预先指定的剂量调整方案,允许阿法替尼剂量增减。对从 40 mg 起减低剂量之前和之后常见 AE 的发生率和严重性进行了评估。此外,研究者在 6 个月内经历剂量减少和最初 6 个月内至少接受 40 mg 的患者之间比较了 PRO和 PFS。
剂量减少情况下保持的疗效
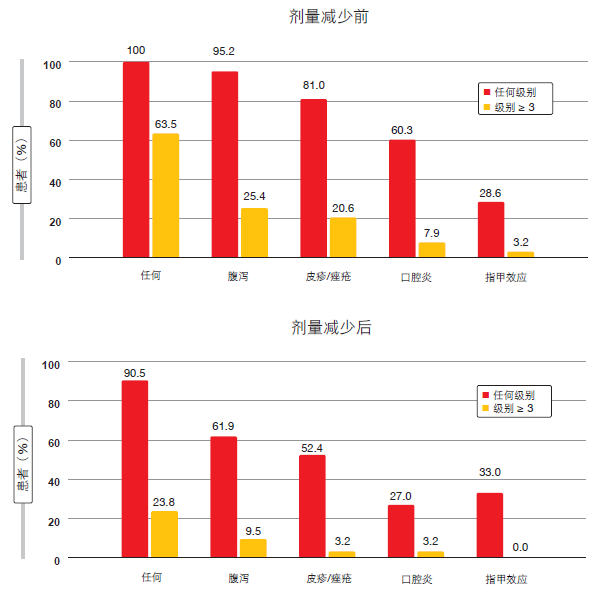
阿法替尼比吉非替尼更常发生剂量减少。与阿法替尼(20 mg、30 mg、40 mg、50 mg)相反,吉非替尼仅以一种剂量强度使用。在用阿法替尼治疗 的患者中,有 39 %的人剂量从 40 mg减少到 30 mg,13 %的人剂量进一步减少到 20 mg。然而,在各组中因 AE造成的药物相关停药率相似,从而表明剂量减少有效地控制了 AE。剂量调整的确导致药物相关 AE 发生率和严重性的降低(见图)。
图:通过阿法替尼剂量调整产生的治疗相关 AE 发生率和严重性降低
就 PRO 而言,根据 EQ-5D™健康状况自我评估问卷,在全部两个研究组中观察到相似的改善。在平均 EQ-5D 或 EQ-VAS 得分方面,阿法替尼组与吉非替尼组之间无显著或临床上有意义的差异。阿法替尼剂量的减少并未削弱对 PRO 的治疗效果。此外,在最初 6 个月的治疗期间,接受< 40 mg或≥ 40 mg 剂量的患者之间 PFS 无差 别。在经历和未经历剂量减少的患者中,中位 PFS 分别为 12.8 月和 11.0月。与之相比,根据初步分析,吉非替尼组的中位 PFS 为 10.9 月[1]。
总体而言,阿法替尼剂量调节使患者能够维持治疗。如 LUX-Lung 3 和LUX-Lung 6 试验中的观察[3],耐受性引导的阿法替尼剂量减少构成了在不影响疗效的情况下减少治疗相关 AE 的一种有效措施。
对 LUX-Lung 8 试验的VeriStrat 分析
在开放标签 III 期 LUX-Lung 8 试验中将阿法替尼与埃洛替尼(erlotinib)进行了比较。该项试验招募了 795 名晚期鳞状细胞肺癌患者,他们均在至少 4个周期的铂基化疗之后出现了病情进展。用阿法替尼治疗的患者表现出OS、PFS 和疾病控制上的显著获益[4]。Goss 等人展示了利用 VeriStrat 获得的数据[5]。VeriStrat 是一种血清-蛋 白质质谱测试,其展现出 EGFR 靶向治疗在非小细胞肺癌(NSCLC)中的预后和预测效用[6]。研究者使用 OS作为主要疗效变量,评估了 VeriStrat在 LUX-Lung 8 中的预测能力。为此,基于预定参照组将取自 675 名患者的血清预处理样品归类为“好(VS-G)”或“差(VS-P)”。在整体人群和预定亚组中关于 VeriStrat 状态分析了临床结果。
在 VS-G 组(n = 412)中,阿法替尼和埃洛替尼的中位 OS 分别为 11.5月和 8.9 月(HR, 0.79;p = 0.03);中位 PFS 分别为 3.3 月和 2.0 月(HR, 0.73;p = 0.005)。对于归类为 VS-P的患者(n = 263),阿法替尼和埃洛替尼的中位 OS 分别为 4.7 月和 4.8 月(HR, 0.90;差异不显著),并且中位PFS 均为 1.9 月(HR, 0.96;差异不显著)。在用阿法替尼治疗的患者中, VS-G 组的 OS 和 PFS 均长于 VS-P 组(OS: HR, 0.40;p < 0.0001;PFS: HR, 0.56;p < 0.0001)。根据多因素分析 ,VeriStrat 是阿法替尼治疗患者的 OS和 PFS 的独立预测指标,与 ECOG 活动状态、对一线治疗的最佳反应、年龄和种族无关。然而对于 OS 和 PFS,在 VeriStrat 归类与治疗组之间并未展现出任何相互作用。
总体而言,在 LUX-Lung 8 试验中,VeriStrat 在接受阿法替尼治疗的复发/难治鳞状细胞肺癌患者中提供了很强的独立分层作用。在这些难以治疗的患者中,阿法替尼疗法在 VS-G 组产生了显著优于埃洛替尼的 OS 和PFS。
关于 rociletinib 的更新数据:TIGER-X
抑制 EGFR 基因的突变形式的 TKI 存在两种重要局限:对野生型 EGFR 的抑制导致皮肤毒性和腹泻,而治疗的功效在约 60 %的患者身上由于出现EGFR T790M 获得性耐药突变而受到限制。因此,rociletinib 被设计成针对激活突变外显子 19 和外显子 21 中的L858R 点突变以及获得性耐药突变T790M 的口服、不可逆抑制剂。其对野生型EGFR 只有最小的活性。
Goldman 等人 报告了 I/II 期TIGER-X 研究获得的更新结果,该研究考察 rociletinib 在患有晚期或复发性集中确诊 T790M-阳性 NSCLC 的病人中的作用[7]。在该试验的剂量扩大 I期部分之后,经使用一种或两种 EGFR TKI 仍出现病情进展的患者进入到扩展队列(II 期)。在 548 名患者身上以 3 种剂量(每日两次每次 500 mg,每日两次每次 625 mg,每日两次每次750 mg)对 rociletinib 进行了测试。针对所有 3 个剂量队列中的亚组评估了 N-乙酰转移酶 2(NAT2)基因型多态性。
根据研究人员报告,rociletinib 疗法产生了 33.9 %的经证实 ORR。这一数据低于此前报告的反应率[8, 9]。在3 个剂量组中,均证明反应持久,中位数分别为 8.9 月、9.0 月和 7.1 月。FPS分别为 5.7 月、5.0 月和4.3 月。 在所有剂量中,各级别最常见 AE包括高血糖症、腹泻、恶心、疲劳和食欲减退。高血糖症、QTc 间期延长和疲劳为报告频率最高的 3/4 级 AE。研究发现,在长期接受 rociletinib 治疗的患者中常见白内障,这也是为什么要及时考察视觉症状。基于 NAT2基因型结果,将患者归类为具有慢(n = 196)、中等(n = 148)或快(n =
38)乙酰化表型。慢乙酰化患者表现
出患高血糖症、QTc 间期延长或其他心脏疾病的倾向。rocilitinib 的临床开发最近已被 Clovis Inc.停止。
创新型第三代 EGFR -突变特
异性 TKI:olmutinib
olmutinib 是一种口服第三代 TKI,具有针对 19 缺失、L858R 和 T790M 点突变的 EGFR-突变特异性活性。该药物不抑制野生型 EGFR。在以 EGFR-TKI 预治疗的患有 NSCLC 的韩国病人为对象进行的开放标签、多中心 I/II期试验中,评价了 olmutinib 的安全性、耐受性、药代动力学和初步活性 。在此项研究的 II 期部分中,76 名带有 T790M 突变的患者接受了每日一次每次 800 mg 的 olmutinib。这些患者都在至少一种先前 EGFR TKI 治疗中病情出现了进展。
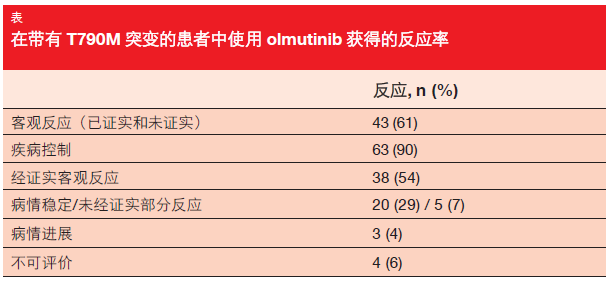
有 61 %的患者实现了可认定为客观反应的肿瘤缩小(表)。在 84 %的病人中,肿瘤反应在第 6 周发生。在90 %的病人身上观察到疾病控制。反应期中位数为 8.3 月。接受过一种先前全身治疗的患者获得 8.8 月的中位PFS,而在接受过两种或更多种先前治疗的患者中,PFS 为 6.8 月。关于耐受性,患者最常报告的有腹泻、瘙痒、 皮疹和恶心,主要是轻度到中等强度。4 名患者由于 AE(上腹痛和呕吐、间质性肺病、外周神经病变、表皮脱落)而中断治疗。未观察到 QT间期延长和高血糖症。
作者得出结论认为,olmutinib 在推荐的每日一次每次 800 mg II 期剂量下表现出有意义的临床活性,并具有良好的安全性。进行中的全球 II 期试验 ELUXA 1 正在进一步评估olmutinib 在 T790M-阳性 NSCLC 患者中的疗效和安全性。
参考文献
- Park K et al., Afatinib versus gefitinib as firstline treatment of patients with EGFR mutationpositive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17(5): 577-589
- Hirsh V et al., First-line afatinib versus gefitinib for patients with EGFR mutation-positive NSCLC (LUX-Lung7): patient-reported outcomes and impact of dose modifications on efficacy and adverse events. J Clin Oncol 34, 2016 (suppl; abstr 9046)
- Schuler M et al., First-line afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor receptor gene mutations and brain metastases. J Thorac Oncol 2016; 11(3): 380-390
- Soria JC et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16(8): 897-907
- Goss GD et al., Evaluation of VeriStrat, a serum proteomic test, in the randomized, open-label, phase 3 LUX-Lung 8 (LL8) trial of afatinib (A) versus erlotinib (E) for the second-line treatment of advanced squamous cell carcinoma (SCC) of the lung. J Clin Oncol 34, 2016 (suppl; abstr e20510)
- Gregorc V, et al., Predictive value of a proteomic signature in patients with non-small-cell lung cancer treated with second-line erlotinib or chemotherapy (PROSE): a biomarker-stratified, randomised phase 3 trial. Lancet Oncol 2014; 15(7): 713-721
- Goldman JW et al., Updated results from TIGER- X, a phase 1/2 open-label study of rociletinib in patients with advanced, recurrent T790M-positive non-small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 9045)
- Sequist LV et al., Rociletinib in EGFR-mutated non-small-cell lung cancer. N Engl J Med 2015; 372: 1700-1709
- Sequist LV et al., Efficacy of rociletinib (CO- 1686) in plasma-genotyped T790M-positive non-small cell lung cancer (NSCLC) patients (pts). J Clin Oncol 33, 2015 (suppl; abstr 8001)
- Park K et al., Olmutinib (BI 1482694; HM61713), an EGFR mutant-specific inhibitor, in T790M+ NSCLC: efficacy and safety at the RP2D. J Clin Oncol 34, 2016 (suppl; abstr 9055)
More posts
寡转移性非小细胞肺癌中局部治疗产生的无进展生存期改善
寡转移性非小细胞肺癌中局部治疗产生的无进展生存期改善 有证据表明存在一种“有限转移性” 的非小细胞肺癌(NSCLC)表型。然而,针对这些患者的最佳治疗类型和积极局部治疗作用
局部晚期非小细胞肺癌:口服长春瑞滨显示出比依托泊苷更好的安全性
局部晚期非小细胞肺癌:口服长春瑞滨显示出比依托泊苷更好的安全性 进行的随机化、多中心、开放标签 II期 RENO 试验的目标在于建立局部晚期非小细胞肺癌(NSCLC)放化疗
ULTIMATE:在一线外采用化疗联合贝伐单抗
ULTIMATE:在一线外采用化疗联合贝伐单抗 由于化疗在二线或三线非小细胞肺癌(NSCLC)环境下表现得疗效有限,因此 III 期随机化 ULTIMATE 试验在接受一线
新治疗方法为小细胞肺癌患者带来希望
新治疗方法为小细胞肺癌患者带来希望 小细胞肺癌(SCLC)在肺癌病例中占比高达 10 %到 15 %,但在过去 30 到40 年里对这种疾病的治疗方面进展不大。SCLC 对
突变分析:在通向完善标准的道路上前行
突变分析:在通向完善标准的道路上前行 LCMC II 肺癌突变联盟(LCMC)是一个旨在研究肺腺癌驱动突变的多机构联盟。参与合作机构支持鉴别出相对大量带有不常见和罕见变异的
“一线和二线靶向药物的重要性显而易见”
“一线和二线靶向药物的重要性显而易见” Nir Peled MD, PhD, FCCP, Head of the Thoracic Cancer Unit, Thoraci