新治疗方法为小细胞肺癌患者带来希望
小细胞肺癌(SCLC)在肺癌病例中占比高达 10 %到 15 %,但在过去 30 到40 年里对这种疾病的治疗方面进展不大。SCLC 对放射敏感,但大约 70 %的病人具有无法包含在一个放疗野中的扩大的病变。大部分患者对一线化疗有反应。然而,这些反应几乎总是暂时性的,而使用二线治疗的结果普遍较差。在广泛性病变中,从确诊起的中位生存期通常不超过 10 个月。
针对广泛期 SCLC 的当前治疗方案是一线联合化疗(铂-依托泊苷),随后针对复发/病情进展利用拓扑替康(topotecan)、伊立替 康 ( irinotecan )、紫杉醇( paclitaxel )、多西他赛(docetaxel)以及多种其他药物选择进行化疗。所有这些药物只能产生微薄的反应。到目前为止,拓扑替康是唯一获得 FDA 批准的复发性疾病治疗药物。患者加入临床试验,或者仅接受支持治疗。针对这一患者人群尚未确认任何生物标志物驱动疗法。
在开发新的活性治疗选择方面存在尚未满足的需求,特别是在复发性疾病方面情况尤为如此。然而与此同时,对 SCLC 生物学的进一 步完善的了解已经导致能够鉴别出可施药靶标;几十年来,第一次有可能采用合适的药物来开始改变这种疾病的进程。
CheckMate 032
从免疫治疗的角度来看,SCLC 是一种“冷”肿瘤,因为肿瘤浸润 T 细胞数量较低。这基本上限制了诸如纳武单抗(nivolumab)等 PD-1 抗体的功效,但这一问题可以通过使用组合策略来克服。抗 CTLA-4 抗体伊匹单抗(ipilimumab)增加肿瘤反应性 T 细胞的数量,从而增强 纳武单抗的活性。
3 组 CheckMate 032 试验招募了 216 名患有 SLCL 并在包括一线铂基方案在内的至少一种前一线治疗之后发生疾病进展的病人[1]。患者不是基于 PD-L1 表达而选择的。他们被随机分为每 2 周静脉注射 3 mg/kg 纳武单抗作为单药治疗(n = 98),每 3 周静脉注射 1 mg/kg 纳武单抗加 3 mg/kg 伊匹单抗连用 4个周期(n = 61),或者每 3 周静脉注射 3 mg/kg 纳武单抗加 1 mg/kg 伊匹单抗连用4 个周期(n = 54)。此后,每 2 周施用 3 mg/kg单药纳武单抗作为维持治疗。
采用纳武单抗加伊匹单抗达到的最佳效果
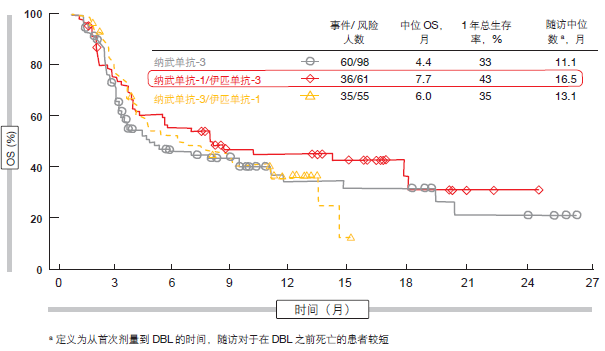
纳武单抗加伊匹单抗表现出比单独使用纳武单抗更大的功效。采用单药纳武单抗的 ORR 为 10 %,而采用纳 武单抗 -1 加伊匹单抗 -3 (23 %)和纳武单抗-3 加伊匹单抗- 1(19 %)的 ORR 则要高出一倍。对于非小细胞肺癌(NSCLC)患者,反应既迅速又持久,并且即使在带有大体积肿块的患者身上也出现了反应。反应既不取决于铂敏感性,也不取决于 PD-L1 表达。在OS 方面,纳武单抗-1/伊匹单抗-3组合显露出最有效的作用,中位OS 达 7.7 月(相比之下,纳武单抗- 3/伊匹单抗-1 为 6.0 月,单独使用纳武单抗为 4.4 月;图 1)。尽管还需要更长的随访期,但分析已经表明一定比例的患者表现出能够长期生存,而这是免疫治疗剂的已知效果。这里,安全性类似于在其他疾病中使用纳武单抗和伊匹单抗时观察到的情况。
图 1:与纳武单抗-3/伊匹单抗-1 和纳武单抗单药治疗相比,纳武单抗-1/伊匹单抗-3 在复发性 SCLC 患者总生存率方面的优势
采用联合治疗时有较高的不良事件(AE)发生率;而且还有 3 例治疗相关死亡(肺炎、重症肌无力、肾衰竭恶化)。采用既定的安全指南对免疫相关 AE 进行了控制。然而,仅有 10 %的患者因毒性而停止治疗。 1 mg/kg 纳武单抗加 3 mg/kg伊匹单抗被选择用于 III 期调查。三项研究预计会确认和扩大这些数据。除了目前正在进行的CheckMate 032 扩展研究,Check-Mate 331 将会在复发性 SCLC 患者中比较纳武单抗与化疗,而CheckMate 451 将会在患有广泛性病变的病人中对比测试单独使用纳武单抗、纳武单抗加伊匹单抗、安慰剂,作为铂基一线治疗之后的巩固/维持疗法。
Rova-T:SCLC 中第一种生物标志物定向策略
δ 样蛋白 3(DLL3)已被确立为神经内分泌肿瘤中的新靶点。该蛋白是由关键神经内分泌转录因子ASCL1 诱导的非典型抑制性 Notch配体。在 SCLC 中,DLL3 高度上调并过量表达;在癌症干细胞和肿瘤细胞上均存在细胞表面表达(但在正常成体组织中无表达),这使它适合于抗体-药物偶联物(ADC)方法。DLL3 不是预后标志物,并且不能预测对细胞毒性化疗的反应。
rovalpituzumab tesirine (Rova-TTM,SC16LD6.5)被设计为一种 DLL3 靶向 ADC。在该分子内,抗 DLL3 单克隆抗体连接到吡 咯并苯并二氮杂 (PBD)二聚体毒素,这会导致 DNA 链断裂并且以与细胞周期无关的方式具有高细胞毒性。由于抗体的选择性结合,毒素仅在癌细胞内释放。
首次在人类身上进行的 I 期剂量递增 SCRX16-001 试验包含 74 名SCLC 患者[2]。两个扩大队列接受每 3 周 0.2 mg/kg 或每 6 周 0.3 mg/kg 治疗。最终,试验确定了每6 周施用两次 0.3 mg/kg 作为推荐 II期剂量。采用免疫组织化学法对DLL3 表达进行评估,并将其评级为低(≥ 1 %的肿瘤细胞,88 %的患者)或高(≥ 50 %的肿瘤细胞, 67 %的患者)。
无关于先前治疗线数量的获益
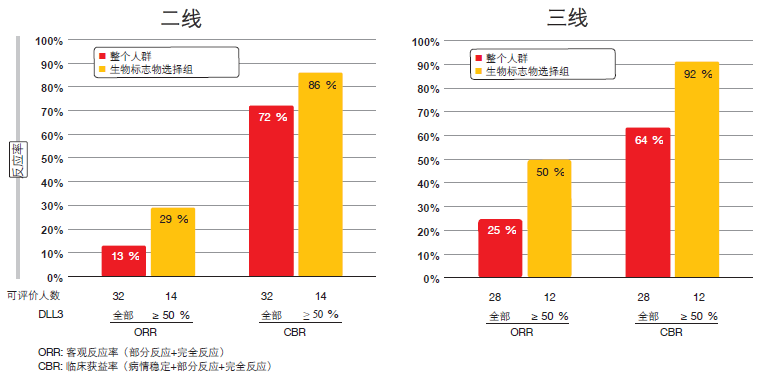
SCRX16-001 试验表明了 Rova-T 的重要临床活性,而 DLL3 表达可预测反应。每一研究者的 RECIST 证实反应率在全部人群中为 18 %,而在生物标志物选择组中为 39 %;后者包含 DLL3 表达 ≥ 50 %的患者。临床获益率分别为 68 %和 89 %。在一个患者子集中,进行了中央审查并确认了每一研究者反应。分析揭示了无关于先前治疗线数量的重要获益,其中反应率在二线和三线环境下相仿(图 2)。根据瀑布图,所有的反应都发生在具有高 DLL3 表达的组中。高 DLL3 表达人群显示出 5.8 月的中位 OS 和32 %的 1 年生存率。总体而言,安全性被证实可控。在 3 级或更高等级 AE 中,12 %的患者发生血小板减少症,11 %的患者发生浆膜腔积液,并有 8 %的患者发生皮肤反应。
图 2:Rova-T 在复发性/难治性 SCLC 二线和三线环境下相仿的证实反应
历史比较表明,采用 Rova-T获得的二线和三线结果优于标准医护疗法。然而,参与 SCRX16-001试验的患者数量较少;就目前而言,这些数据只是产生假说,但却很有希望,并且有理由进行进一步的临床开发。II 期单组 TRINITY 试验正在加入三线环境中,而这将会作为 SCRX16-001 的验证性试验。附加研究,例如对 Rova-T 在表达DLL3 的其他肿瘤类型中的活性进行调查的一线篮子试验等,也在规划阶段。
除化疗外的 PARP 抑制
一项多中心随机化双盲 II 期研究在一种或两种先前方案失败后的复发敏感性和难治 SCLC 患者中,对除替莫唑胺(temozolomide)之外每日两次每次 40 mg 剂量连用 7 天的口服 PARP-1/2 抑制剂 veliparib 进行了测试[3]。敏感性疾病定义为在完成一线铂基化疗后 60 天复发, 而难治性患者未对最初铂基治疗发生任何反应,或者在完成治疗后 60天内病情进展;此外,该定义包含任何需要三线治疗的患者。55 名患者除替莫唑胺之外接受 veliparib,并且 40 名患者接受安慰剂加替莫唑胺治疗。选择 veliparib 的原因是,SCLC 以参与 DNA 损伤修复的基因和蛋白质的异常表达为特征。因此,DNA 修复通路代表了 SCLC中一个有吸引力的靶标。
在 veliparib 组与安慰剂组之间,PFS 和 OS 无显著区别,但在ORR 方面则存在显著差异(39 %与14 %;p = 0.016)。对诸如 PARP-1、SLFN11 和 MGMT 等涉及 DNA修复的蛋白的表达进行了评估并将其关联于结果。这里,在 veliparib组内,高 SLFN11 表达情况下观察到更佳 OS 的趋势。对额外生物标记物的分析正在进行当中。另外,这些发现表明,在基线和 1 个疗程之后循环肿瘤细胞数量的增加与较差的生存率相关联。此项研究中观察到的 ORR 改善支持对 SCLC 中PARP1 抑制剂和替莫唑胺的进一步试验。
利用贝伐单抗(bevacizumab)和帕唑帕尼(pazopanib)实现抗血管生成
由于血管生成在 SCLC 中十分丰富并且与不良预后相关,因此另一有希望的方法包括使用抗 VEGF 抗体贝伐单抗来抑制 VEGF。在一项多中心 III 期研究中,在广泛期 SCLC一线治疗中向铂和依托泊苷添加贝伐单抗与仅含顺铂(cisplatin)和依托泊苷的对照方案相比,产生了显著的 PFS 改善(1 年 PFS 率为18.4 %与 11.5 %;HR, 0.72)[4]。在每一组中治疗了大约 100 名患者。对于被定义为主要结果的 OS,分析显示出基于贝伐单抗疗法的不显著优势(1 年 OS 率为 36.7 %与24.9 %;HR, 0.78)。反应率在两组之间无显著差异。时间依赖性分析揭示了维持治疗对 OS 的显著作用(HR, 0.60)。毒性特征可以接受。正如作者所指出,有必要在SCLC 的抗血管生成治疗领域开展进一步研究。
直接针对 VEGFR、PDGFR、 FGFR 和 c-KIT 的多激酶抑制剂帕唑帕尼也引发抗血管生成作用。希腊肿瘤研究小组开展了一项非随机化、开放标签 II 期试验,在患有化疗耐药性/化疗难治性和化疗敏感性 SCLC 的患者中以每日 800 mg剂量使用单药帕唑帕尼作为二线治疗[5]。敏感复发患者被包含在队列A 中(n = 39),而耐药性或难治性疾病患者则被包含在队列 B 中 (n = 19)。主要目标是第 8 周时的无进展率(PFR)。
这项试验达到了队列 A 的主要终点;这里,PFR 为 59 %。队列 B中的招募由于期中分析时功效欠佳而提前终止(PFR 为 26.3 %)。在队列 A 中,中位 PFS 和中位 OS 分别为 3.7 月和 8.0 月。在 1 年时,这些患者中有 26.5 %存活。帕唑帕尼的耐受性良好。
这项研究首次证明酪氨酸激酶抗血管生成抑制剂在 SCLC 患者中作为挽救治疗的可观和临床相关疗效。作者得出结论认为,应当将帕唑帕尼作为单一疗法或与其他药物联用,以进行进一步评价。
CONVERT:放化疗在局限期疾病中的作用
大约三分之一的 SCLC 患者所患为局限期疾病。在那些拥有良好活动状态的患者中,医护标准是同步放化疗(CTRT)。记录在案的最佳结果为每日两次(BD)CTRT;然而,由于毒性和组织方面的问题,仅五分之一的患者实际定期使用BD 治疗。关于局限期 SCLC 标准放疗方案缺乏一致性,这导致了开发多国 III 期 CONVERT 试验[6]。
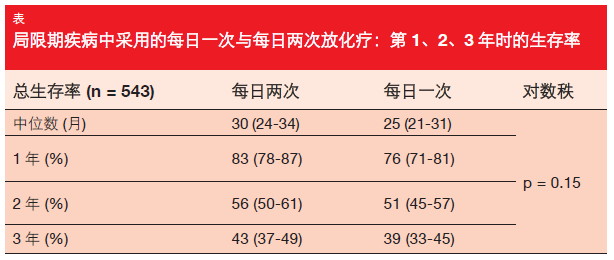
这里,患者被随机分配为在 3周中以每日两次(BD)每次 30 份接受 45 Gy(n = 274),或者在 6.5周中以每日一次(OD)每次 33 份 接受 66 Gy(n = 273)。化疗包含4 到 6 个疗程的顺铂和依托泊苷。放疗在第 1 疗程的第 22 天开始。 OS 被定义为 CONVERT 试验的主要终点。
尽管放射治疗用量在 BD 组中较高,但 OS 在这两个组中相仿, BD 组和 OD 组的 2 年生存率分别为 56 %和 51 %(HR 1.17;p = 0.15;表)。OD 放疗没有导致比BD 放疗更严重的毒性。除了采用BD 治疗造成显著增高的 3/4 级中性粒细胞减少比率之外,毒性在两组中相仿。在全部两组中,3/4 级急性食管炎发生率为 19 %,而 3/4级急性放射性肺炎一般比较罕见(BD 与 OD 治疗分别为 2.5 %和2.2 %)。总体上,辐射相关毒性出现频率少于预期,这可能是由于采用了现代放疗技术。CONVERT 的结果支持使用这两种方案中任一种作为拥有良好活动状态的局限期SCLC 患者的标准医护疗法。
参考文献
- Antonia SJ et al., CheckMate 032: nivolumab alone or in combination with ipilimumab for the treatment of recurrent small cell lung cancer. J Clin Oncol 34, 2016 (suppl; abstr 100)
- Rudin CM et al., Safety and efficacy of single agent rovalpituzumab tesirine (SC16LD6.5), a deltalike protein 3 (DLL3)-targeted antibody-drug conjugate (ADC) in recurrent or refractory small cell lung cancer (SCLC). J Clin Oncol 34, 2016 (suppl; abstr LBA8505)
- Pietanza MC et al., A multi-center, randomized, double-blind phase II study comparing temozolomide plus veliparib, a PARP-inhibitor, or placebo as 2nd or 3rd-line therapy for patients with relapsed small cell lung cancers. J Clin Oncol 34, 2016 (suppl; abstr 8512)
- Tiseo M et al., Italian multicentre phase III randomised study of cisplatin-etoposide with or without bevacizumab as first-line treatment in extensive small cell lung cancer (SCLC): GOIRC-AIFA FARM- 6PMF JM trial. J Clin Oncol 34, 2016 (suppl; abstr 8513)
- Kotsakis A et al., Salvage treatment of relapsed/ refractory small cell lung cancer with pazopanib: a Hellenic Oncology Research Group’s (HORG) phase II study. J Clin Oncol 34, 2016 (suppl; abstr 8561)
- Faivre-Finn C et al., Concurrent ONce-daily Versus twice-daily RadioTherapy: a 2-arm randomised controlled trial of concurrent chemo-radiotherapy comparing twice-daily and once-daily radiotherapy schedules in patients with limited-stage small cell lung cancer and good performance status. J Clin Oncol 34, 2016 (suppl; abstr 8504)
More posts
寡转移性非小细胞肺癌中局部治疗产生的无进展生存期改善
寡转移性非小细胞肺癌中局部治疗产生的无进展生存期改善 有证据表明存在一种“有限转移性” 的非小细胞肺癌(NSCLC)表型。然而,针对这些患者的最佳治疗类型和积极局部治疗作用
局部晚期非小细胞肺癌:口服长春瑞滨显示出比依托泊苷更好的安全性
局部晚期非小细胞肺癌:口服长春瑞滨显示出比依托泊苷更好的安全性 进行的随机化、多中心、开放标签 II期 RENO 试验的目标在于建立局部晚期非小细胞肺癌(NSCLC)放化疗
ULTIMATE:在一线外采用化疗联合贝伐单抗
ULTIMATE:在一线外采用化疗联合贝伐单抗 由于化疗在二线或三线非小细胞肺癌(NSCLC)环境下表现得疗效有限,因此 III 期随机化 ULTIMATE 试验在接受一线
新治疗方法为小细胞肺癌患者带来希望
新治疗方法为小细胞肺癌患者带来希望 小细胞肺癌(SCLC)在肺癌病例中占比高达 10 %到 15 %,但在过去 30 到40 年里对这种疾病的治疗方面进展不大。SCLC 对
突变分析:在通向完善标准的道路上前行
突变分析:在通向完善标准的道路上前行 LCMC II 肺癌突变联盟(LCMC)是一个旨在研究肺腺癌驱动突变的多机构联盟。参与合作机构支持鉴别出相对大量带有不常见和罕见变异的
“一线和二线靶向药物的重要性显而易见”
“一线和二线靶向药物的重要性显而易见” Nir Peled MD, PhD, FCCP, Head of the Thoracic Cancer Unit, Thoraci