小細胞がんの治療に関する最新ベンチマーク
KEYNOTE-158
進展型小細胞肺がん(ED-SCLC)は一次治療によく反応するが、早期再発も多く起こり、予後は不良である。今日まで、バイオマーカー駆動療法は確立されていない。
SCLCの病態生理学における免疫システムの関与およびこの疾患の高い変異負荷に基づいて、免疫療法は、新規治療としての可能性を秘めている[1-3]。高頻度マイクロサテライト不安定性(MSI-H)を有するがんを含む10タイプの腫瘍で実施された第II相バスケット試験KEYNOTE-158は、バイオマーカーの状態にかかわらず進展型小細胞肺がんにおける抗PD1抗体ペムブロリズマブを評価した[4]。標準療法の進行または不耐容を経験した切除不能および/または転移性SCLCを有する前治療歴がある患者は、ペムブロリズマブ200mg Q3W投与を2年間または進行するまでの期間受けた。主要評価項目をORRとする。107人の患者のうち、16人(15%)は安定した脳転移を有していた。コホートには、カルチノイドを有する患者1人および神経内分泌腫瘍を有する患者7人が含まれていた。
集団の3分の1は過去に2種の治療を受けており、23%が3種以上の治療を受けていた。ベースラインでは、腫瘍の39%および47%がそれぞれPD-L1陽性およびPD-L1陰性であり、14%は評価できなかった。さらに、バイオマーカー解析では、91%に非MSI-H状態(すなわち、マイクロサテライト安定性およびマイクロサテライト不安定性)をもたらし、9%は評価できなかった。
PD-L1陽性群の優れた結果
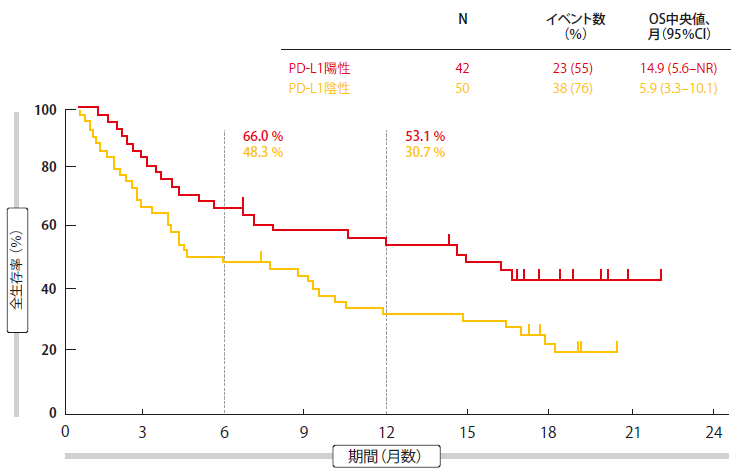
総体的に、奏効は18.7%に認められ、病勢コントロール率は30%であった。PD-L1陽性腫瘍の患者は35.7%であったが、PD-L1陰性群では6.0%に過ぎなかった。病勢コントロール率はそれぞれ43%と20%であった。これらの知見が、過去に治療を受けた進展型PD-L1発現腫瘍を有する患者を対象に、ペムブロリズマブを評価した第IB相KEYNOTE-028試験のSCLCコホートと一致することを指摘した[5]。重要なことに、奏効は持続性が証明された。平均期間は、解析期間の時点では未到達であり、12人の患者(73%)が1年以上奏効した。PD-L1陽性患者およびPD-L1陰性患者のPFS中央値はそれぞれ2.1ヶ月および1.9ヶ月であった。それぞれのOS結果は、14.9ヶ月および5.9ヶ月であった(図1)。12ヶ月では、それぞれ53.1 % および 30.7 %の患者が生存していた。
安全性プロファイルは、他の腫瘍タイプにおいてペムブロリズマブ単独療法のものと一致した。新たに診断されたED-SCLC患者対象の進行中の第III相KEYNOTE-604試験において、ペムブロリズマブ+標準化学療法(すなわち、エトポシド/プラチナ)が評価されている。
図1:ペンブロリズマブで治療したPD-L1陽性患者群の全生存率の結果
デュルバルマブ単独およびトレメリムマブと併用
SCLC対象に検討された別のチェックポイント阻害剤として、抗PD-L1抗体デュルバルマブが挙げられる。この薬剤は、単剤としても、抗CTLA-4抗体トレメリムマブとの併用でも両方で効果を示した。多施設非盲検ED-SCLC拡大コホート1108試験の単独療法試験で、最大12ヶ月間デュルバルマブ10mg / kg Q2Wを投与した特定の患者において持続性のある臨床効果を示した[6]。患者21人中2人(ORR, 9.5 %)のみが奏効したが、それぞれ14.6ヶ月および29.5 ヶ月以上続いた。2人目の患者はプラチナ製剤不応性であり、過去に3種類の治療を受けていた。PFSおよびOS中央値はそれぞれ1.5ヶ月および4.8ヶ月であった。12ヶ月間のOS率は27.6%に達した。デュルバルマブは良好な忍容性を示し、グレード3/4のAEは観察されなかった。
用量調整/拡大試験であった多施設非盲検併用試験第I相では、選ばれた進行固形腫瘍を有する過去に治療歴がある患者を対象に、デュルバルマブ20mg/kg Q4Wおよびトレメリムマブ1mg/kg Q4Wを4回投与した。併用後、患者はデュルバルマブ10mg/kg Q2Wの投与を12ヶ月間受けた。Cho らは2018年ASCO学会で、ED-SCLC用量拡大コホート(n = 30)における臨床効果および安全性の最初の報告を発表した[7]。
非小細胞肺がんの結果[8]と一致して、デュルバルマブとトレメリムマブは有望な効果を示した。確認されたORRは、完全奏効2人と部分奏効2人を含む13.3%であった。プラチナ製剤抵抗性/プラチナ製剤不応性の患者3人が治療に奏効した。奏効は早期に起こり、持続性があった(DOR中間値, 18.9 ヶ月)。6ヶ月PFSは16.3%であり、12ヶ月OSは41.7%であった。治療関連AEによる中止または死亡はなかった。グレード3/4の治療関連AEは23.3%であった。単独療法データとともに、ED-SCLC患者におけるデュルバルマブの活性を示すと結論付けた。現在進行中の試験には、プラチナ不応性患者対象のデュルバルマブ+トレメリムマブ投与をしている第Ⅱ相オープンラベルBALTIC試験とトレメリムマブ+プラチナベースの化学療法単独vs化学療法の有無にかかわらずデュルバルマブをファーストライン治療として投与する第III相CASPIAN試験がある。
二次治療ルルビネクテジン単独療法の魅力的な効果
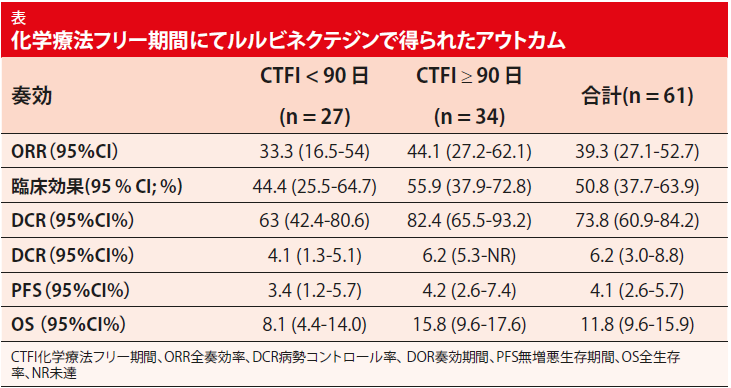
ルルビネクテジンは、転移を遮断し、DNA二本鎖切断を誘導してアポトーシスを引き起こす新しい抗がん剤だ。Trigoらは、いくつかの進行固形腫瘍において、61名のSCLC患者を対象に、ルルビネクテジン3.2mg /m2 Q 3W の有効性と安全性を評価する多施設第2相バスケット試験を行い、結果を提示した[9]。SCLC群は、1度の過去化学療法治療歴をもっていた。脳転移は認められなかった。この解析のために、集団を化学療法フリー間隔(CTFI)に従い分割した。34人および27人の患者は、CTFIがそれぞれ90日以上および90日未満であった。
長期CTFIを有する群は、ORR、臨床的有益性、病勢コントロール率、DOR、PFS、およびOSに関してより良好な傾向が示された(表)。6カ月の時点で、全集団の36.3%の患者が生存しており、進行がなかった。割合はそれぞれ42.8%と28.1%であり、CTFIがそれぞれ90日以上、90日未満であった。同様に、12ヶ月OSは59.1%と22.9%であった。この集団で観察された安全性プロファイルは、予期せぬ毒性または薬剤関連死亡なしに許容され、忍容性が良好であった。試験担当医らによると、これらの結果は、再発SCLC患者のための代替療法として、ルルビネクテジン単剤投与が考えられることを示唆している。
三次治療Rova-T
神経内分泌腫瘍における革新的標的として、非定型阻害性ノッチリガンドデルタライクプロテイン3(DLL3)がある。これは、がん幹細胞および腫瘍細胞の両方で発現するものだが、正常な成体組織では発現しない。SCLC患者の85%以上がDLL3を発現するが、標準治療の予後アウトカムはない。 Rovalpituzumab tesirine (Rova-TTM)は、抗体薬物複合体であり、DLL3を分子標的治療するために開発された。第I相試験によると、56人の再発性SCLC患者のORR は16%だった。ここでは、DLL3発現が最も高い患者の31%に奏効がみられ、OS中央値は5.8ヶ月であった[10]。
第Ⅱ相単群TRINITY試験では、少なくとも1回プラチナベースのレジメンを含む2回以上過去に治療を受けたDLL3発現を有している再発難治性SCLC患者339人を対象に、Rova-T 0.3mg /kg(2回投与、6週間間隔)を投与した[11]。進行中再治療が可能であった。TRINITY試験に参加している患者の70%は、DLL3高発現、すなわち腫瘍内の細胞の75%以上がDLL3を発現していると定義された。安定したCNS転移が認められた。339人の登録患者のうち、23%がファーストライン治療の際のプラチナ療法に抵抗性または不応性を経験した。77%が過去2度治療を受けていた。脳転移は40%にみられ、25%には胸水の病歴があった。
臨床的効果70%以上
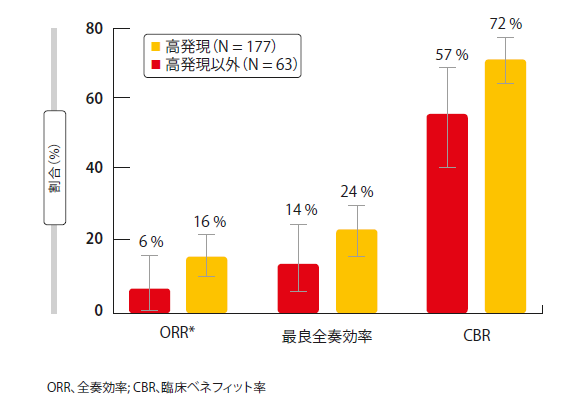
主要評価項目をORRとする。試験担当医らによると、ORRはコホート全体で18.0%、DLL3高発現サブグループで19.7%だった。これらの結果は、IRCあたり12.4%と14.3%だった。OS中央値は群全体とDLL3高発現の患者でそれぞれ5.6ヶ月と5.7ヶ月であった。奏効率は、三次治療や四次治療でより高いようであった(試験担当医によると三次治療と四次治療ではそれぞれ29%および23%)。重要なことに、試験担当医とIRCによると、三次治療と四次治療では、臨床的有効率(完全奏効と部分奏効+疾患安定)は70%以上だった。奏効は、DLL3高発現になるほど高まるようであった。DLL3陽性だが高発現ではない患者とは対照的に、DLL3高発現の患者では、ORR、全奏効率および臨床有効率の改善がみられた(図2)。奏効の約40%が治療開始10週間後にみられた。IRCによるDORは、三次治療と四次治療でそれぞれ4.1ヶ月および2.8ヶ月であった。DLL3高発現患者のIRCで評価されたPFSおよびOSは、すべての治療段階において、それぞれ3.8ヶ月および5.7ヶ月であった。
治療関連の重篤なAEは30%で発生し、グレード3以上のAEは40%で生じた。全身性浮腫、肺炎、腹水、薬剤誘発性肝障害、胸水、気胸、呼吸不全、および敗血症のために、試験中10人に致死的AE(3%)が発生した。治療中止につながったAEは5%であった。最も多かったAEは、光線過敏性(35%)、胸水(28%)、疲労(28%)、末梢浮腫(26%)、血小板減少症(22%)だった。治療前に既に滲出液を発症していた患者では、高度の漿膜滲出液のリスクが増加するようであった。
試験担当医は、Rova-Tが二次治療に留まらずSCLCに有効な薬剤であると結論づけたが、現在治療法は承認されていない。Rova-Tは、MERUおよびTAHOE第Ⅲ相試験で評価されており、これらの試験では、この薬剤を第一線での維持管理およびセカンドライン治療としてそれぞれ評価している。化学療法、ニボルマブ、およびニボルマブ/イピリムマブと併用したRova-Tの効果をみる複数の第I相試験も現在進行中である。
図2:DLL3高発現および高発現以外の患者のORR、最良全奏効率および臨床ベネフィット率
SCLC形質転換後に何が起こるか?
TKI治療に対する耐性から、EGFR遺伝子変異腺がんの3-10%がSCLCを含む高悪性度神経内分泌がんに変わる[12]。EGFR遺伝子変異を有するノボSCLCの症例が報告されている[13]。SCLCで形質転換されたEGFR陽性肺がんの特徴および臨床経過は大部分が未知であったため、Marcoux et alは、EGFR遺伝子変異SCLCを有する67人の患者をレトロスペクティブレビューをした[14]。転移性がんの初期診断では、58人(87%)が非小細胞肺がん患者と一致した病理を有し、9人(13%)はSCLCエビデンスを有していた。5人が純粋なSCLC組織型であり、4人はSCLC成分を含む混合組織型であった。患者は、形質転換前に、2度の全身治療を受けた。形質転換の時点で、93%がEGFR TKIで治療された。転移性非小細胞肺がん患者の初期診断とSCLC初期エビデンスの中央値は17.8ヶ月であった。
遺伝子型を調べた全患者は、形質転換時に最初のEGFR遺伝子変異を維持した。過去にT790M陽性であった患者の大多数(79%)は、形質転換時にT790Mが検出されなくなった。次に多く観察された遺伝子変異は、TP53, RB1 そしてPIK3CA変異だった。遠隔転移した肺がんの診断時からのOS中央値(31.5ヶ月)は、SCLCに決して変換されないEGFR遺伝子変異を有する患者の期待されるOSと類似していた。また、SCLCのEGFR遺伝子変異が最初に確認された時点からのOSの中央値(10.9ヶ月)はデノボSCLCのデータとも同等であったプラチン+エトポシドおよびタキサンに反応した患者は多かったが、一時的であった。重要な点として、この解析では、チェックポイントイン阻害剤療法に対する奏効は示されなかった。これらのEGFR遺伝子変異腫瘍の最適な診断および治療アプローチをより明確にするために、さらなる研究が必要であるとまとめた。
参照
- George J et al., Comprehensive genomic profiles of small cell lung cancer.Nature 2015; 524(7563): 47-53
- Maddison P et al., Favourable prognosis in Lambert-Eaton myasthenic syndrome and small-cell lung carcinoma.Lancet 1999; 353(9147): 117-118
- Peifer M et al., Integrative genome analyses identify key somatic driver mutations of small-cell lung cancer.Nat Genet 2012; 44: 1104-1110
- Chung HC et al., Phase 2 study of pembrolizumab in advanced small-cell lung cancer: KEYNOTE-158.J Clin Oncol 36, 2018 (suppl; abstr 8506)
- Ott PA et al., Pembrolizumab in patients with extensive-stage small-cell lung cancer: results from the phase Ib KEYNOTE-028 study.J Clin Oncol 2017; 35(34): 3823-3829
- Goldman JW et al., Safety and antitumor activity of durvalumab monotherapy in patients with pretreated extensive disease small-cell lung cancer.J Clin Oncol 36, 2018 (suppl; abstr 8518)
- Cho D et al., Safety and clinical activity of durvalumab in combination with tremelimumab in extensive disease small-cell lung cancer.J Clin Oncol 36, 2018 (suppl; abstr 8517)
- Antonia S et al., Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study.Lancet Oncol 2016; 17; 299-308
- Trigo JM et al., Efficacy and safety of lurbinectedin (PM1183, Zepsyre®) in small cell lung cancer (SCLC): results from a phase 2 study.J Clin Oncol 36, 2018 (suppl; abstr 8570)
- Rudin CM et al., Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study.Lancet Oncol 2017; 18(1): 42-51
- Carbone DP et al., Efficacy and safety of rovalpituzumab tesirine (Rova-TTM) in patients with DLL3-expressing, ≥ 3rd line small cell lung cancer: results from the phase 2 TRINITY study.J Clin Oncol 36, 2018 (suppl; abstr 8507)
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors.Sci Transl Med 2011; 3(75): 75ra26
- Okamoto I et al., EGFR mutation in gefitinib-responsive small-cell lung cancer.Ann Oncol 2006; 17(6): 1028-1029
- Marcoux N et al., Outcomes of EGFR-mutant lung adenocarcinomas that transform to small cell lung cancer.J Clin Oncol 36, 2018 (suppl; abstr 8573)
More posts
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング 肺がんの早期発見は、未だ医学において解決されていない。低線量コンピュータ断層撮影法(LDCT)は、高
小細胞がんの治療に関する最新ベンチマーク
小細胞がんの治療に関する最新ベンチマーク KEYNOTE-158 進展型小細胞肺がん(ED-SCLC)は一次治療によく反応するが、早期再発も多く起こり、予後は不良である。今
16 ALK陽性疾患:治療の可能性が広がる
16 ALK陽性疾患:治療の可能性が広がる ALEX試験で確認されたアレクチニブのCNSおよび非CNSの有効性 ALK陽性進行非小細胞肺がん患者の標準治療には、第1世代AL
「シーケンシングの課題」
「シーケンシングの課題」 インタビューカナダ、バンクーバー Barbara Melosky、MD、FRCPC、University of British Columbia
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ エルロチニブ+ベバシズマブ EGFR TKI治療は、進行性EGFR遺伝子変異陽性の非小細胞肺がん患者のための標準
免疫チェックポイント遮断:治療成功の成功のカギを握る要素
免疫チェックポイント遮断:治療成功の成功のカギを握る要素 PD-L1発現以外にもさまざまな臨床的要素が、免疫チェックポイント阻害の有効性の予測因子として検討されている。特に