第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ
エルロチニブ+ベバシズマブ
EGFR TKI治療は、進行性EGFR遺伝子変異陽性の非小細胞肺がん患者のための標準的な一次治療である。確立された薬剤には、第1世代のゲフィチニブおよびエルロチニブ、第2世代のアファチニブおよびダコミチニブ、ならびに第3世代のTKIオシメルチニブがある。EGFR TKIと他の薬剤を併用することで最大の治療成果が得られることがあり、ベバシズマブおよびラムシルマブなどの抗血管新生阻害剤の追加投与が例として挙げられる。
NEJ026試験は、一次治療として抗VEGF抗体ベバシズマブとエルロチニブの併用療法を調べるための最初の第III相試験である[1]。第Ⅱ相では、無作為化JO25567試験でエルロチニブ単独療法と比較したときのエルロチニブ+ベバシズマブの有意なPFS効果が示されている[2]。これらの結果を再確認するために、NEJ026試験が実施された。活性型EGFR 遺伝子変異を有する非扁平上皮がんでステージIIIB / IVまたは術後再発の非小細胞肺がんの日本人患者を対象に、ベバシズマブ15mg / kg Q3W +エルロチニブ150mg 1日1回(QD; n=112)またはエルロチニブ単独(n = 112)のいずれかを投与した。病勢進行後、被験群はプラチナ製剤とペメトレキセドで治療を受け、続いてペメトレキセドで維持治療を受けた。対照群はプラチナ製剤+ペメトレキセドとベバシズマブ、その後ペメトレキセドとベバシズマブで治療を続けた。無症候性の中枢神経系(CNS)転移の患者は各群の32.1%に及んだ。
独立審査委員会の評価によるPFSを主要評価項目とした。PFSの中間解析は、ベバシズマブの追加が有意なPFS延長をもたらしたと発表した。(16.9 vs. 13.3 ヶ月; HR, 0.605; p = 0.01573) [1]エクソン19欠失およびエクソン21L858R変異を有する患者には併用が有益であった。独立審査委員会の評価によるORRは治療群全体で有意な差がなかった(72.3 %. vs 66.1 %)。出血、蛋白尿、高血圧はベバシズマブ群でより頻繁に発生したが、管理可能なものであった。試験担当医が指摘したように、エルロチニブ+ベバシズマブは、EGFR変異陽性の非小細胞肺がんの新たな一次治療となる。バイオマーカー解析とOSの追跡が進行中である。
ゲフィチニブと化学療法の同時併用
NEJ002試験では、ゲフィチニブ治療は、標準化学療法(10.8 vs. 5.4 ヶ月; HR, 0.30; p < 0.001) [3]と比較してPFS改善をもたらしたが、OSに有意差はなかったことがわかった。また、ゲフィチニブ群の70%のみが標準的なPOST-TKI治療としてプラチナダブレット化学療法を受けた。したがって、EGFR TKI治療と化学療法の両方を徹底的に使用することにより、OSの改善が期待された。
事実、第II相NEJ005試験では、逐次レジメンと比較して、ゲフィチニブと化学療法の同時使用による有望な効果を示唆している[4]。第III相NEJ009試験でゲフィチニブQD+カルボプラチンとペメトレキセドの同時投与を4〜6サイクルで行った[5]。維持療法には、進行までゲフィチニブ+ペメトレキセドQ3Wを投与した。一方、対照群は、進行までゲフィチニブQDを受け、二次治療にはプラチナベースが推奨された。
PFS、PFS2およびOSを主要評価項目とした(すなわち、対照群における二度目の病勢進行[PD2]および被験群における最初の病勢進行[PD1]の時点でのPFS比較 図)。日本全体で、非扁平上皮がん、未治療ステージIIIB / IVまたは再発性非小細胞肺がんの患者345人が47の施設にて登録した。
図: NEJ009試験で定義されたPFSアウトカム
最初の病勢進行までの期間
PFS1(20.9 vs. 11.2ヶ月; HR, 0.494; p < 0.001)およびORR(84.0 % vs 67.4 %)に関しては予想通り、併用療法のほうが優れている。これは、被験群におけるかなり長いゲフィチニブ治療曝露(730日間vs 462日間)に起因する可能性が高い。PD1の時点で、患者の臨床状態(すなわち、ECOG PS、転移性器官の数、脳転移)は、試験群で同等であった。しかし、これはPD2では当てはまらず、連続して治療を受けた患者の状態はかなり悪化した。PFS2解析では、2つのレジメンに差はなかった。(20.9 vs. 20.7 ヶ月; HR, 0.966; p = 0.774)
追加のOS解析により、併用レジメンの有意な利点が明らかになった。(52.2 vs. 38.8 ヶ月; HR, 0.695; p = 0.013)ゲフィチニブ単独群の患者の大部分が最初の病勢進行の後にプラチナレジメンを受けたにもかかわらず、PD1生存率に差はなかった(19.3 vs. 23.0 ヶ月; HR, 1.037; p = 0.812)。これは、OSがPFS2ではなくPFS1に密接に関連していることを示す。最初の病勢進行までの期間の延長は、EGFR遺伝子変異非小細胞肺がんの患者にとって重大であり、PFSはOSの代理マーカーであると結論付けた。
血液学的AEの発生は併用群のほうが多かった。一方、毒性のために治療を中止した患者は両群ともごくわずかであった。総体的に、未治療の進行EGFR変異陽性非小細胞肺がんに対して、カルボプラチンとペメトレキセドにゲフェチニブを追加するとPFSおよびOSが有意に改善し、毒性は許容範囲であった。したがって、併用レジメンは、このような状況下では効果的な一次治療となる。
ARCHER 1050試験で得られたOSの結果
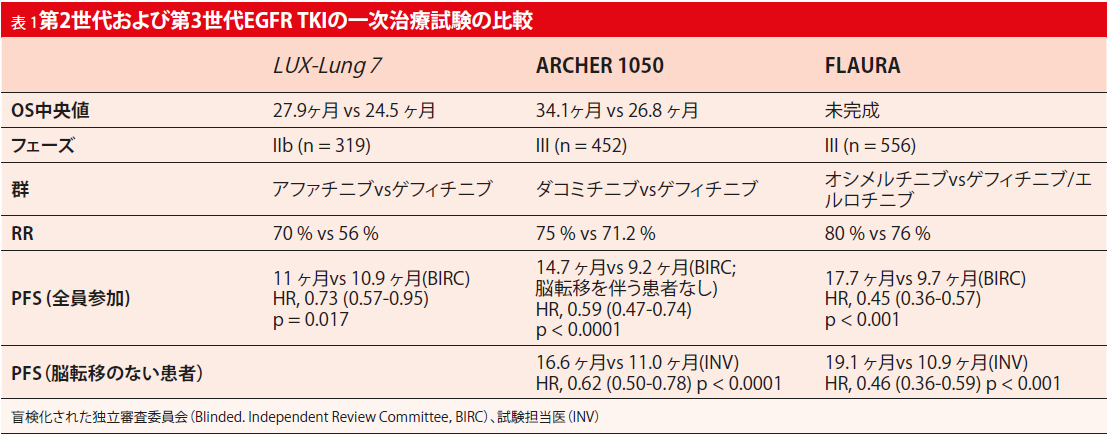
第2世代の不可逆的EGFR TKIダコミチニブは、第III相無作為化非盲検ARCHER 1050試験で治験された。Wu らは、進行EGFR変異陽性非小細胞肺がん(14.7 vs. 9.2 ヶ月; HR, 0.59; p < 0.0001)の患者における一次治療としてのダコミチニブvsゲフィチニブの有意なPFS改善を報告した[6]。合計452人の患者に、ダコミチニブ45mg QDまたはゲフィチニブ250mg QDを投与した。脳病変を有する患者においてダコミチニブの有効性は、試験開始時では不明であったため、この試験では、中枢神経系に転移がない患者を対象に行われた。両群の70%-80%はアジア人だった。約60%が65歳未満だった。
2018年ASCO学会で発表されたARCHER 1050試験の最終的なOS解析では、OSの改善を実証するために2つの一次治療EGFR TKIを比較した最初の無作為化第III相試験であると発表した[7]。OS結果の中央値は、ダコミチニブとゲフィチニブのそれぞれ34.1ヶ月 vs 26.8カ月 (HR, 0.76; p = 0.0438)であった。30ヶ月時点で、56.2 % vs 46.3 %の患者が生存していた。サブグループ解析では、エクソン19欠失(HR, 0.88; p = 0.4862)またはエクソン21 L858R変異(HR, 0.707; p = 0.0805)の患者に2種の治療法におけるOSの差はなく、本試験自体がサブグループでの生存効果の差を検出できるものではなかった。同様に、アジア人の患者のOS解析は、有意な治療効果を示さなかった。(HR, 0.812; p = 0.1879)第3世代EGFR TKI治療(集団の9.7%)を受けたダコミチニブ治療患者のOS中央値は36.7ヶ月であった。継続治療で他のEGFR-TKIを受けた患者のOSは、34.7ヶ月だった。
ダコミチニブによるEGFR阻害活性の増加は、グレード3以上の13.7%のざ瘡様皮膚炎、8.8%の下痢、7.5%の爪囲炎を伴う典型的なAEを引き起こした。一方、ゲフィチニブは、グレード3以上の肝酵素上昇を引き起こした。AEの発生で被験群で必要に応じて頻繁に用量変更を行った(ゲフィチニブ66.5 % vs 8.0 %)。ダコミチニブは、進行EGFR変異陽性非小細胞肺がんの一次治療の新しい選択肢として考えられるべきであると結論付けた。
ARCHER 1050試験のデータの見通し
National Cancer Centre SingaporeのDr. Daniel Tanは、2つの第III相試験ARCHER 1050試験およびNEJ009試験では、まだ課題は残っているとはいえ、最終的に標準EGFR TKIよりもOS効果があると指摘した[8]。以前のEGFR TKIはすべてPFSに基づいて一次治療として承認されたが、潜在的にクロスオーバーに起因するOSには有意差は認められなかった。Dr. Tanは、ARCHER 1050試験と第2世代および第3世代のEGFR TKIを検証する他の主な一次治療の試験と比較すると、ゲフィチニブ対アファチニブを比較したLUX-Lung 7試験(n = 319)では、ARCHER 1050試験(n = 452; 表1)より症例数が少なかったと述べた。また、これは第IIb相試験であり、OSの差の検出を混乱させる可能性がある。脳転移のある患者がLUX-Lung 7試験には含まれていたが、ARCHER 1050試験には含まれていなかった。ダコミチニブの長期忍容性は潜在的な懸案事項であり、最適な薬理学的活性用量を定義する必要性が高まっている。他の未解決の課題として、第2世代および第3世代のTKIのシーケンシングがある。
また、オシメルチニブをいつ使用するのかの疑問が残っている。FLAURA試験のOSデータはまだ成熟しておらず、耐性メカニズムは明らかにされておらず、不確実だ。Dr. Tanは、EGFR遺伝子変異肺がんは、臨床的およびゲノム的に異質の疾患であることを強調した。初回治療がその発生を増強する可能性があるため、初回治療を正当化するためにも個別に進行リスクを評価することがますます重要になる。Dr. Tanは、これらの標準治療候補のリスク・ベネフィット比を批判的に評価し、個々の患者の好みに合わせて調整する必要があると述べた。
アファチニブに関するリアルワールドエビデンス
忍容性に基づいたアファチニブ用量調整は、LUX-Lung試験において、有効性に影響を与えずに、AEの発生率および重症度を減少させた。Halmos らは、リアルワールドエビデンスの有効性および安全性に関するアファチニブ用量調整の影響を報告した[10]。一次治療にアファチニブの投与を受けた13カ国計228人の患者が、非侵襲的な観察試験に登録した。
LUX-Lung試験と同様に、アファチニブ用量調整は、有効性に影響を与えることなくAEの発生率および重症度を減少させた。無増悪期間および治療期間は、用量の変更または開始用量の減少にかかわらず同様であった。40mg以上の用量で開始した患者の67%に減少があり、そのうちの86%が最初の6ヶ月に減少した。12%は量を増加した。用量調節の主な理由はAEであった。調節が多かったのは女性、高齢者、東アジア人、比較的低体重の患者で
あった。この解析では、新たな安全性のシグナルは確認されなかった。同結果は、アウトカムを最適化するために、個々の患者の特徴およびAEに基づいて、アファチニブ用量を調整するベネ
フィットを強調している。
アファチニブを受けた患者128人の日本の解析では、実臨床でのアファチニブによる臨床アウトカムに着目した。76人が一次治療でアファチニブを受け、52人は再治療であった[11]。ア
ファチニブの使用は、過去の試験と比較して同等またはより良いアウトカムを出した。一次治療では、PFSとOSはそれぞれ17.8ヶ月と39.5ヶ月であった。AEが原因で58人の患者(76.3%)では用量を減少したが、これはOSには影響しなかった(減少群39.5ヶ月、非減少群は未達; p = 0.37)。さらに、用量が減少した患者でさえ、非減少患者
よりも長いPFSを経験した(18.0 vs. 7.9 ヶ月; p = 0.016)。ORRは64%だった。再試験群のORRは、24%だった。
アファチニブと特異的変異(uncommon mutations)を有するEGFR 遺伝子変異
後ろ向きの施設共同研究では、スペイン臨床診療において特異的変異を持つEGFR遺伝子変異肺腺がんの患者を対象にアファチニブの有効性を評価した[12]。23のスペイン医療施設で2012年から2017年にかけて、アファチニブ治療を受けた非小細胞肺がん患者67名の医療記録のレビューを行った。患者の80%が一次治療としてアファチニブを受けていた。複雑変異(Complex mutations) (A群; n = 20)、エクソン20挿入変異(B群; n = 23)、または単独変異(Single mutations) (C群; n = 24)に分けて特異的変異を持つEGFR遺伝子変異を解析した。
この3群に臨床的特徴の差はな
かった。患者の18%は、減少した用量でアファチニブを開始し、24%は用量の減少が必要であった。アファチニブの奏効率は、A群およびC群(それぞれ70%と54%)がB群 (13 %;一対比較p < 0.001 とp = 0.013)より有意に高かった。コホート全体のOS中央値は19.9ヶ月であり、A群およびC群はB群と比較して、それぞれ0.27(p = 0.009)および0.40(p = 0.037)のHRが得られた。結論は、臨床診療で稀なEGFR遺伝子変異を有する非小細胞肺がん、特に複雑変異および単独変異に対してアファチニブは有効だった。しかし、エクソン20挿入変異を伴う患者ではさらなる戦略が求められる。
ネオアジュバント療法:ASCENT試験
ネオアジュバント療法でのアファチニブ投与は、化学放射線療法に適したステージIII、EGFR変異陽性非小細胞肺がん患者を対象に、第II相ASCENT試験で評価された[13]。2ヵ月間アファチニブ40mg QD投与を受けた後、ネオアジュバントTKIの使用で疾患の進行がなかったことを条件に、患者は化学放射線療法と外科切除を受けて2年間アファチニブ40mgQD投与を受けるアジュバント療法を受けた。手術後、アジュバント療法アファチニブに続くアジュバント化学療法は任意である。
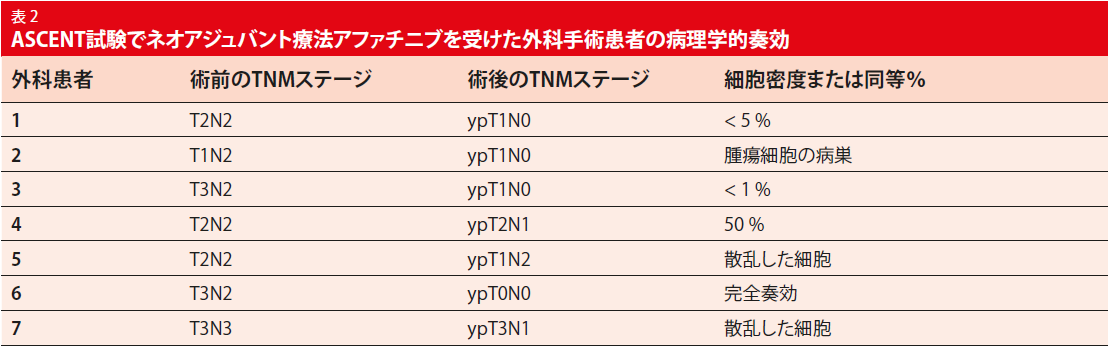
この解析には13人の患者しか含まれていなかったが、75%の良好なネオアジュバント奏効率であった。外科手術の有無にかかわらず化学放射線療法は、ネオアジュバントのアファチニブ投与に影響を受けなかった。手術を受けた7人のうち6人は臨床的に有意な病理学的奏効を経験した(すなわち、不十分な細胞、5%未満の細胞密度; 表 2)。PFS中央値は34.8ヶ月であり、解析の時点で7人の患者には再発がなかった。この結果は、遺伝子型アプローチを支持するPACIFIC試験[14]の免疫療法群で観察された16.8ヶ月のPFSアウトカムと比較して良好である。PACIFIC試験は、切除不能な局所進行ステージIII非小細胞肺がん患者においてPD-L1阻害剤デュルバルマブをプラセボと比較した。試験担当医はネオアジュバント療法としてアファチニブを2ヶ月間投与することは、アジュバント療法としてのTKIの使用を凌ぐ可能性があるとした。ASCENT試験は進行中である。
抗EGFR治療のTMBの意義
腫瘍変異負荷(TMB)は、特定の治療および疾患環境に依存する複数の生物学的影響をもつ。免疫療法では、TMBと改善された治療ベネフィットとの関係を示す。Offin らは、TMBは耐性経路の存在を代理する可能性がある標的療法において、TMBがアウトカムとは異なる(そして逆の)関係を有する可能性があると仮説した[15]。試験担当医らは、治療前の組織に対して、腫瘍プロファイリングをする次世代のシーケンシングMSK-IMPACTTMを利用した第1世代および第2世代EGFR TKIで治療したEGFR遺伝子変異(エクソン19欠失およびエクソン21 L858R変異)を有する153人の患者を特定した。初期EGFR TKI療法によるOSおよび治療中止期間(TTD)は、単変量解析および多変量解析のもとTMBに沿って評価した。
この結果は、EGFR変異陽性肺がんが、特定の発がん遺伝子疾患においても、広範囲のTMBで広い分子不均一性を有することを示した。試験担当医が推測したように、TMBはEGFR TKI治療の有効性と反比例していた。多変量解析(それぞれp = 0.025および0.009)により、高TMBを示す群では、OSおよびTTDはいずれもHRが0.49および0.57で最短であった。この関係は、TMBの多様かつ具体的コンテクストをハイライトする免疫療法で見られるものとは対照的である。
オシメルチニブ耐性:最新情報
第3世代EGFR TKIオシメルチニブは、第1世代または第2世代のEGFR TKI治療を経て、T790M陽性非小細胞肺がん患者を対象に、プラチナペメトレキセド化学療法と比較したとき、第III相AURA3試験において有意な臨床活性を示した[16]。さらに、一次治療としてエルロチニブまたはゲフィチニブと比較して、オシメルチニブは第III相FLAURA試験において有意なPFS効果をもたらした[17]。
非小細胞肺がんの治療に対するオシメルチニブの役割の増大にもかかわらず、この薬剤の耐性メカニズムに関するデータは限られている。しかし、オシメルチニブ耐性を克服するための戦略を開発するには、これらのメカニズムの包括的な理解が必要である。Le らは、オシメルチニブで治療を受けた患者を除外した上で、EGFR変異陽性非小細胞肺がん患者のMD Anderson Lung Cancer Moon Shot GEMINI、 Moffitt electronic health record、 Clinical Genomic Action Committee、およびpyrosequencing 法に基づいた解析を行った[18]。合計118人の患者が試験基準を満たした。ほぼすべての患者(95%)が前EGFR TKI治療、主にエルロチニブ投与を受けていた。
ゲノムプロファイリングでは、耐性メカニズムが多様であり、T790M温存およびT790M消失がそれぞれ約半数に及ぶことを示した。T790Mを有する症例では、C797S / L792H突然変異(58%)ならびにMET増幅がみられた。これは、EGFRの3次突然変異がこの群の共通のメカニズムであることを意味する。T790M消失を有する患者の耐性メカニズムは主に非依存性EGFRおよび非発がん性遺伝子ドライバーであった。(すなわち、PIK3CA変異、 MET増幅、 SCLC形質転換)細胞周期遺伝子変化は低い臨床アウトカムとのつながりを示した。
Zhang らは、臨床的にオシメルチニブ耐性の活性型EGFR遺伝子変異を有する110人の患者を対象に突然変異スペクトルに関する差異を解析した。オシメルチニブ耐性を可能にする突然変異は、19欠損変異を有する群の患者のほうがL8585R変異を有する群の患者よりも特定しやすいと示した(62.5 % vs. 39.1 %; p = 0.015) [19]。
オシメルチニブの奏効予測
これまでのAURA試験の縦断的解析では、オシメルチニブの投与を受けたT790M陽性進行性非小細胞肺がん患者のEGFR遺伝子変異血漿の早期クリアランスが改善したPFSの予後マーカーであると示唆していた[20]。 Shepherd らは、オシメルチニブ療法の開始後3および6週目で、AURA3試験に登録した患者のEGFR 遺伝子変異血漿の存在が臨床アウトカムに関連するかどうかを調べた[21]。
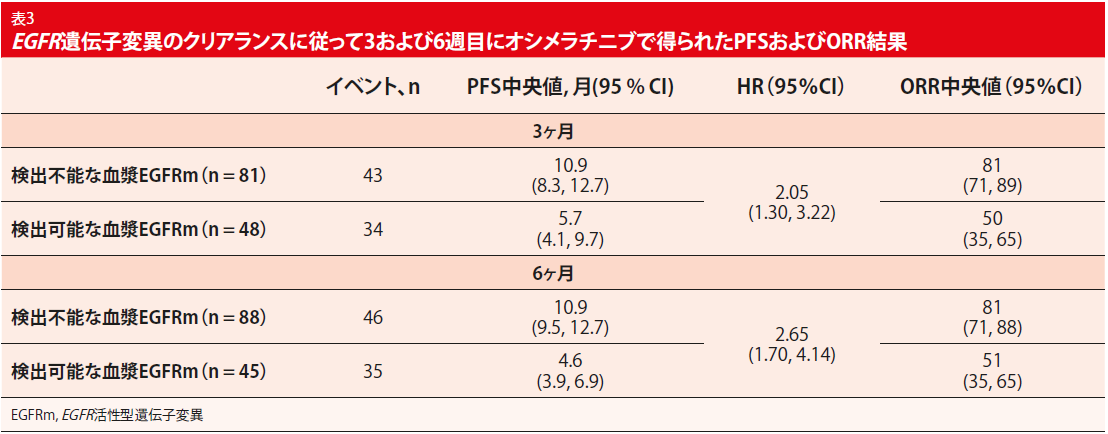
腫瘍脱落指標ベースライン血漿症例で検出可能なEGFR 遺伝子変異を有するオシメラチブ治療患者のアウトカムは、PFS(8.3 vs 14.0ヶ月)、ORR (68 % vs 75 %)のいずれも脱落なしの症例よりも良好ではなかった。試験担当医らは、検出可能な腫瘍脱落は疾患負荷の増大を反映している可能性があり、不良アウトカムに対する予後バイオマーカーの可能性があると結論付けた。
また、EGFR遺伝子変異血漿の早期動的変化は、第3週および第6週において、EGFR遺伝子変異の循環腫瘍DNA(ctDNA)の継続的存在があまり好ましくないPFSおよびORRの結果と関連していたとして、 T790M陽性非小細胞肺がんの治療を受けている患者のPFSを予測を可能にする可能性がある(表 3)。したがって、オシメルチニブの開始後3週間で臨床効果が不十分となる可能性のあるT790M陽性非小細胞肺がん患者を特定できる。EGFR 遺伝子変異においてのctDNAモニタリングは、アウトカムを最大にするために治療の変更を可能にする可能性がある。
オシメルチニブに対する奏効の予測を可能にするもう1つの早期マーカーは、18FDG-PET検査である。Yoon らは、第1世代EGFR TKI治療で病勢進行を示した25人の患者を対象とした、前向き非盲検単施設パイロット試験を実施した[22]。代謝反応(ΔSUVmaxの
20%以上の減少と定義) を伴うORRは76%であり、PFSおよびORRの中央値と有意に関連していた。オシメルチニブはT790M変異を持たない患者でも抗腫瘍活性を示した。
併用投与としてのラムシルマブ
進行中の第I相JVDL試験は、一次治療EGFR TKI後の、EGFR遺伝子変異T790M 陽性非小細胞肺がん患者を対象にヒト型抗VEGFR-2モノクローナル抗体ラムシルマブとオシメルチニブの併用を評価している。Planchard らは、 25人の患者の解析において、併用療法の安全性プロファイルが、毒性を有さない単独療法としての各薬剤の安全性プロファイルと一致することを示した[23]。高血圧、下痢、口内炎、発疹、および血小板減少症のAEが最も多かった。AEによる治療中止は4%のみであった。
さらに、この結果は、抗腫瘍活性を促進することを示唆している。完全奏効または部分奏効は76%、病勢コントロール率は92%であった。解析の時点でDOR中央値、PFS中央値に達しなかった。12ヶ月時点で、患者の57.5%が生存、進行がなかった。
新しい治療薬:ナザルチニブ
ナザルチニブは、野生型EGFRを有するEGFR遺伝子変異およびT790M変異を活性化する第3世代不可逆的EGFRTKIである。多施設共同オープンラベル第I / II相試験の第II相試験暫定結果によると、ナザルチニブは、ステージIIIB / IVのEGFR遺伝子変異非小細胞肺がんを有する治療未経験患者を対象に、許容可能な安全性プロファイルおよび有望な有効性を示した[24]。患者の40%がスクリーニング時に脳転移を呈した。
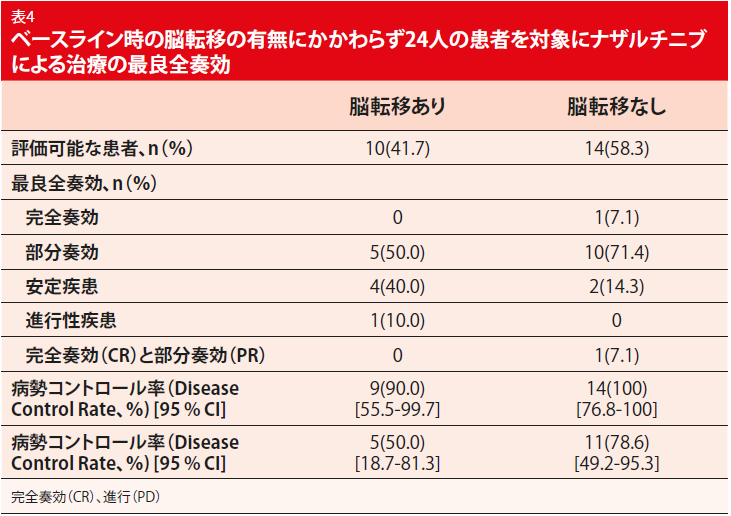
ナザルチニブは忍容性が高く、AEの大部分はグレード1または2であった。総体的に、安全性プロファイルは、下痢、ざ瘡様皮膚炎、乾燥皮膚、口内炎および爪囲炎などの典型的な毒性において良好であった。黄斑丘疹が最も頻繁なAEであったが、管理可能であることが証明された。ベースラインで脳病変を有する患者の割合が高いにもかかわらず、新しいTKIは、盲検化された独立審査委員会によると、66.7%のORRだった。病勢コントロール率は95.8%だった。大部分の患者は、標的病変の縮小を経験した。ナザルチニブは、脳転移の有無にかかわらず、患者に有効である(表 4)。PFSおよびDORデータは、データカットオフ時にはまだ未完成であった。治療未経験患者を対象にしたナザルチニブの効果を調べる第Ⅲ相試験は、2018年7月に開始する予定である。
参考文献
- Furuya N et al., Phase III study comparing bevacizumab plus erlotinib to erlotinib in patients with untreated NSCLC harboring activating EGFR mutations: NEJ026.J Clin Oncol 36, 2018 (suppl; abstr 9006)
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study.Lancet Oncol 2014; 15(11): 1236-1244
- Maemondo M et al., Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR.N Engl J Med 2010; 362(25): 2380-2388
- Sugawara S et al., Randomized phase II study of concurrent versus sequential alternating gefitinib and chemotherapy in previously untreated non-small cell lung cancer with sensitive EGFR mutations: NEJ005/TCOG0902.Ann Oncol 2015; 26(5): 888-894
- Nakamura A et al., Phase III study comparing gefitinib monotherapy to combination therapy with gefitinib, carboplatin, and pemetrexed for untreated patients with advanced non-small cell lung cancer with EGFR mutations (NEJ009).J Clin Oncol 36, 2018 (suppl; abstr 9005)
- Wu YL et al., Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial.Lancet Oncol 2017; 18(11): 1454-1466
- Mok TS et al., Improvement in overall survival in a randomized study comparing dacomitinib with gefitinib in patients with advanced non-small cell lung cancer harboring EGFR-activating mutations.J Clin Oncol 36, 2018 (suppl; abstr 9004)
- Tan DSW, Shifting Sands: improving on first-generation EGFR TKIs.ASCO 2018 Congress, Discussion of abstracts 9004 and 9005
- Park K et al., Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial.Lancet Oncol 2016; 17(5): 577-589
- Halmos B et al., Real-world dose adjustment study of first-line afatinib in pts with EGFR mutation-positive (EGFRm+) advanced NSCLC.J Clin Oncol 36, 2018 (suppl; abstr e21060)
- Tanaka H et al., Real world study of afatinib in first-line or re-challenge setting for patients with EGFR mutant non-small cell lung cancer.J Clin Oncol 36, 2018 (suppl; abstr e211713)
- Domine M et al., Clinical activity of afatinib in a cohort of patients with lung adenocarcinoma harbouring uncommon EGFR mutations: A Spanish retrospective multicentre study.J Clin Oncol 36, 2018 (suppl; abstr e21028)
- Sequist LV et al., The ASCENT trial: a phase II study of neoadjuvant afatinib, chemoradiation and surgery for stage III EGFR mutation-positive NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 8544)
- Paz-Ares L et al., PACIFIC: a double-blind, placebo-controlled Phase III study of durvalumab after chemoradiation therapy (CRT) in patients with stage III, locally advanced, unresectable NSCLC, ESMO 2017, abstract LBA1_PR
- Offin M et al., Tumor mutation burden and efficacy of EGFR-tyrosine kinase inhibitors in patients with EGFR-mutant lung cancers.J Clin Oncol 36, 2018 (suppl; abstr 9042)
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer.N Engl J Med 2017; 376: 629-640
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer.N Engl J Med 2018; 378(2):113-125
- Le X et al., Landscape of EGFR-dependent and -independent resistance mechanisms to osimertinib in EGFR-mutant NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 9087)
- Zhang Y et al., Landscape of osimertinib resistant mutations between the two common subtypes of EGFR 19del or L858R in NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 12108)
- Thress KS et al., Complete clearance of plasma EGFR mutations as a predictor of outcome on osimertinib in the AURA trial.J Clin Oncol 35, 2017 (suppl; abstr 9018)
- Shepherd FA et al., Early clearance of plasma EGFR mutations as a predictor of response to osimertinib in the AURA3 trial.J Clin Oncol 36, 2018 (suppl; abstr 9027)
- Yoon S et al., The role of FDG-PET during osimertinib treatment to predict the responsiveness of tumor early in patients with stage IV non-small cell lung cancer: A pilot study.J Clin Oncol 36, 2018 (suppl; abstr e21150)
- Planchard D et al., Efficacy and safety results of ramucirumab in combination with osimertinib in advanced T790M-positive EGFR-mutant NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 9053)
- Kim D-W et al., Preliminary phase II results of a multicenter, open-label study of nazartinib (EGF816) in adult patients with treatment-naïve, EGFR-mutant NSCLC.J Clin Oncol 36, 2018 (suppl; abstr 9094)
More posts
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング
非浸潤がん検出を可能にする血漿セルフリーDNAの包括的なシーケンシング 肺がんの早期発見は、未だ医学において解決されていない。低線量コンピュータ断層撮影法(LDCT)は、高
小細胞がんの治療に関する最新ベンチマーク
小細胞がんの治療に関する最新ベンチマーク KEYNOTE-158 進展型小細胞肺がん(ED-SCLC)は一次治療によく反応するが、早期再発も多く起こり、予後は不良である。今
16 ALK陽性疾患:治療の可能性が広がる
16 ALK陽性疾患:治療の可能性が広がる ALEX試験で確認されたアレクチニブのCNSおよび非CNSの有効性 ALK陽性進行非小細胞肺がん患者の標準治療には、第1世代AL
「シーケンシングの課題」
「シーケンシングの課題」 インタビューカナダ、バンクーバー Barbara Melosky、MD、FRCPC、University of British Columbia
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ
第3世代EGFRチロシンキナーゼ阻害薬(TKI)最新データ エルロチニブ+ベバシズマブ EGFR TKI治療は、進行性EGFR遺伝子変異陽性の非小細胞肺がん患者のための標準
免疫チェックポイント遮断:治療成功の成功のカギを握る要素
免疫チェックポイント遮断:治療成功の成功のカギを握る要素 PD-L1発現以外にもさまざまな臨床的要素が、免疫チェックポイント阻害の有効性の予測因子として検討されている。特に