早期NSCLC:有前景的(新)辅助方法
NEOSTAR试验
可切除非小细胞肺癌(NSCLC)患者需要有效的治疗选择,因为超过半数的I期至III期疾病患者经历复发[1]。Chen等人在他们的动物模型中证明,肿瘤PD-L1上调对转移的扩散和存活至关重要[2]。基于这些考虑,一些临床试验正在研究免疫疗法在新辅助条件下的潜在获益。 随机化II期NEOSTAR试验包括44名患有I期至IIIA期NSCLC的手术候选者[3]。将他们随机分配为在第1天、第15天和第29天接受3个剂量的3mg/kg纳武单抗(nivolumab),或者接受相同的纳武单抗方案并在第1天添加1 mg/kg易普利姆玛(ipilimumab)。在末剂量后3至6周内进行手术。主要病理缓解(MPR),即≤ 10 %存活肿瘤细胞,被定义为主要终点。据推测,与历史对照相比,纳武单抗和/或组合将产生大于使用诱导化疗所达到的MPR率。在构成意向治疗(ITT)人群的44名随机化患者中,23名接受纳武单抗单药,21名患者使用纳武单抗加易普利姆玛治疗。39名患者接受了手术切除。
临床获益与T细胞浸润增加
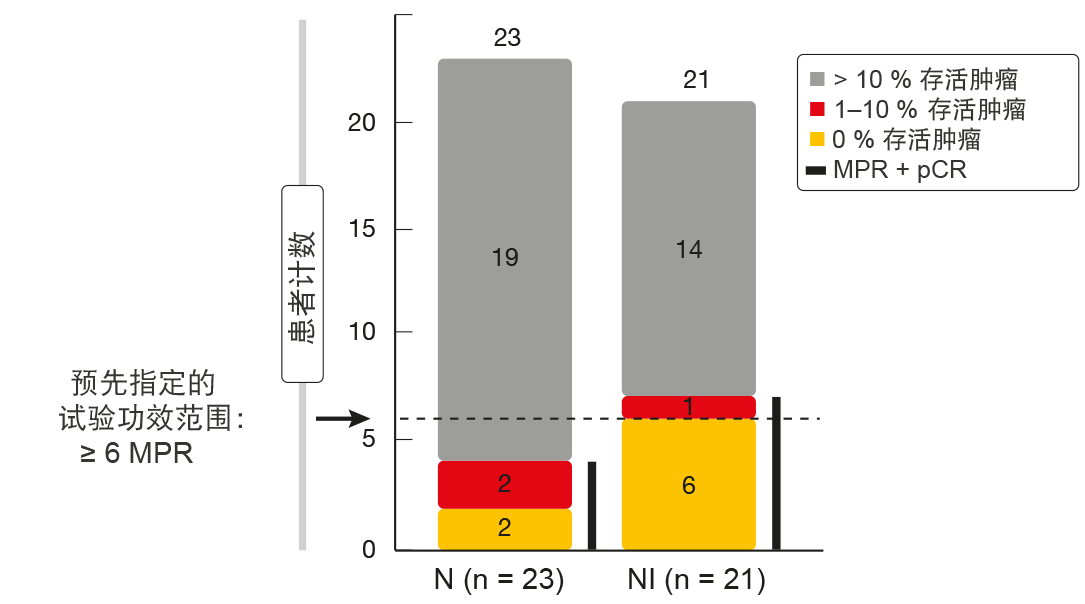
在组合组中观察到的MPR率满足预先指定的试验疗效范围。对于ITT人群,显示33 %的接受纳武单抗和易普利姆玛治疗的患者发生MPR加病理学完全缓解(pCR;即,0 %存活肿瘤细胞)(图1)。纳武单抗单药的这一比例为17 %。在切除的人群中,组合诱导44 %的MPR加pCR率,其中pCR占38 %(对于纳武单抗,MPR加pCR率为19 %)。根据成像,由RECIST确定的总体缓解率(ORR)分别占ITT人群的19 %和22 %。组合组中有一名患者(5 %)达到完全缓解(CR);在两组中,共有8名患者(36 %)有部分缓解(PR)。 未观察到不可接受的毒性或者围手术期发病率或死亡率的增加。然而,作者指出,在新辅助免疫疗法的背景下应当注意结节免疫突发,因为患者可能会由于出现肉芽肿而经历放射照相结节进展,需要与肿瘤生长进行区分。这很重要,因为如果临床医生无法区分结节免疫突发与疾病进展,可能会停止潜在的治疗手术。 RECIST缓解显示与MPR率呈正相关。升高的基线PD-L1表达与放射照相缓解和病理性肿瘤消退相关。根据缓解率的改善,通过流式细胞术对手术样品的免疫表征显示,联合治疗与较高频率的CD3阳性肿瘤浸润淋巴细胞以及组织驻留和效应记忆T细胞相关。此外,纳武单抗加易普利姆玛导致肿瘤中T细胞库多样性和反应性的增加。
图1:NEOSTAR:纳武单抗单药(N)和纳武单抗加易普利姆玛(NI)获得的病理缓解率
单药阿特朱单 (atezolizumab) : LCMC3
多中心II期LCMC3研究正在IB期、II期、IIIA期和经选择的IIIB期可切除和未经治疗的NSCLC患者中评估PD-L1抑制剂阿特朱单抗(计划进行,n = 180)。在手术前给予两个周期的阿特朱单抗。MPR构成主要终点。在2019年ASCO大会上,Kwiatkowski等人介绍了疗效中期分析的结果[4]。此时,安全性人群包括101名患者。其中90名(89 %)接受了手术,因此代表意向手术人群。84名切除的患者(83 %)进行了MPR评估。在排除EGFR和ALK阳性肿瘤患者后,主要疗效人群包括77名个体(76 %)。安全性人群中多达46 %的患者患有IIIA/IIIB期疾病,51 %患者显示出PD-L1表达。 在意向手术人群中,PR和疾病稳定(SD)分别达到7 %和89 %。对于主要疗效人群,MPR率为19 %,并且5 %的患者获得pCR。49 %患者的样本具有≥ 50 %的病理消退。作者认为,考虑到大部分患者处于疾病晚期,这些结果是令人鼓舞的。根据RECIST,病理消退与肿瘤病灶大小的变化适度相关。无论PD-L1表达和肿瘤突变负荷如何,均发生MPR和病理消退。此外,未观察到基因改变与MPR之间的显著关联。阿特朱单抗单药治疗耐受性良好,并且未出现新的安全性信号。由于此项中期分析通过了其无效边界,因此研究招募仍在继续。研究阿特朱单抗联合铂类化疗的安慰剂对照III期研究IMpower030正在进行当中。
化学免疫疗法:71 %的pCR
通过多中心单组开放标签II期NADIM研究测试了联合新辅助方法[5]。可切除IIIA期NSCLC患者接受3个周期的360 mg纳武单抗加紫杉醇(paclitaxel)和卡铂(carboplatin)化疗。手术在第三周期第21天之后的第3周或第4周进行。此后,给予包括纳武单抗的辅助治疗共一年。ITT人群包括46名患者,其中41名接受手术。 纳武单抗加化疗被证明是可耐受的。所有患者在手术前均未由于疾病进展或毒性而退出研究,并且任何患者均未延迟手术。未发生术中并发症,并且术后并发症是可控的。新辅助治疗使得几乎所有患者都出现临床缓解。CR和PR率分别为6.5 %和72 %,SD观察为17.5 %。主要病理缓解的发生率为85.36 %。pCR率达到前所未有的71.4 %。93 %的病例获得了分期降低。
JIPANG:辅助培美曲塞(pemetrexed)证明可行
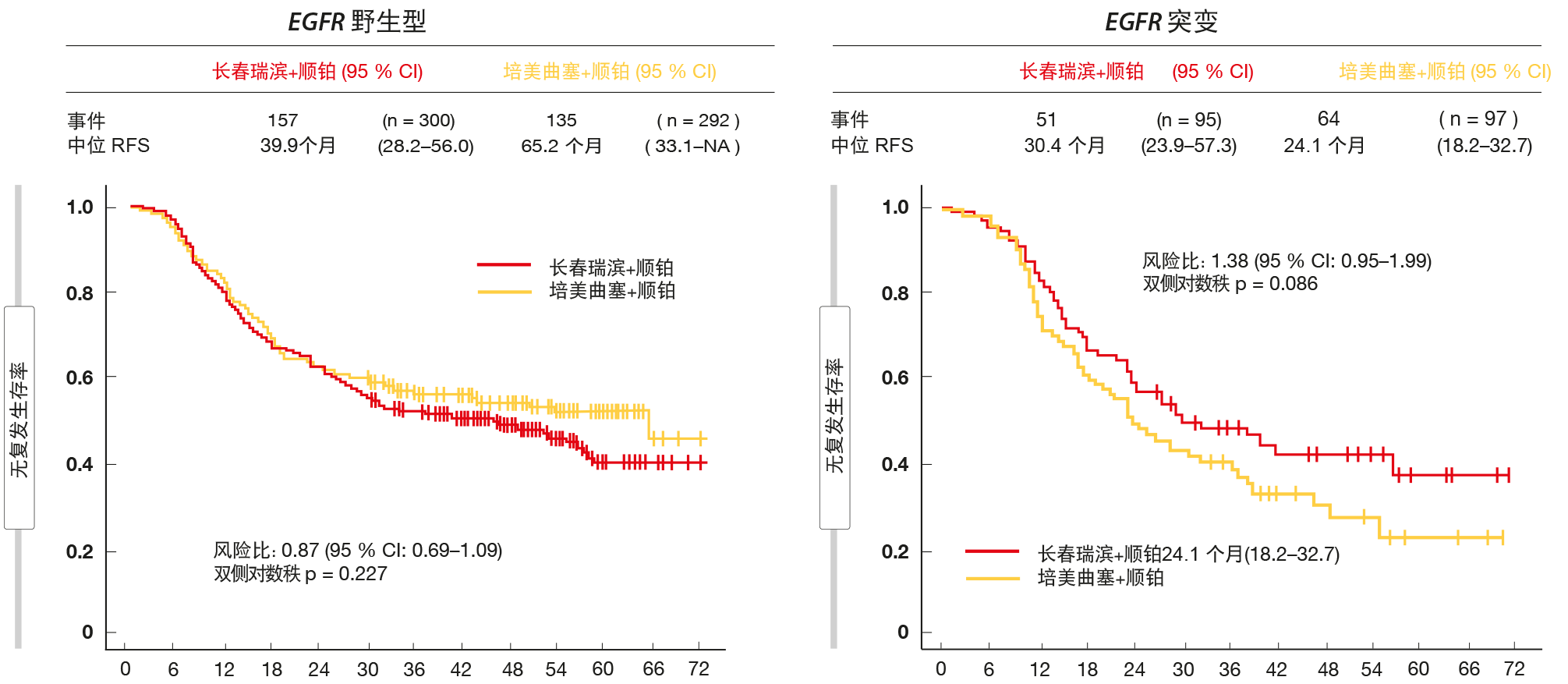
在术后辅助化疗的条件下,随机化JIPANG试验试图回答何种顺铂(cisplatin)类方案最为有效的问题[6]。将完全切除的非鳞状II期至IIIA期NSCLC患者随机分为培美曲塞加顺铂(n = 389)或长春瑞滨(vinorelbine)加顺铂(n = 395)。每种方案给予至多4个周期。JIPANG是评估培美曲塞加顺铂作为术后辅助方案的首项III期试验。 对于被定义为主要终点的无复发生存期(RFS),该试验显示培美曲塞加顺铂并无优效性。然而,两种方案表现出相似的疗效(培美曲塞加顺铂与长春瑞滨加顺铂的中位RFS,38.9与37.3个月;HR,0.98)。类似地,OS在各组之间没有差异(HR,0.98)。RFS相关的亚组分析表明EGFR突变患者使用长春瑞滨方案表现更好,而EGFR野生型患者从基于培美曲塞的治疗中得到更多获益(图2)。
图2:EGFR野生型患者使用培美曲塞加顺铂、EGFR突变患者使用长春瑞滨加顺铂获得更大的无复发生存率获益
同时,培美曲塞加顺铂显示出更高的耐受性。更大比例的患者完成4个周期的治疗(87.9 %与72.7 %),并且毒性较轻,其中严重的和3-5级不良事件(AE)发生率较低。严重的血液学AE的发生率显著较低(24.7 %与81.8 %;p < 0.001),并且治疗中止率较低(9.5 %与23.5 %)。基于这些数据,培美曲塞加顺铂可作为II期至IIIA期非鳞状NSCLC的术后辅助化疗的选择,特别是对于EGFR野生型疾病患者。
术后EGFR TKI治疗
辅助EGFR酪氨酸激酶抑制剂(TKI)治疗在早期EGFR突变NSCLC中的作用仍存在争议。Tang等人在对包括总计1,152名具有激活EGFR突变的切除NSCLC患者的11项试验的荟萃分析中发现,与没有辅助EGFR TKI的治疗相比,EGFR TKI延长了OS(OR,0.63;p= 0.004)和无疾病生存期(DFS;OR,0.56;p < 0.00001)[7]。预定义的亚组分析表明EGFR TKI相比于化疗具有更高的DFS获益。但是,OS并非如此。与单独化疗相比,EGFR TKI治疗与化疗的组合导致显著更长的DFS(OR,0.48;p< 0.00001)和OS(OR,0.50;p = 0.003)。此外,TKI治疗的患者显示≥3级AE少于化疗治疗组(OR,0.22;p< 0.00001)。考虑到这些发现,辅助EGFR TKI是在完全切除的EGFR阳性NSCLC患者中作为单药或联合化疗的潜在治疗选择。 肿瘤微环境(TME)的改变可能为患者在辅助EGFR TKI治疗方面的选择提供信息。Khalil等人鉴定了8个关键的TME基因,其高表达与EGFR突变患者中的DFS改善相关[8]。研究人员将它们分为特征在于不同免疫谱的两组。一组显示比另一组更“具炎性”的表型(例如,更高的淋巴细胞浸润评分和TGF-β应答)。炎性组的DFS和疾病特异性生存期均明显长于非炎性组。结果表明,根据这些基因进行的患者分层可能有助于识别将获益于辅助治疗的个体。
3个月与2年的阿法替尼(afatinib)
由于辅助EGFR TKI治疗的最佳持续时间存在争议,因此随机化II期试验在切除术后完成标准辅助治疗的I期至III期NSCLC患者中评估了每日给予阿法替尼2年(n = 22)与3个月(n = 24)的作用[9]。60名计划患者中有46名因缓慢进行而结束研究。2年DFS被定义为主要终点。其中,与3个月的方案相比,2年方案诱导的复发率降低14 %(2年DFS,85 %与71 %),但这种差异并未达到统计学上不同。两组均尚未达到中位DFS和OS 与先前的辅助EGFR TKI试验相同,2年组中的许多患者未完成治疗,主要原因是撤回同意(23 %),其次是毒性(18 %)和复发(9 %)。作者得出结论认为,在TKI耐受性改善的时代,辅助治疗的持续时间仍然是重要问题。
巩固性免疫疗法的个性化
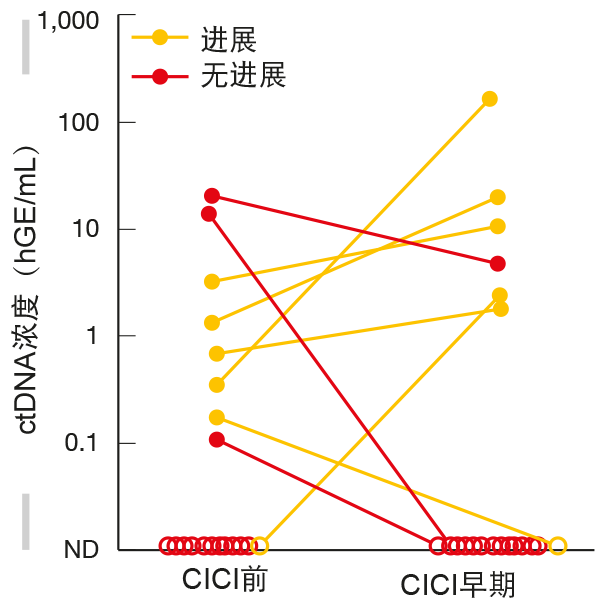
Moding等人研究了循环肿瘤DNA(ctDNA)在局部NSCLC患者进行放化疗(CRT)后检测分子残留病中的应用[10]。科学家们猜测,CRT后导致额外的毒性和成本的巩固性免疫检查点抑制(CICI)对于ctDNA不可检测的患者可以省略。从62名因为根治性目的接受同时CRT的IIB期至IIIB期NSCLC患者中收集样品。向其中25名患者给予CICI。 事实上,ctDNA的存在显示出具有预测能力。在CRT后没有可检测ctDNA的组中,在分析时尚未达到中位无进展(FFP);这些患者预后极佳,并且可能无法获益于CICI。在早期CICI阶段期间的重新评估证明,ctDNA变化可能鉴别对于巩固性治疗的应答者和无应答者。在早期CICI期间,在没有可检测ctDNA的患者中尚未达到中位FFP。在显示ctDNA减少的患者中,中位FFP为16.5个月;该组未经历进展,因此似乎获益于免疫疗法(图3)。巩固开始后ctDNA增加的患者表现最差,中位FFP为0.4个月。其中,快速进展表明对治疗缺乏应答。 作者提出了一种算法,包括仅在ctDNA存在的情况下在CRT后启动CICI。在CICI开始后的早期,将进行另一项分析,其根据ctDNA的持久性提示改变治疗或继续免疫疗法。CRT后不显示可检测ctDNA的患者将不接受CICI,而是在成像之外进行ctDNA监测。然而,前瞻性临床试验对于确定ctDNA分析在巩固性免疫疗法个性化中的作用至关重要。
图3:辅助放化疗后接受免疫检查点抑制剂巩固(CICI)的患者中ctDNA水平变化与临床病程之间的关联
参考文献
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- Chen L et al., Metastasis is regulated via microRNA-200/ZEB1 axis control of tumour cell PD-L1 expression and intratumoral immunosuppression. Nat Commun 2014; 5: 5241
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer (NSCLC): clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Kwiatkowski DJ et al., Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): interim analysis and biomarker data from a multicenter study (LCMC3). J Clin Oncol 37, 2019 (suppl; abstr 8503)
- Provencio M et al., Neo-adjuvant chemo-immunotherapy for the treatment of stage IIIA resectable non-small-cell lung cancer (NSCLC): a phase II multicenter exploratory study. Final data of patients who underwent surgical assessment (NADIM). J Clin Oncol 37, 2019 (suppl; abstr 8509)
- Kenmotsu H et al., Randomized phase III study of pemetrexed/cisplatin versus vinorelbine/cisplatin for completely resected non-squamous non-small-cell lung cancer. The JIPANG study. J Clin Oncol 37, 2019 (suppl; abstr 8501)
- Tang W et al., EGFR inhibitors as adjuvant therapy for EGFR mutation positive non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 8508)
- Khalil M et al., The tumor microenvironment in EGFR-driven loco-regional lung adenocarcinoma can predict higher risk of recurrence. J Clin Oncol 37, 2019 (suppl; abstr 8521)
- Chaft JE et al., Randomized phase II study of adjuvant afatinib for 3 months versus 2 years in patients with resected stage I-III EGFR mutant NSCLC. J Clin Oncol 37, 2019 (suppl; abstr 8507)
- Moding EJ et al., ctDNA for personalization of consolidation immunotherapy in localized non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 2547)
More posts
小细胞肿瘤:二线条件下的改善
小细胞肿瘤:二线条件下的改善 Lurbinectedin单药疗法 对于复发性小细胞肺癌(SCLC)患者,仅可获得有限的治疗选择。拓扑替康(topotecan)是唯一经FDA
罕见突变:使治疗更进一步
罕见突变:使治疗更进一步 GEOMETRY mono-1:MET失调NSCLC中的capmatinib 据报道,3 %至4 %的NSCLC患者具有MET外显子14跳跃突变(
ALK阳性疾病基于血液的检测
ALK阳性疾病基于血液的检测 Rafał Dziadziuszko,MD,PhD,波兰格但斯克,格但斯克医学院肿瘤及放射学系 在现今的肺癌诊断和治疗环境中,我们可以对循环
免疫疗法领域的试验更新和新生物标志物
免疫疗法领域的试验更新和新生物标志物 派姆单抗(pembrolizumab)的 长期发现:KEYNOTE-001 KEYNOTE-001是证明PD-1抑制剂派姆单抗在初治或
EGFR突变肺癌的新一线选择和其他见解
EGFR突变肺癌的新一线选择和其他见解 RELAY:添加雷莫芦单抗(ramucirumab) 尽管EGFR TKI治疗通常对EGFR突变肺癌患者有效,但耐药性在治疗开始后8
早期NSCLC:有前景的(新)辅助方法
早期NSCLC:有前景的(新)辅助方法 NEOSTAR试验 可切除非小细胞肺癌(NSCLC)患者需要有效的治疗选择,因为超过半数的I期至III期疾病患者经历复发[1]。Ch