罕见突变:使治疗更进一步
GEOMETRY mono-1:MET失调NSCLC中的capmatinib
据报道,3 %至4 %的NSCLC患者具有MET外显子14跳跃突变(METex14)[1-3]。这些突变意味着不良的预后,以及对包括免疫疗法在内的标准治疗的应答较差[4-8]。此外,具有MET异常的患者通常年龄较大,这意味着需要耐受性更好的策略。Capmatinib已被开发作为高选择性的有效MET抑制剂,针对携带MET活化的临床前癌症模型具有体外和体内活性[9]。
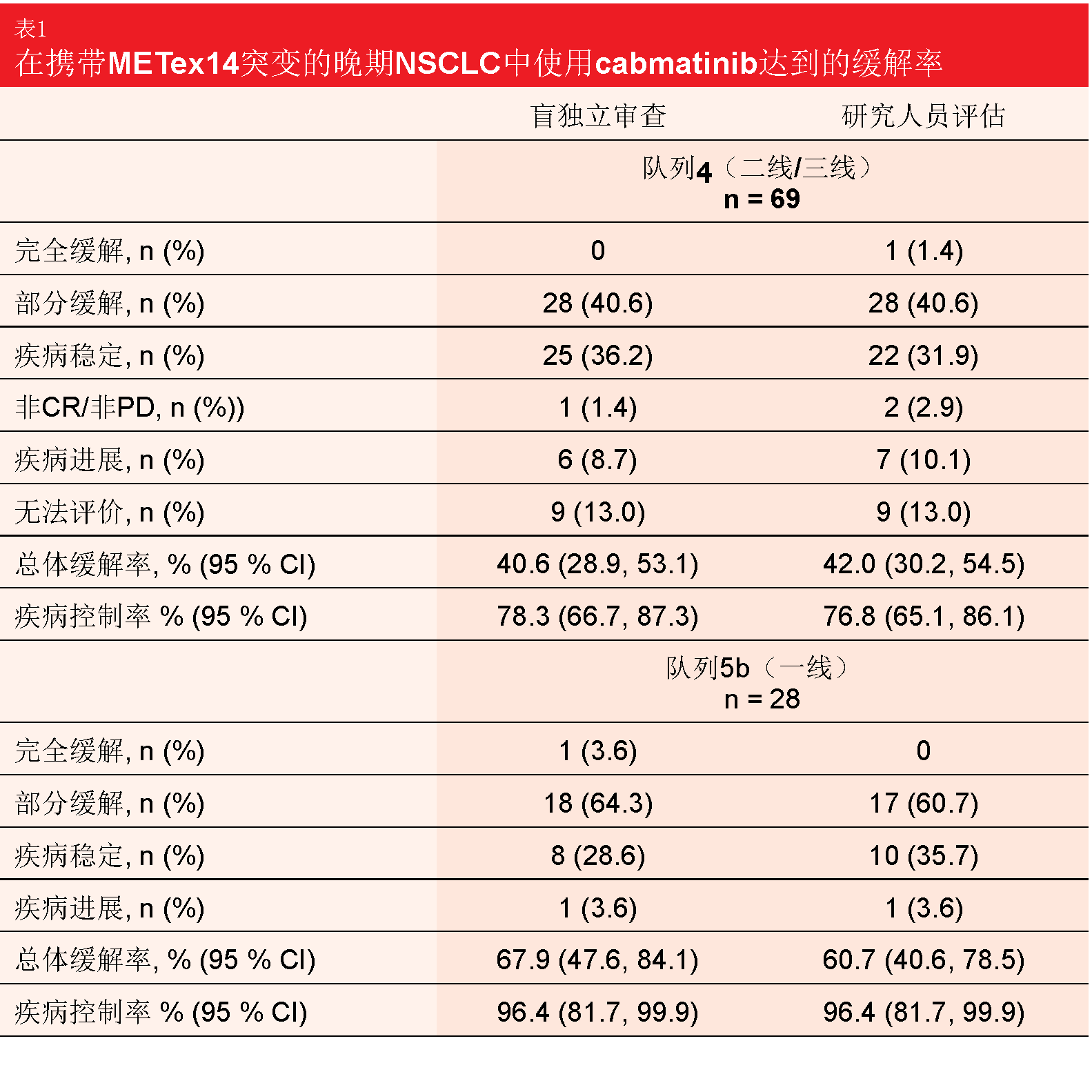
多队列多中心II期GEOMETRY mono-1试验在IIIB/IV期NSCLC且具有METex14的患者中研究了每天两次400 mg capmatinib的作用。在2018年ESMO大会上介绍的初步疗效数据显示,无论治疗线和CNS活动如何,均具有深度缓解[10]。在2019年ASCO大会上,Wolf等人报告了队列4和队列5b的主要疗效分析和其他分析[11]。队列4评价了二线和三线中的capmatinib(n = 69),而队列5b包括初治患者(n = 28)。在预先治疗的队列中,74 %接受过一种治疗;其中88.4 %接受过铂类化疗。两个队列中的大多数患者显示并发的MET扩增。分别对两个队列进行分析,并且两个队列具有独立的前瞻性设计的统计假设。根据盲独立审查委员会(BIRC)的ORR构成主要终点。
颅外和颅内作用
在队列4中,根据BIRC的ORR达到40.6 %,而作为关键次要终点的DCR为78.3 %(表1)。对于队列5b,ORR和DCR分别为67.9 %和96.4 %。两个队列都发生了快速、深度和持久的缓解。队列4和队列5b的中位缓解持续时间分别为9.72和11.14个月。12个月时,分别有25.8 %和49.7 %的患者保持无进展;中位PFS分别为5.42和9.69个月。所有这些结果在BIRC和研究人员评估之间是一致的。神经放射学家审查确认了capmatinib治疗对脑转移的活性。13名在基线时有CNS病灶的可评估患者中有7名实现了颅内缓解,其中4名患者甚至经历了所有转移的完全消退。12名患者获得了颅内疾病控制。颅内缓解的发生被证明与在CNS外观察到的缓解同等迅速。
此外,研究人员发现深度和持久缓解的发生不依赖于导致METex14的MET突变类型或MET扩增的同时出现。新一代测序和逆转录酶聚合酶链反应均表现出对肿瘤组织中METex14检测的高灵敏度,一致率为99 %。与其他分子驱动相同,这些患者的肿瘤突变负荷与野生型NSCLC患者相比较低(中值,肿瘤组织中< 6个突变/MB),且在各个治疗线之间相似。
安全性分析数据集代表迄今为止MET失调的NSCLC患者的最大数据集(n = 334)。Capmatinib显示出高耐受性,3/4级事件很少。外周性水肿、恶心和肌酸酐水平升高是最常报告的AE。治疗相关AE导致的剂量调整和治疗中止分别在21.9 %和11.1 %的情况下是有必要的。作者在结论中指出,初治队列中有利的ORR突出了早期分子检测的重要性。在罕见但具有挑战性的晚期NSCLC且MET失调患者人群中,capmatinib似乎是新的治疗选择。
Tepotinib:VISION研究
另一种高选择性的有效MET抑制剂是tepotinib,其正在单组II期VISION试验中在具有所有组织学和根据组织或液体活检具有MET异常的IIIB/IV期NSCLC患者中进行评价。在队列A中,具有METex14跳跃突变的患者接受500 mg/d tepotinib直至进展。Tepotinib用于一线、二线和三线条件。Paik报告了中期发现,包括队列A的通过独立审查评估的ORR(即主要终点)以及选择性次要结果[12]。在分析时已有87名患者接受了治疗。
根据液体活检和组织活检,通过独立审查得到的tepotinib引起的ORR分别为50.0 %和45.1 %。缓解分别持续12.4和15.7个月。疾病控制分别达到66.7 %和72.5 %。治疗活性在治疗线之间一致。肿瘤收缩也是如此;根据独立审查和研究人员读数,92 %的患者在一线和二线条件下经历肿瘤收缩。在三线及以后,在≥ 75 %的病例中发现肿瘤收缩的证据。缓解在早期发生,并且在治疗线之间是持久的。在所有分析子集中,中位缓解持续时间超过一年,总体为14.3个月。在基线时显示脑转移的患者从治疗获得同等获益。根据液体活检和组织活检,总队列的中位PFS分别为9.5和10.8个月。
试验证明有利的安全性特征,其中外周性水肿、恶心和腹泻报告为最常见的AE。未发生4级或5级的治疗相关AE。研究人员得出结论认为,tepotinib在METex14突变患者中显示出有前景且持久的临床活性。VISION研究正在进行中;队列B中包括没有METex14跳跃突变的MET扩增患者,该队列的结果将在未来呈现。
用于RET阳性疾病的BLU-667
在大约1 %至2 %的NSCLC病例中发现RET异常[13, 14]。这些患者的医疗需求尚未得到满足,因为在他们中未观察到来自化疗、免疫疗法或多激酶抑制剂治疗等现有策略的显著获益[15-17]。迄今为止尚无批准的选择性RET抑制剂。
有效且选择性地抑制RET异常和RET耐药性突变的研究药物BLU-667[18,19]可能将会填补这一空白。Gainor等人介绍了I期ARROW研究的发现[20]。该试验的剂量递增部分将400mg/d确定为理想剂量。第2部分目前正在招募患者进入具有各种RET改变的晚期实体瘤的7个扩展队列中。允许无症状的脑转移。这些队列中有两个包含NSCLC患者,其中一个队列是铂初治的,另一个接受铂预先治疗。后者接受过中值为2的先前治疗线。整个NSCLC人群中有40 %显示CNS病灶。已知的RET融合伴侣主要是KIF5B(66 %)和CCDC6(13 %)。ORR和安全性构成ARROW研究的主要目标。
临床获益和RET清除
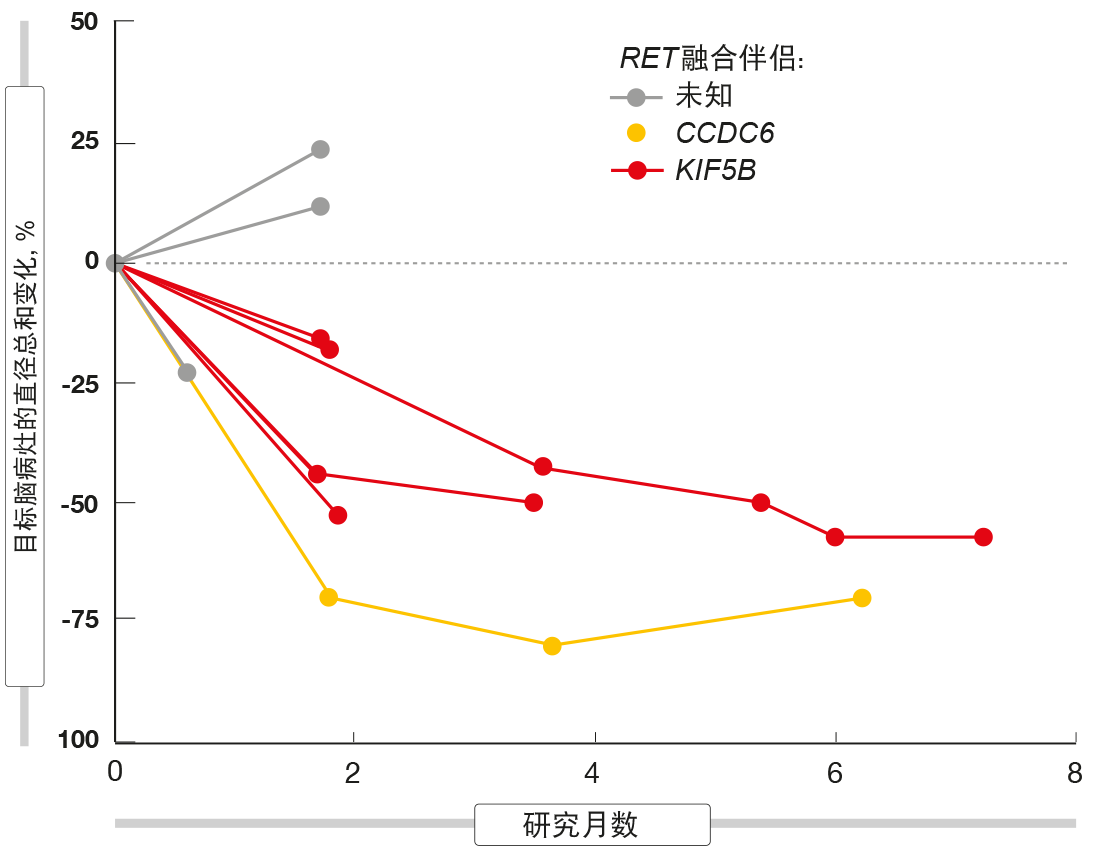
根据对48名NSCLC患者进行的初步疗效分析(其中有35名经预先治疗),BLU-667表现出广泛且持久的抗肿瘤活性,总队列和预先治疗组的ORR分别为58 %和60 %。这两个人群的DCR分别为96 %和100 %。大多数缓解在首次随访成像评估时已经出现。在数据截止时,82 %的缓解患者仍在接受治疗,并且尚未达到中位缓解持续时间。包括剂量递增阶段在内,患者已进行治疗长达24个月。不论先前的免疫检查点抑制剂治疗、RET融合基因型和CNS受损情况如何,BLU-667均保持活性。在基线时具有可测量的未治疗脑转移的九名患者中有七名实现了这些病灶的收缩(图)。以400mg/d的起始剂量治疗的患者中没有人由于新出现CNS受损而经历进展。在基线处具有可检测的RET融合ctDNA的20名患者中有18名在第一治疗周期内显示完全清除。
安全性分析包括120名患者,其中91名患者接受过铂预先治疗。BLU-667耐受性良好,毒性通常是低等级、可逆的并且与药物的选择性特征一致。最常见的AE包括便秘、中性粒细胞减少症、转氨酶升高、疲劳和高血压。在≥ 3级AE中,中性粒细胞减少症和高血压各占13 %。共有7 %的患者因治疗相关毒性而中止BLU-667。作者指出,这些数据支持ARROW试验在初治NSCLC患者中扩展。
图:接受BLU-667的RET阳性肺癌患者中脑转移的收缩
有说服力的拉罗替尼(larotrectinib)活性
已经在广泛的恶性肿瘤中鉴别了涉及NTRK基因的重排,在所有实体瘤中的估计频率为1 %[21]。首创的高选择性TRK抑制剂拉罗替尼在109名患者的综合扩展数据集中证明了强有力的疗效,无论肿瘤类型或年龄如何[22]。Hong等人在三项临床试验(成人I期,NCT02122913;SCOUT, NCT02637687;NAVIGATE,NCT02576431)中进行治疗的83名局部晚期或转移性实体肿瘤成年患者中评估了每日两次100mg拉罗替尼的疗效和安全性[23]。这些研究纳入了共12种肿瘤类型的患者;其中13 %被诊断患有肺癌。
拉罗替尼显示在整个人群中诱导强烈和持久的缓解。根据独立审查委员会的ORR为68 %。观察到的CR、PR和SD分别为17 %、51 %和15 %。无论肿瘤类型如何,均发生缓解。在17.5个月的中位随访时,对于具有确认缓解的患者,尚未达到中位缓解持续时间。据估计,79 %缓解者的缓解超过12个月。中位PFS为25.8个月,且尚未达到中位OS。
拉罗替尼耐受性良好,大多数AE被分级为1级或2级。最常见的AE包括疲劳(40 %)、头晕(36 %)和恶心(29 %)。总体而言,这些数据提供有力证据,支持在晚期实体瘤成年患者中进行TRK融合测试,而不考虑原发性肿瘤部位。
NRG1阳性肺癌的特征
在大约1.7 %的肺腺癌患者中发现NRG1融合[24]。这些融合激活HER3/HER2信号传导,支持HER3和/或HER2抑制剂的治疗性使用。然而,缺乏对该疾病的临床病理学和分子特征的表征,以及全身治疗在NRG1阳性NSCLC患者的较大队列中的功效相关证据。因此,Duruisseaux等人推出了注册中心,来自8个国家17个机构的全球性多中心胸肿瘤学家网络进行了参与[25]。这些工作共确定了117名确诊为NRG1融合阳性NSCLC的患者。回顾性地收集临床病理/分子特征和临床结果。该队列包含较高比例的女性(54.7 %)和从未吸烟者(43.6 %)。吸烟者的中位数报告为40包/年。肿瘤主要显示腺癌组织学(94.9 %),并且主要为粘液性亚型(71%)。在遗传特征方面,NRG1融合在58.9%的病例中具有上游伴侣基因;其中,CD74和SCLA3A2是最常见的。NRG1融合主要使用基于RNA的测定来鉴别。在患有转移性疾病的患者中,肺是最常见的播散器官部位。IV期NRG1阳性NSCLC显示极佳的预后,中位OS为4.83年。对于I期和III期,尚未达到中位OS,对于II期,中位OS为4.4年。
可获得关于23名患者全身治疗功效的数据。在18个病例中给予铂类化疗(表2)。其中,两名患者获得PR(11 %),并且九名个体发生SD(50 %)。在用阿法替尼作为单药或组合进行治疗的患者中(n = 13,12名可获得疗效数据),一名达到CR(8 %),而三名达到PR(25 %),两名达到SD(17 %)。两名患者经历的缓解持续超过一年。使用阿法替尼的中位PFS为2.0个月,而中位OS尚未达到。然而,在使用和不使用阿法替尼治疗的患者中,来自转移阶段诊断的OS没有差异。对于单药抗PD-1/L1治疗,未观察到缓解;化学免疫疗法也是如此。
作者得出结论认为,阿法替尼治疗可能不会改变转移性疾病的自然史,尽管在少数患者中使用这种治疗会发生持久的缓解。需要新型靶向治疗方法。基于RNA的测定可能是鉴别NRG1融合的测试方法选择。
参考文献
- Ma PC, MET receptor juxtamembrane exon 14 alternative spliced variant: novel cancer genomic predictive biomarker. Cancer Discov 2015; 5(8): 802-805
- Reungwetwattana T et al., The race to target MET exon 14 skipping alterations in non-small cell lung cancer: The Why, the How, the Who, the Unknown, and the Inevitable. Lung Cancer 2017; 103: 27-37
- Tong JH et al., MET amplification and exon 14 splice site mutation define unique molecular subgroups of non-small cell lung carcinoma with poor prognosis. Clin Cancer Res 2016; 22(12): 3048-3056
- Dimou A et al., MET gene copy number predicts worse overall survival in patients with non-small cell lung cancer (NSCLC); a systematic review and meta-analysis. PLoS One 2014; 9(9): e107677
- Guo B et al., Prognostic value of MET gene copy number and protein expression in patients with surgically resected non-small cell lung cancer: a meta-analysis of published literatures. PLoS One 2014; 9(6): e99399
- Sabari JK et al., PD-L1 expression, tumor mutational burden, and response to immunotherapy in patients with MET exon 14 altered lung cancers. Ann Oncol 2018; 29(10): 2085-2091
- Baba K et al., Efficacy of pembrolizumab for patients with both high PD-L1 expression and a MET exon 14 skipping mutation: A case report. Thorac Cancer 2019; 10(2): 369-372
- Reis H et al., MET expression in advanced non-small-cell lung cancer: Effect on clinical outcomes of chemotherapy, targeted therapy, and immunotherapy. Clin Lung Cancer 2018; 19(4): e441-e163
- Baltschukat S et al., Capmatinib (INC280) is active against models of non-small cell lung cancer and other cancer types with defined mechanisms of MET activation. Clin Cancer Res 2019; 25(10): 3164-3175
- Wolf J et al., Results of the GEOMETRY mono-1 phase II for evaluation of the MET inhibitor capmatinib (INC280) in patients with METΔex14 mutated advanced non-small cell lung cancer. ESMO 2018, abstract LBA52
- Wolf J et al., Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): efficacy data from the phase II GEOMETRY mono-1 study. J Clin Oncol 37, 2019 (suppl; abstr 9004)
- Paik PK et al., Phase II study of tepotinib in NSCLC patients with METex14 mutations. J Clin Oncol 37, 2019 (suppl; abstr 9005)
- Lipson D et al., Identification of new ALK and RET gene fusions from colorectal and lung cancer biopsies. Nat Med 2012; 18(3): 382-384
- Takeuchi K et al., RET, ROS1 and ALK fusions in lung cancer. Nat Med 2012; 18(3): 378-381
- Mazieres J et al., Efficacy of immune-checkpoint inhibitors (ICI) in non-small cell lung cancer (NSCLC) patients harboring activating molecular alterations (ImmunoTarget). J Clin Oncol 36, 2018 (suppl; abstr 9010)
- Drilon A, Targeted therapy outcomes in RET-rearranged lung cancers: drug or driver? Lancet Respir Med 2017; 5(1): 5-6
- Yoh K et al., Vandetanib in patients with previously treated RET-rearranged advanced non-small-cell lung cancer (LURET): an open-label, multicentre phase 2 trial. Lancet Respir Med 2017; 5(1): 42-50
- Subbiah V et al., Precision targeted therapy with BLU-667 for RET-driven cancers. Cancer Discov 2018; 8(7): 836-884
- Blueprint internal data
- Gainor JF et al., Clinical activity and tolerability of BLU-667, a highly potent and selective RET inhibitor, in patients with advanced RET-fusion+ non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 9008)
- Cocco E et al., NTRK fusion-positive cancers and TRK inhibitor therapy. Nat Rev Clin Oncol 2018; 15(12): 731-747
- Lassen UN et al., Larotrectinib efficacy and safety in TRK fusion cancer: an expanded clinical dataset showing consistency in an age and tumor agnostic approach. Ann Oncol 2018; 29 (suppl_8): viii133-viii148
- Hong DS et al., Larotrectinib efficacy and safety in adult TRK fusion cancer patients. J Clin Oncol 37, 2019 (suppl; abstr 3122)
- Fernandez-Cuesta L et al., CD74-NRG1 fusions in lung adenocarcinoma. Cancer Discov 2014; 4(4): 415-422
- Duruisseaux M et al., NRG1 fusion-positive lung cancers: clinicopathologic profile and treatment outcomes from a global multicenter registry. J Clin Oncol 37, 2019 (suppl; abstr 9081)
More posts
小细胞肿瘤:二线条件下的改善
小细胞肿瘤:二线条件下的改善 Lurbinectedin单药疗法 对于复发性小细胞肺癌(SCLC)患者,仅可获得有限的治疗选择。拓扑替康(topotecan)是唯一经FDA
罕见突变:使治疗更进一步
罕见突变:使治疗更进一步 GEOMETRY mono-1:MET失调NSCLC中的capmatinib 据报道,3 %至4 %的NSCLC患者具有MET外显子14跳跃突变(
ALK阳性疾病基于血液的检测
ALK阳性疾病基于血液的检测 Rafał Dziadziuszko,MD,PhD,波兰格但斯克,格但斯克医学院肿瘤及放射学系 在现今的肺癌诊断和治疗环境中,我们可以对循环
免疫疗法领域的试验更新和新生物标志物
免疫疗法领域的试验更新和新生物标志物 派姆单抗(pembrolizumab)的 长期发现:KEYNOTE-001 KEYNOTE-001是证明PD-1抑制剂派姆单抗在初治或
EGFR突变肺癌的新一线选择和其他见解
EGFR突变肺癌的新一线选择和其他见解 RELAY:添加雷莫芦单抗(ramucirumab) 尽管EGFR TKI治疗通常对EGFR突变肺癌患者有效,但耐药性在治疗开始后8
早期NSCLC:有前景的(新)辅助方法
早期NSCLC:有前景的(新)辅助方法 NEOSTAR试验 可切除非小细胞肺癌(NSCLC)患者需要有效的治疗选择,因为超过半数的I期至III期疾病患者经历复发[1]。Ch