EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
RELAY試験:ラムシルマブの追加
EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だが、投与開始後8~12か月以内に耐性を獲得することは避けられず、治療がうまくいかない原因となっている。EGFR阻害薬の活性を延長させる選択肢のないところが、アンメットニーズになっている。VEGFとEGFRのシグナル伝達経路をダブルでブロックする方法が、このアンメットニーズへの解決策になる可能性がある。
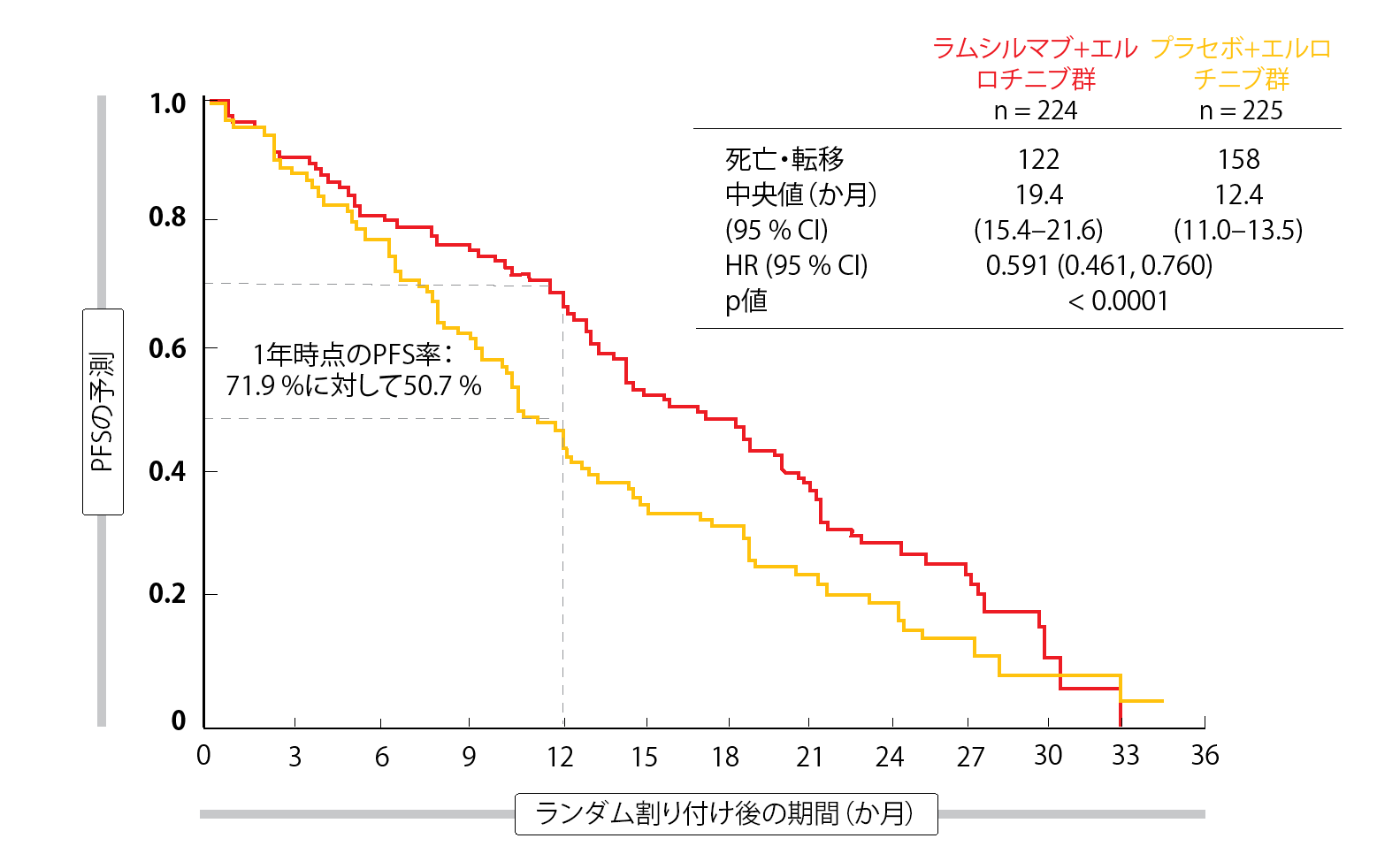
国際共同ランダム化プラセボ対照第Ⅲ相RELAY試験では、Ⅳ期のEGFR遺伝子変異陽性(具体的にはエクソン19欠失変異、エクソン21のL858R点突然変異)NSCLC患者へのファーストライン治療として、第一世代のEGFR TKIであるエルロチニブと抗VEGFR2抗体のラムシルマブの併用療法について検証した[1]。なお、脳転移巣のある患者は同試験から除外した。治療内容は、エルロチニブ150 mg/日とラムシルマブ10 mg/kgの2週間1回投与(n=224)と、エルロチニブ150 mg/日とプラセボの投与(n=225)である。疾患が増悪するまでもしくは許容できない毒性が発現するまで治療を続けた。試験責任医師が判定するPFSを主要評価項目にした。同試験には13か国の医療機関100施設が参加している。両群を合わせるとアジア人の患者数は77%に上った。
ラムシルマブを追加したことがPFSを7か月間、統計学的有意に改善させ、リスク低下が41%と統計学的有意性が非常に高いと解釈できた(PFSはラムシルマブ群が19.4か月、プラセボ群が12.4か月、HR:0.591、p<0.0001、 図)。カプランマイアー生存曲線は早い段階から分かれた。1年時点の無増悪生存率はラムシルマブ群が71.9%、プラセボ群が50.7%だった。盲検化している独立評価委員会の判定でも、PFSへのベネフィットは一致していた(HR:0.671、p= 0.0022)。大半のサブグループに、ラムシルマブの追加によりPFSの改善が見られた。エクソン19欠失変異のある患者群への効果と、エクソン21のL858R点突然変異のある患者群への効果にほとんど差異は認められなかった(HRは前者が0.651、後者が0.618)。
図:RELAY試験でエルロチニブにラムシルマブを追加することでPFSが7か月延長
副次評価項目
両群の全奏効率は同等で(ラムシルマブ群が76%、プラセボ群が75%)、病勢コントロール率についても同じだった(前者は95%、後者は96%)。しかし、奏効期間はラムシルマブ群が統計学的有意に長くなった(前者は18.0か月、後者は 11.1か月、HR:0.619)。なお、OSの結果はまだ判明していない。PFS2(ランダム割り付けから2度目の病勢進行までの期間)については、ラムシルマブ群で統計学的有意に長かったことが解析で判明した(HR:0.690、p=0.03)。これは無増悪生存期間だけでなく、OSにもベネフィットがあるということを意味している。EGFR T790M耐性変異の獲得率は、ベースライン時とその1か月後にリキッドバイオプシーを行って調べた。どちらの群でもベースライン時にこの耐性変異を検出したが、増悪した患者の場合、1か月後の変異の獲得率は前者が43%、後者が47%と大差はなかった。
安全性に関する解析結果は、エルロチニブ・ラムシルマブの併用療法の、既知の安全性プロファイルと一致していた。グレード3以上の治療関連AEは、ラムシルマブ群で多く発現した(前者は72%、後者は54%)が、AEの発現により治験薬すべての投与を中止した率に差異は認められなかった(前者は13%、後者は11%)。グレードを問わない重度の高血圧については、ラムシルマブ群で発現率が高くなったものの、グレード4の高血圧は見受けられなかった。また、この群でトランスアミナーゼ値上昇が多く見られたが、いずれもグレード1か2と判定された。出血関連のAEもこれと同様だった。以上の結果を踏まえると、エルロチニブとラムシルマブの併用療法は、EGFR遺伝子変異陽性の転移性NSCLC患者へのファーストライン治療の新たな選択肢になりうることが示唆された。
ゲフィチニブと化学療法の併用
ファーストライン治療で投与したEGFR TKIへの耐性獲得を防ぐもうひとつの対策は、TKIの経口薬と化学療法の併用である。増悪が見られない患者を対象に、第一世代のEGFR TKIのゲフィチニブと、ゲフィチニブとペメトレキセドまたはカルボプラチンの併用を4コース行ったあとにペメトレキセドを用いる維持療法を比較した、第Ⅲ相非盲検ランダム化比較試験の成績をNoronhaらが発表した[2]。 ⅢB期とⅣ期のEGFR遺伝子変異陽性NSCLC患者に、緩和の意味合いで併用療法(n=174)もしくはゲフィチニブの単独療法(n=176)を増悪するまでファーストライン治療として行った。各群の患者の20%超がECOG PS 2で、併用療法群の17%、単独療法群の19%に脳転移巣を認めた。エクソン18やエクソン20の変異といった珍しいEGFR遺伝子変異のある患者も、同試験に組み入れた。
PFSとOSの両方とも、単独療法群に比べて併用療法群で統計学的有意性のある改善が見られた。主要評価項目であるPFSの中央値は、併用療法群で2倍の長さになっていた(併用療法群は16か月、単独療法群は8か月、 HR:0.51、p<0.0001)。すべてのサブグループでPFSに統計学的有意な延長が見られた。OSに関しては、死亡リスクが55%低下した(前者は判明せず、後者は17か月、HR:0.45、p<0.0001)。また、奏効(ORRは前者が75.3%、後者が62.5%)そして最大腫瘍縮小効果(depth of response)の中央値(前者は-56.4、後者は-43.5、p=0.002)も併用療法群により顕著な効果が見られた。臨床的に意義のあるグレード3以上の毒性は25.3%から50.6%へと、2倍になった(p<0.001)この毒性の大部分は血球減少症である。腎毒性と低カリウム血症を除くと、いずれの群でも毒性の発現率に統計学的に有意な上昇はなかった。
以上の結果から、ゲフィチニブとペメトレキセドまたはカルボプラチンの併用療法が、EGFR遺伝子変異陽性NSCLC患者へのファーストライン治療のもうひとつの選択肢になることが証明された。この併用療法は、こういった状況下でOSを延長させる数少ない治療レジメンのひとつだと、試験責任医師らは語っている。この試験で見られたPFSの延長効果は、第三世代のTKIであるオシメルチニブを評価したFLAURA試験で得た成績とほぼ同じだったが、今回の試験ではPSが2の患者を組み入れる一方、FLAURA試験で組み入れたのはPSが1の患者だけである[3]。著者らによると、生存期間を最大に延ばすためには、効果の高い治療を順番に行うことが重要になるという。オシメルチニブがT790M耐性変異陽性の肺がんに活性を示すことを考えると、再発したときのために温存するのが最善なのかもしれない。
エクソン20挿入変異陽性肺がんにはTAK-788が有効
現在承認を受けているEGFR TKIは、エクソン19欠失変異やエクソン21のL858R点突然変異といった、よく見受けられるEGFR活性型変異陽性肺がんには効果を示すが、エクソン20挿入変異陽性肺がんにはほとんど効果が認められない。肺がん患者のおよそ6%に生じるエクソン20挿入変異のある患者には、分子標的治療薬の選択肢がな い[4]。
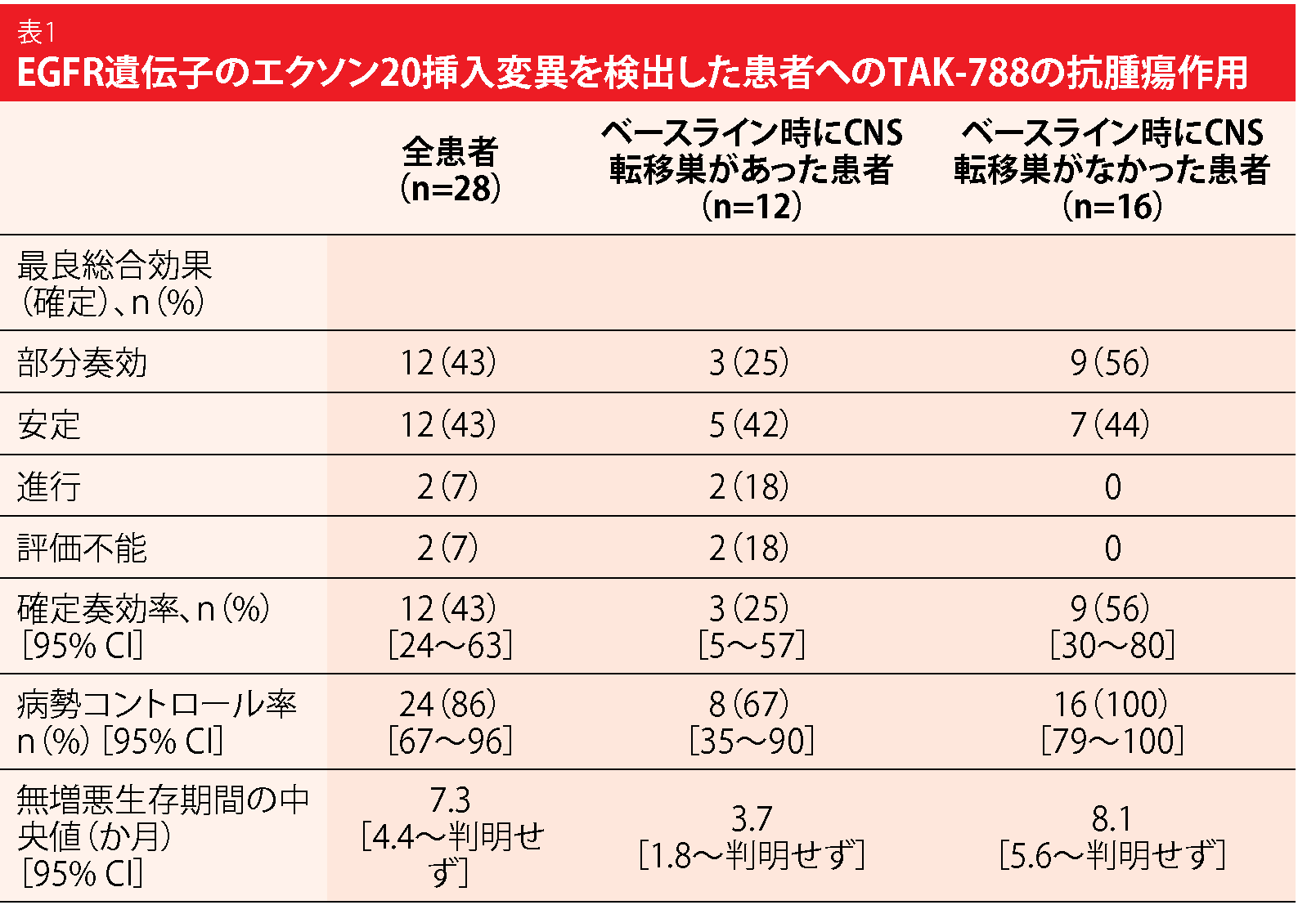
EGFR TKIの新薬候補であるTAK-788は、野生型EGFRからエクソン20挿入変異を選択的かつ強力に阻害する効果を見せている。NSCLCだけでなく他のがんの7つの患者コホートを対象に、第Ⅱ相試験でTAK-788を1日に1回160 mg投与して有効性などを検証している。エクソン20挿入変異陽性の難治性肺がん患者で、CNS転移巣に活動性があるもしくは同転移巣が測定可能な患者のどちらか一方で構成するコホート1から得た成績を、Jänneらが発表した[5]。全身療法を1回以上受けた経験を組み入れの条件にし、TKIへの治療反応がない場合に限りこの治療を受けた患者も組み入れることにした。主要評価項目の対象集団となったのは28人である。治療継続期間の中央値は7.9か月で、解析時点に試験への参加が続いていた患者は50%だった。
TAK-788の1日に1回160 mg投与は抗腫瘍作用を示し、確定ORRは43%だった(表1)。ベースライン時にCNS転移巣を認めた患者の奏効率は25%、CNS転移巣を認めなかった患者の奏効率は56%になった。全患者のDCRは86%、PFSは7.3か月である。769_ASVや773_NPHといった種類のエクソン20挿入変異のある患者にも、TAK-788は奏効した。AEは治療が可能で、発現率が最高レベルだった毒性は下痢、悪心、発疹と、他のEGFR TKIに伴うものと一致していた。治療関連AEの大部分はグレード1か2で、いずれも可逆的だった。用量漸増期もしくは用量拡大期にTAK-788の1日1回160 mg投与を最低でも1回受けた、コホート1からコホート7の患者群(n=72)では、40%の患者にグレード3以上の治療関連AEが発現し、25%の患者に減量が必要になった。毒性が生じたため14%の患者が投与中止に至った。
国際共同拡大コホートEXCLAIM試験では、EGFR遺伝子のエクソン20挿入変異を検出した局所進行NSCLC患者および転移性NSCLC患者で、これまでに化学療法を1回または2回受けたことのある91人を対象に、増悪が認められるまでTAK-788を1日1回160 mg投与して有効性や安全性を検証した。CNS転移巣を治療していれば同試験に組み入れた。主要評価項目は、独立評価委員会が個別に判定した確定ORRである。
実臨床でのアファチニブの使用経験
観察研究で中国人患者88人から得たリアルワールドデータを基に、第二世代のEGFR TKIであるアファチニブをファーストライン治療に用いたときの有効性および忍容性を確認した[6]。ORRは54.4 %、DCRは92.0 %、PFSの中央値は14.2か月だった。脳転移巣の存在、用量、治療ラインのいずれもアファチニブの活性に影響を与えることはなかった。アファチニブの投与中に増悪した患者の65.4 %に、T790M耐性変異を認め、この患者の大部分に第三世代のEGFR TKIが投与されていた。疾患が増悪してからも27人の患者には引き続きアファチニブを投与したが、この方法が症状の悪化を遅らせることになった。症状増悪までの期間の中央値は16.3か月だった。
スペインの複数の医療機関でアファチニブによるファーストライン治療を受けた患者45人を対象にした、後ろ向きリアルワールド研究では、ORRが68.9%、 CRと判定された患者は13.3%、PRと判定された患者は55.6%だった[7]。安定と判定された患者は17.8%だった。PFSの中央値が27か月だったことで、臨床試験で見られた中央値を超える結果となった。なお、このときはOSを判定する時期に達していなかった。PFSの結果が良好だったのは、特にアファチニブによく反応する、エクソン19欠失変異のある患者がかなりの割合を占めたからだろうと、著者らは述べている。
また、高齢患者へのアファチニブの活性について、この患者コホートのデータを解析している[8]。年齢の中央値は71.2歳で、24人の患者(53.3%)が70歳以上だった。70歳未満の患者に比べて70歳以上の患者で休薬や用量調節の必要性が増すことは当然だが、それが安全性と有効性を損ねるとは考えづらい。アファチニブを減量したのは70歳未満の患者では47.6%、70歳以上では75%になった。AEの発現により投与中止に至ったのは前者の14.3%、後者の20.8%だった。ORRは前者が76%、後者が62.5%、病勢コントロール率は前者が90.3%、後者が83.3%である。70歳未満の患者ではPFSの中央値が20か月になったが、70歳以上の患者ではまだ判明していない。
特定の遺伝子変異が持つ臨床的な意味
脳転移を伴うEGFR遺伝子変異陽性NSCLC患者269人の転帰について、台湾の研究者らが後ろ向き解析を行った[9]。EGFR遺伝子変異をエクソン19欠失変異、L858R点突然変異、その他のまれな変異に分類した。脳転移を認める患者のがんの自然経過および増悪について、遺伝子変異ごとに差異があるのかを調べたところ、まれな変異は転帰不良に関係していた。PFSの中央値は、エクソン19欠失変異のある患者が10.4か月、L858R点突然変異のある患者が10.0か月、まれな変異のある患者が3.2か月だった(p=0.03)。OSについては、エクソン19欠失変異のある患者が18.1か月、L858R点突然変異のある患者が17.4か月、まれな変異のある患者が12.5か月である(p=0.05)。ゲフィチニブによる治療に比べると、アファチニブによる治療でPFS(HR:0.57、p=0.03)、OS(HR:0.48、p=0.03)とも、転帰が良好であることが示された。
EGFR T790M耐性変異の有無による臨床的特徴と増悪のパターンの特定は、イタリアで行われた観察研究の目的である[10]。ゲフィチニブ、エルロチニブ、アファチニブのいずれかを用いてファーストライン治療を行った後に増悪した、EGFR遺伝子変異陽性NSCLC患者219人を患者コホートとした。このうち49人がT790M耐性変異を獲得していた。T790M耐性変異の獲得と、65歳未満(p=0.05)であることの間、そしてエクソン19欠失変異との間に相関性が見られた(p=0.04)。この相関性は多変量解析でも確認がとれている(65歳未満はp=0.010、エクソン19欠失変異はp=0.006)。増悪を認めた時点で、T790M耐性変異陽性群には新たに増悪した部位(p=0.005)だけでなく肝転移(p<0.001)もより多く見られた。この観察結果に統計学的有意性があることを多変量解析で確認している(前者はp=0.01、後者はp=0.008)。また、単変量解析と多変量解析の両方で、T790M耐性変異陽性群のOSの中央値が長くなったことが判明している(単変量解析では前者が53か月、後者が22か月、p<0.0001)。
ctDNAの早期消失 :オシメルチニブによるファーストライン治療
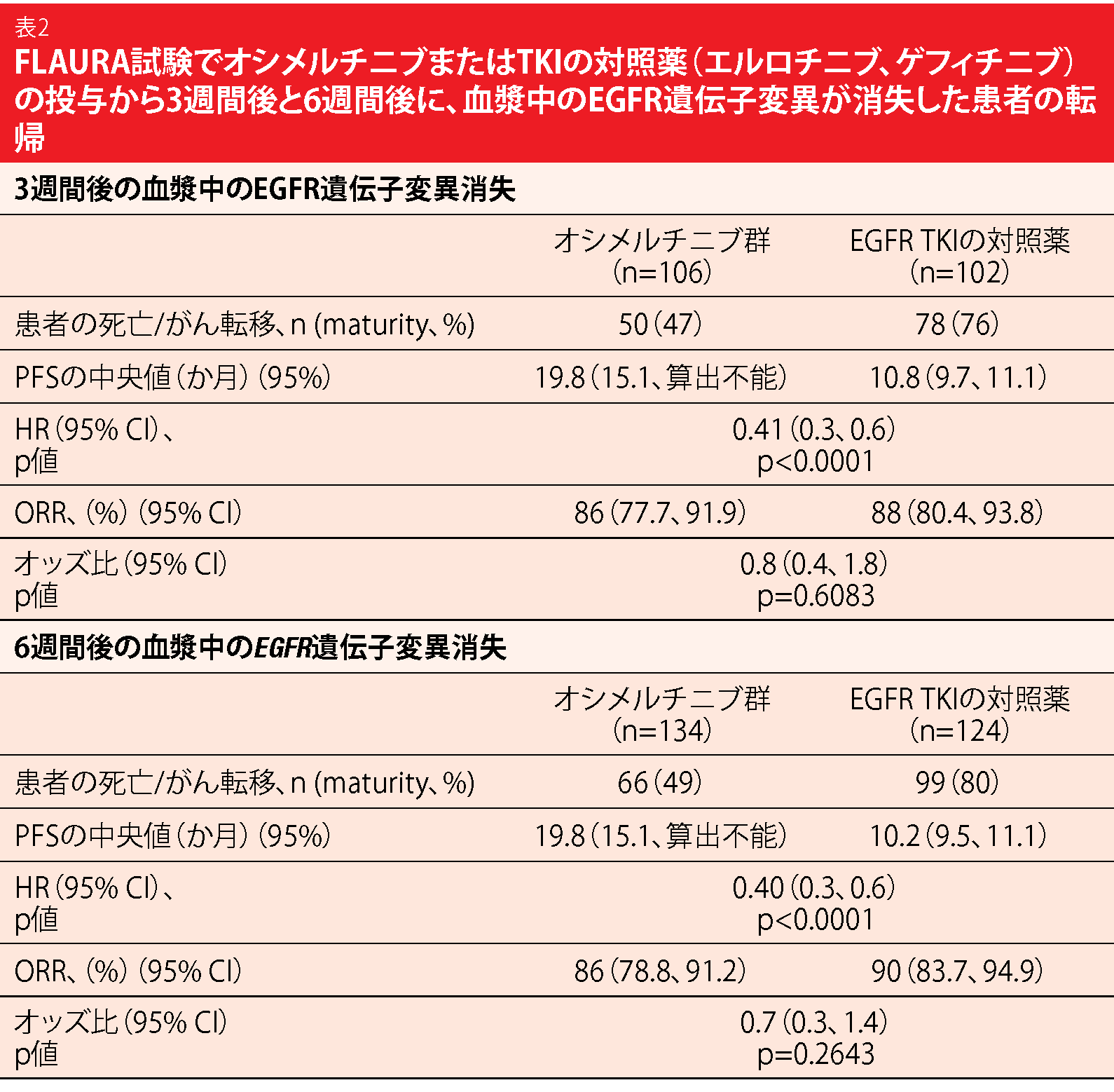
第Ⅲ相二重盲検ランダム化比較FLAURA試験では、オシメルチニブを用いたファーストライン治療の有効性などを検証している。この試験でEGFR遺伝子変異陽性の進行NSCLC患者を対象に、EGFR TKIのエルロチニブおよびゲフィチニブと比較したところ、それらのPFSを上回る結果が得られた[3]。AURA試験では、血中循環腫瘍DNA(ctDNA)の早期の消失と、PFSの改善に相関性が認められている[11、12]。ctDNAが早い段階で消失することがPFSとORRの予測因子になりうるのかを判断するため、FLAURA試験で治験薬の投与開始から3週間後または6週間後に検出したEGFR遺伝子変異と、臨床転帰との関連性に探索解析を行い、その結果をZhouらが発表した[13]。ベースライン時と3週間後もしくは6週間後(あるいは両方の時期)に測定可能なctDNAが検出できたのは、オシメルチニブ群では244人、対照薬群では245人だった。
EGFR遺伝子変異が血漿から早期に消失することは、転帰改善の予測因子になりえた。3週間後、6週間後の両時期にEGFR遺伝子変異を検出した患者群に比べて、同変異が消失していた患者群のPFSは統計学的有意性のある伸びをみせた(3週間後のPFSは変異消失群が13.5か月、変異検出群が9.5か月、HR:0.57、 p<0.0001)(6週間後のPFSは前者が13.5か月、後者が8.2か月、HR:0.51、p<0.0001)。EGFR遺伝子変異が消失した患者群のうち、オシメルチニブを投与された患者の3週間後のPFS(前者は19.8か月、後者は10.8か月、HR:0.41、p<0.0001)と6週間後のPFS(前者は19.8か月、後者は10.2か月、HR:0.40、p<0.0001)は統計学的有意に延長していた(表2)。3週間後に遺伝子変異を検出した場合であっても、第一世代のエルロチニブもしくはゲフィチニブを投与した患者群に比べて、オシメルチニブを投与した患者群でPFSに大きな改善が見られた(オシメルチニブ群は11.3か月、第一世代EGFR TKI群は7.0か月、HR:0.50、p=0.001)。6週間後の解析でも、オシメルチニブに良好な成績が見られた。治験薬の投与開始前に遺伝子変異を検出していた患者群ではPFSの中央値が11.1か月と、消失していた患者群の19.1か月に比べて悪い結果が出た。ORRに関しては両群ともおおむね同じで統計学的有意差もなく、73%から90%という結果になっていた。
以上のデータを考慮すると、オシメルチニブによるファーストライン治療を受けた患者の急速な増悪や死亡の危険性の高さも、早い段階で予測できる可能性がある。治療期間中の別の時点でも、時系列解析を行っているところである。EGFR TKIの投与後にEGFR遺伝子変異を検出した場合、なぜ早い段階で疾患が増悪するリスクが高くなるのか、その機序を解明しようとさらなる解析が行われている。
セカンドライン以降でのオシメルチニブの使用
上記と同様に、ファーストライン治療などをすでに終えた状況で、オシメルチニブの投与開始から50日以内にctDNAが消失するかどうかが、効果予測バイオマーカーになりうることをSongらが示した[14]。ASTRIS試験の参加者で、EGFR TKIの投与期間中に増悪した、T790M変異陽性進行NSCLC患者52人のctDNA量を経時的に測定した。その結果によると、オシメルチニブの投与開始から50日以内にあった1回目のフォローアップで、ctDNAが検出不能だった患者の場合、ctDNAを検出した患者のPFSとOSに比べて、どちらも統計学的有意に長くなっていた。(PFSは p=0.022、OSはp=0.009)
また、ctDNAが病勢進行の早期発見につながる可能性があることも分かった。X線所見で増悪が判明するよりも先に分子レベルの増悪が見られた患者が34%に上り、リードタイムの平均は2.5か月だった。この患者らはX線所見で増悪が判明した時点で、コピー数増幅(CNA)とTP53遺伝子変異を認めることが多く、CNAがある場合、それがない場合に比べてPFSもOSも短くなることが示された。これまでに得た知見を念頭に置くと、追跡調査期間の初回にctDNA量を測定することには、行うだけの価値があるだろう。
参考文献:
- Nakagawa K et al., RELAY: A multicenter, double-blind, randomized phase 3 study of erlotinib in combination with ramucirumab or placebo in previously untreated patients with epidermal growth factor receptor mutation-positive metastatic non-small cell lung cancer. J Clin Oncol 37, 2019 (suppl; abstr 9000)
- Noronha V et al., Phase III randomized trial comparing gefitinib to gefitinib with pemetrexed-carboplatin chemotherapy in patients with advanced untreated EGFR mutant non-small cell lung cancer (gef vs gef+C). J Clin Oncol 37, 2019 (suppl; abstr 9001)
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378(2): 113-125
- Kobayashi Y, Mitsudomi T. Not all epidermal growth factor receptor mutations in lung cancer are created equal: Perspectives for individualized treatment strategy. Cancer Sci 2016; 107(9): 1179-1186
- Jänne PA et al., Antitumor activity of TAK-788 in NSCLC with EGFR exon 20 insertions. J Clin Oncol 37, 2019 (suppl; abstr 9007)
- Li Y et al., Afatinib in the treatment of advanced NSCLC with EGFR mutation: An observational real-world study. J Clin Oncol 37, 2019 (suppl; abstr e20518)
- Busto SA et al., Real-world clinical experience of the Galician Lung Cancer Group: Afatinib in patients with EGFR positive mutation. J Clin Oncol 37, 2019 (suppl; abstr e20654)
- Busto SA et al., Galician lung cancer group: Afatinib data as first-line treatment for elderly patients. J Clin Oncol 37, 2019 (suppl; abstr e20662)
- Kuan FC et al., Real-world outcome analysis of EGFR-mutated lung adenocarcinoma with brain metastases. J Clin Oncol 37, 2019 (suppl; abstr e13588)
- Pasello G et al., Clinical features and progression pattern of T790M+ compared with T790M-EGFR mutant NSCLC. J Clin Oncol 37, 2019 (suppl; abstr e20612)
- Thress KS et al., Complete clearance of plasma EGFR mutations as a predictor of outcome on osimertinib in the AURA trial. J Clin Oncol 2017; 35 (Suppl 15): 9018
- Shepherd FA et al., Early clearance of plasma EGFR mutations as a predictor of response to osimertinib in the AURA3 trial. J Clin Oncol 2018; 36 (Suppl 15): 9027
- Zhou C et al., Early clearance of plasma EGFR mutations as a predictor of response to osimertinib and comparator EGFR-TKIs in the FLAURA trial. J Clin Oncol 37, 2019 (suppl; abstr 9020)
- Song Y et al., Predictive and prognostic values of circulation tumor DNA clearance in osimertinib-treated advanced non-small cell lung cancer cohort. J Clin Oncol 37, 2019 (suppl; abstr 3036)
More posts
小細胞肺がん:セカンドライン治療の改善
小細胞肺がん:セカンドライン治療の改善 ルルビネクテジン単独療法 再発性小細胞肺がん(SCLC)患者への治療の選択肢は非常に限られている。プラチナ製剤感受性肺がんのセカンド
まれな遺伝子変異:治療を一歩先へ進める
まれな遺伝子変異:治療を一歩先へ進める GEOMETRY mono-1試験:MET遺伝子変異陽性NSCLCへのカプマチニブ投与 NSCLC患者の3%から4%にMETエクソン
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー
ALK融合遺伝子陽性NSCLCにおける血液検体を用いたリキッドバイオプシー Rafał Dziadziuszko, MD, PhD, Department of Oncol
臨床試験の最新結果および免疫療法の新規バイオマーカー
臨床試験の最新結果および免疫療法の新規バイオマーカー ペンブロリズマブの長期成績:KEYNOTE-001試験 KEYNOTE-001試験は、進行NSCLCの治療歴のない患者
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見
EGFR遺伝子変異陽性肺がんへの新規第一選択薬およびその他の知見 RELAY試験:ラムシルマブの追加 EGFR遺伝子変異陽性肺がん患者には、EGFR TKIがおおむね有効だ
早期NSCLC:期待を持てる(ネオ)アジュバント療法
早期NSCLC:期待を持てる(ネオ)アジュバント療法 NEOSTAR試験 切除可能な非小細胞肺がん(NSCLC)のⅠ期からⅢ期と診断された患者の半数以上は再発するため、効果