小細胞肺がん:限界をさらに広げる
高線量照射が可能であることが証明された
化学療法と胸部放射線療法(TRT)の同時併用は、1990年代初期から限局型小細胞肺がん(SCLC)の標準治療となっており、1日2回照射、総線量45GyのTRTが最も広く推奨されている治療スケジュールである。しかし、化学放射線治療後に治癒する患者は3分の1未満である。最大50%の患者では、生存率の低下と関連する局所進行がみられるようになる[1, 2]。
Hallqvistらは、1日2回照射、高線量60GyのTRTが実施可能で安全であることを示した[3]。この戦略は忍容性があり、局所制御と生存率を改善するという仮説に基づき、Grønbergらによる第II相ランダム化比較試験では、1日2回(10回/週)の分割照射による60Gy/40回を45Gy/30回と比較した[4]。シスプラチンまたはカルボプラチンとエトポシドによる化学療法4コースを0週目、3週目、6週目および9週目に施行した。全患者が化学療法の2コース目とともにTRTを開始した。化学放射線療法に反応した人には、4コース目の化学療法を終了した後に予防的全脳照射(PCI)が行われることもあった。全身治療およびTRTの治療歴がないII期/III期または手術不能なI期の患者が登録され、高線量群では84人、標準線量群では76人について解析が行われた。この研究の主要評価項目は2年生存率であった。
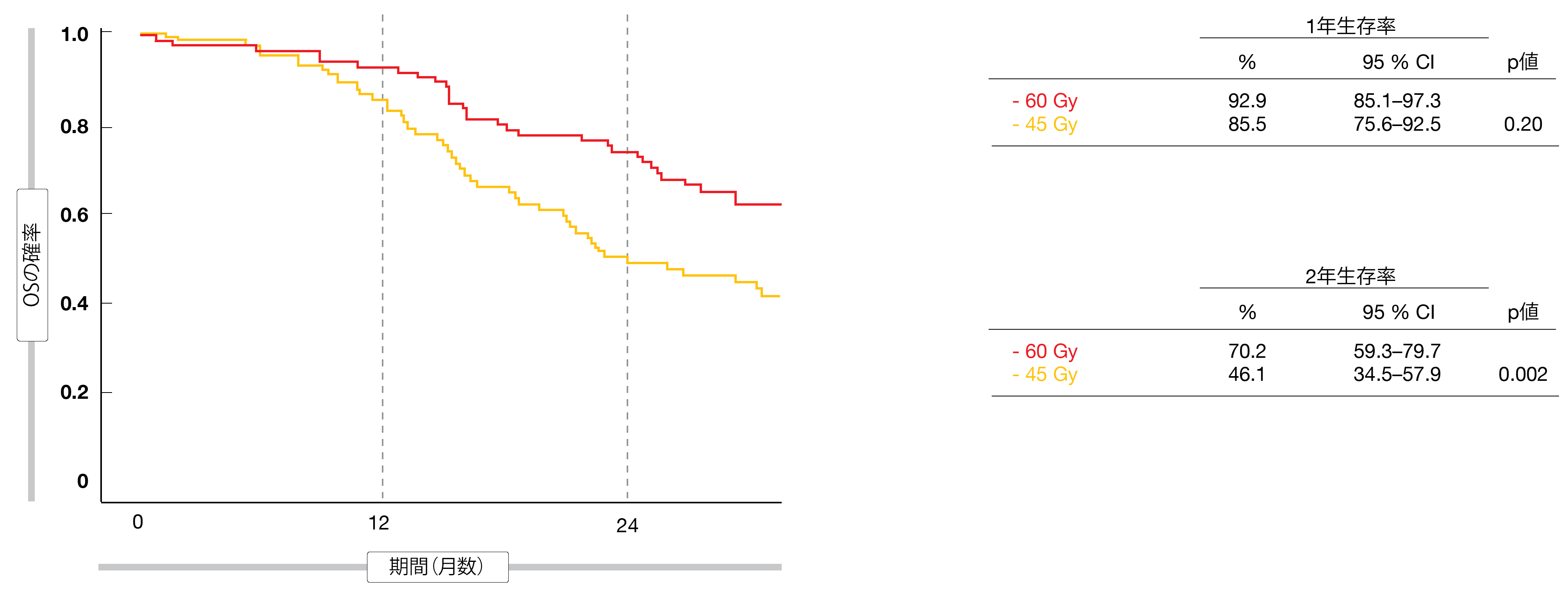
総線量60Gyの照射がほぼ全例で実施可能であることが証明された。両群とも、96%の患者がTRTを完遂し、80%以上の患者がPCIを受けた。奏効率は高線量TRTと標準線量TRTで同等であった(前者 88.5%、後者 84.9%)。これは完全奏効率でも同様であった(前者 20.5%、後者 23.2%)。主要評価項目については、高線量照射に有意かつ大幅な改善が示され、2年OS率は高線量で70.2%、標準線量で46.1%であった(p = 0.002、図1)。OS中央値には有意差があった(前者 41.6カ月、後者 22.9カ月、ハザード比 0.63、p = 0.027)が、PFSには有意差はなかった(前者 19.9カ月、後者 14.4ヵ月、ハザード比 0.80、p = 0.257)。
重要な点は、高線量によって標準線量よりも多くの放射線毒性が生じなかったことである。グレード3/4の有害事象発現率は、血球減少、好中球減少、食道炎および間質性肺炎に関しては治療群間で差がなかった。
図1:限局型SCLCに対する胸部照射の線量について60Gyと45Gyを比較したときの1年後および2年後の生存率
ES-SCLC:CASPIAN試験の新たな結果
進展型小細胞肺がん(ES-SCLC)に対しては30年以上にわたりあまり進歩がなかったが、一次治療でプラチナベースの化学療法に免疫療法を追加することによってOSが改善された[5, 6]。第III相国際多施設共同非盲検ランダム化比較試験のCASPIAN試験では、PD-L1阻害薬であるデュルバルマブとエトポシドの併用による一次治療によって、エトポシド単剤と比較して、有意なOSの改善が得られることが示された(ハザード比 0.73、p = 0.0047)[5]。対照群では、予防的全脳照射(PCI)も選択可能であった。デュルバルマブとエトポシドの併用療法は、2020年3月に米国当局からES-SCLCに対して承認されており、世界各国の保健当局でも審査中である。
CASPIAN試験ではもうひとつの試験治療群を設定して、デュルバルマブとエトポシドの併用に追加したCTLA-4阻害剤トレメリムマブを評価した。追加のトレメリムマブを3週ごと4サイクル投与した後、デュルバルマブを維持療法として投与した。ASCO年次総会では、Paz-Aresらが、この患者群とエトポシド単剤を投与した対照群とを比較した一次解析を発表した[7]。この解析によれば、デュルバルマブとエトポシドの併用にトレメリムマブを追加することによって、エトポシド単剤と比較して、OSに有意な改善はみられなかった(トレメリムマブ追加 10.4カ月、対照 10.5カ月、ハザード比 0.82)。さらに、試験担当医師らはデュルバルマブとエトポシドの併用とエトポシド単剤の比較に関して予定されていた最新解析の結果を報告した。追跡期間をさらに11カ月の追加した後、化学療法と併用したデュルバルマブは、エトポシド単剤を最大6サイクルとPCIの使用を許可した強力な対照群と比較して、引き続きOSの改善を示した(デュルバルマブ 12.9カ月、対照 10.5カ月、ハザード比0.75、名目上の p = 0.0032)。
OS曲線では両群の差が持続しており、24カ月時点での生存率はデュルバルマブ群が22.2%、対照群が.14.4%であった。デュルバルマブ関連の効果は、あらかじめ設定された全サブグループに観察され、PFS(24カ月時点でデュルバルマブ群 11.0%、対照群 2.9%)、奏効率(前者 67.9%、後者 58.0%、オッズ比 1.53)、奏効期間(24カ月時点で前者 13.5%、後者 3.9%)などの主な有効性の副次的評価し項目にも観察された。全群での安全性の所見は、使用された全薬剤の既知の安全性プロファイルと一致していた。以上の結果は、ES-SCLCに対する一次治療の新たな標準治療として、デュルバルマブとエトポシドの併用投与をさらに裏付けるものであり、プラチナ製剤の選択(シスプラチン対カルボプラチン)にも柔軟性を与えるものである。
KEYNOTE-604試験:ペムブロリズマブと化学療法の併用
ペムブロリズマブは、KEYNOTE-028試験とKEYNOTE-158試験に基づき、転移性SCLC患者に対する三次治療以降の治療法として数か国で承認されている[8]。プラセボ対照ランダム化比較試験のKEYNOTE-604試験では、未治療のIV期SCLC患者228人を対象に、ペムブロリズマブとエトポシドの併用を3週間ごとに4サイクル投与した[9]。この治療レジメンでは、続いてペムブロリズマブによる維持療法を最大31サイクル実施した。対照群(n = 225)では、エトポシドとプラセボによる治療の後、プラセボによる維持療法を行った。不安定な脳転移は除外された。
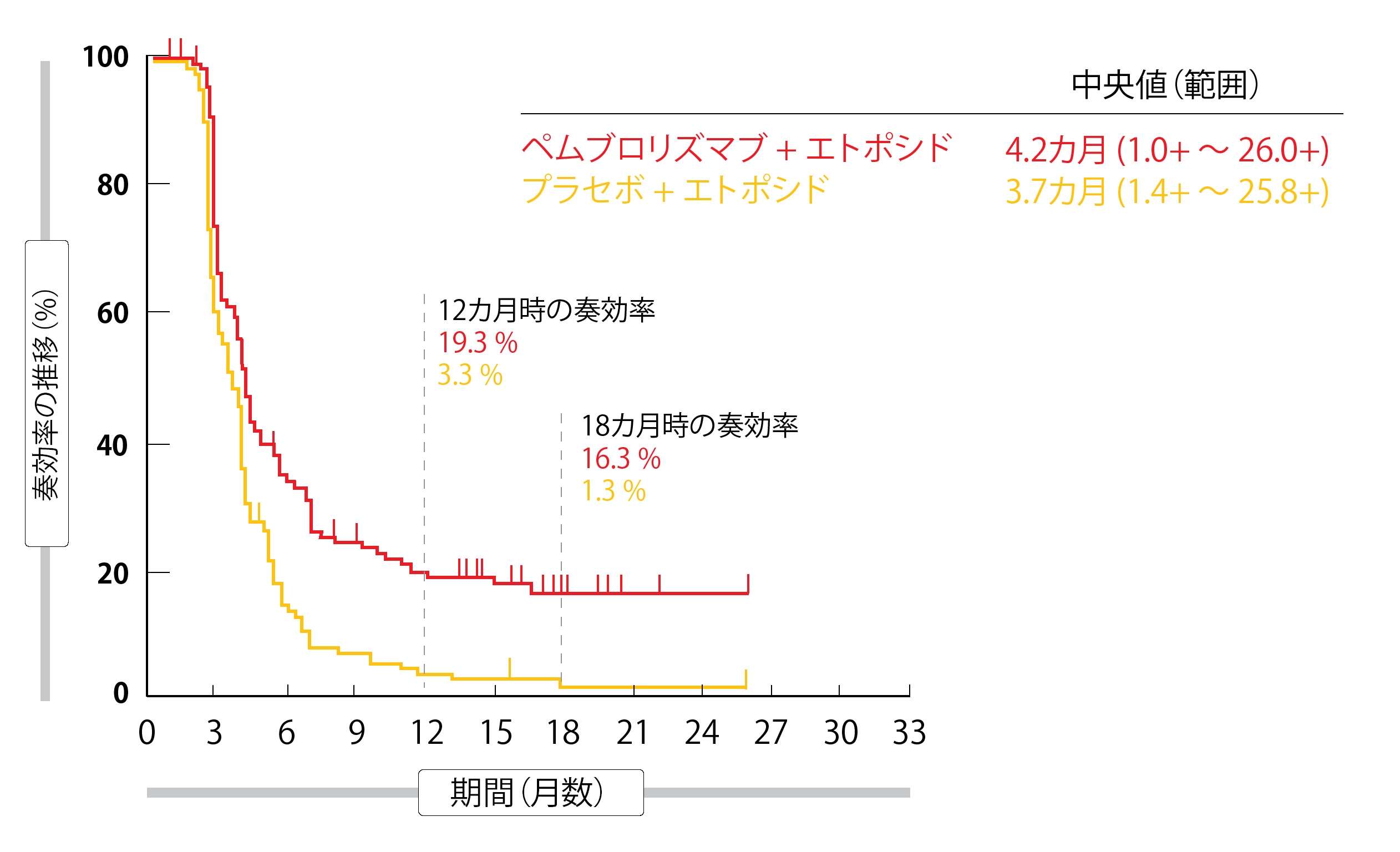
プロトコールごとの最終的なPFS解析を行った第2回中間解析の時点では、一次治療としてエトポシドにペムブロリズマブを追加することによって、エトポシド単剤と比較して、PFSが有意に改善した(前者 4.5カ月、後者 4.3カ月、ハザード比 0.75、p = 0.0023)。本試験の最終解析によれば、18カ月PFS率はペムブロリズマブ併用群が10.8%、対照群が2.1%(ハザード比 0.73)であった。ITT解析対象集団のOSの結果から、死亡リスクに20%の減少が示された(ペムブロリズマブ併用 10.8カ月、対照 9.7カ月、ハザード比 0.080、p = 0.0164)が、統計的に有意ではなかった(p = 0.0128)。24カ月時点では、ペムブロリズマブ群で22.5%、対照群で11.2%の患者jが生存していた。PFSとOSの両サブグループ解析から、ベースラインで脳転移があった患者を除き、試験治療群のサブグループ全体で結果が改善されていたことが示唆された。ORRは、ペムブロリズマブとエトポシドの併用で70.6%、エトポシド単剤では61.8%であった。完全奏効は、前者が1.86%、後者が0.9%であった。ペムブロリズマブによる治療を受けた患者のサブセットでは、奏効が持続するようであり、18カ月時点での奏効率はペムブロリズマブ併用で16.3、エトポシド単剤で1.3%であった(図2)。
併用による有害事象は予想されたとおりであり、管理可能であった。免疫介在性有害事象の全グレードの発現率は、ペムブロリズマブ併用24.7%対、エトポシド単剤で10.3%であり、治療中止に至ったのは前者が5.8%、後者が0.9%であった。著者らによれば、これらのデータは、ペムブロリズマブの有用性と、SCLC治療での免疫療法の価値を裏付けるものであるという。
図2:KEYNOTE-604試験でペムブロリズマブと化学療法の併用をプラセボおよび化学療法の組み合わせと比較したときの奏効期間の比較
ECOG-ACRIN EA5161試験でのニボルマブの評価
進展型小細胞肺がん(ES-SCLC)に対するニボルマブの役割を評価するために、ECOG-ACRIN EA5161試験が実施された[10]。本試験では、化学療法未治療の患者を、エトポシドとニボルマブの併用療法に続いてニボルマブ維持療法(n = 75)、または化学療法のみに続いて観察療法(n = 70)に無作為に割り付けた。脳転移に対して治療を受けた患者も参加が認められた。
主要評価項目であるPFSについては、ニボルマブをベースとしたレジメンでは、PFS中央値が5.5カ月であり、対照群の4.7カ月と比較して優れていた(ハザード比 0.68、p = 0.047)。副次評価項目としてのOSも、試験治療群のほうが良好ではあったが有意ではなかったが(ニボルマブ 11.3カ月、対照 9.3カ月、ハザード 比0.73、p = 0.14)。ニボルマブ群の52%、対照群の47%に奏効が認められ、奏効期間中央値は前者が5.6カ月、後者は3.3カ月であった。ニボルマブと化学療法の併用は忍容性に優れており、毒性は管理可能であった。グレード 3~4 の有害事象は両治療群に同等の頻度で発生した。試験担当医師らは結論として、ECOG-ACRIN EA5161試験により、ES-SCLCに対するニボルマブの有効性が確認されたとしている。
参考文献:
- Turrisi AT et al., Twice-daily compared with once-daily thoracic radiotherapy in limited small-cell lung cancer treated concurrently with cisplatin and etoposide. N Engl J Med 1999; 340(4): 265-271
- Kubota K et al., Etoposide and cisplatin versus irinotecan and cisplatin in patients with limited-stage small-cell lung cancer treated with etoposide and cisplatin plus concurrent accelerated hyperfractionated thoracic radiotherapy (JCOG0202): a randomised phase 3 study. Lancet 2014; 15(1): 106-113
- Hallqvist A et al., Accelerated hyperfractionated radiotherapy and concomitant chemotherapy in small cell lung cancer limited-disease. Dose response, feasibility and outcome for patients treated in western Sweden, 1998-2004. Acta Oncol 2007; 46(7): 969-974
- Grønberg BH et al., Randomized phase II study comparing the efficacy of standard-dose with high-dose twice-daily thoracic radiotherapy in limited stage small-cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9007)
- Paz-Ares L et al., Durvalumab plus platinum-etoposide versus platinum-etoposide in first-line treatment of extensive-stage small-cell lung cancer (CASPIAN): a randomised, controlled, open-label, phase 3 trial. Lancet 2019; 394: 1929-1939
- Horn L et al., First-line atezolizumab plus chemotherapy in extensive-stage small-cell lung cancer. N Engl J Med 2018; 379: 2220-2229
- Paz-Ares L et al., Durvalumab ± tremelimumab + platinum-etoposide in first-line extensive-stage SCLC: updated results from the phase 3 CASPIAN study. J Clin Oncol 38: 2020 (suppl; abstr 9002)
- Chung JC et al., Pembrolizumab after two or more lines of previous therapy in patients with recurrent or metastatic SCLC: results from the KEYNOTE-028 and KEYNOTE-158 studies. J Thorac Oncol 2020; 15: 618-627
- Rudin CM et al., KEYNOTE-604: pembrolizumab or placebo plus etoposide and platinum as first-line therapy for extensive-stage small-cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9001)
- Leal TA et al., Randomized phase II clinical trial of cisplatin/carboplatin and etoposide alone or in combination with nivolumab as frontline therapy for extensive stage small cell lung cancer: ECOG-ACRIN EA5161. J Clin Oncol 38: 2020 (suppl; abstr 9000)
© 2019 Springer-Verlag GmbH, Impressum