早期がんの転帰を改善するための(術前)術後補助療法による戦略
NSCLC患者の約30%には、診断時に切除可能な病変が認められる [1-3]。早期NSCLCの主な治療法は手術である。切除後、II期/IIIA期の肺がん患者および選定されたIB期の患者には、シスプラチンをベースとした補助化学療法が推奨される [4]。しかし、手術および補助化学療法後の再発・死亡率は依然として高く、IB期では45%、III期では76%となっている [5]。ということは、臨床アウトカムを改善させるための新しい有効な治療薬に依然としてニーズがあることは明らかである。
ADAURA試験:オシメルチニブを用いた術後補助療法
第三世代のEGFR-TKIであるオシメルチニブは、EGFR 遺伝子変異陽性の進行NSCLC患者に対する一次治療および二次治療の標準治療のひとつとして確立している。この薬剤の有効性および安全性プロファイルから、早期がんに対する効果が示唆されるという観察に基づいて[6]、第III相二重盲検ランダム化比較試験のADAURA試験では、EGFR 遺伝子変異陽性(エクソン19欠失またはL858R変異)の非扁平上皮肺がんの完全切除を受けた患者を対象に、オシメルチニブ80mg/日(n = 339)とプラセボ(n = 343)を比較検討した。組織学的には切除縁陰性が示されており、脳CTやMRIスキャンを含む画像診断では病変がないことが示されていた。無作為割り付けの前に、術後の標準補助化学療法は許可されていたが、放射線療法は許可されていなかった。手術から無作為割り付け時までの間の最長期間は、補助化学療法を行わない場合は10週、補助化学療法を行う場合は26週であった。予定された治療期間は3年であった。両群ともに約3分の1の患者がIB期、II期、IIIA期であり、55%が補助化学療法を受けていた。主要評価項目はII期/IIIA期の患者の無病生存期間(DFS)とした。
独立データモニタリング委員会の勧告を受け、オシメルチニブによる治療に圧倒的な効果が認められたため、2年前倒しで非盲検化試験とした。ASCO年次総会では、HerbstらがADAURA試験の予定外の中間解析結果を発表した[7]。非盲検化した時点で本試験の登録は終了しており、全患者が1年以上の追跡調査を受けていた。
リスクの大幅な低減
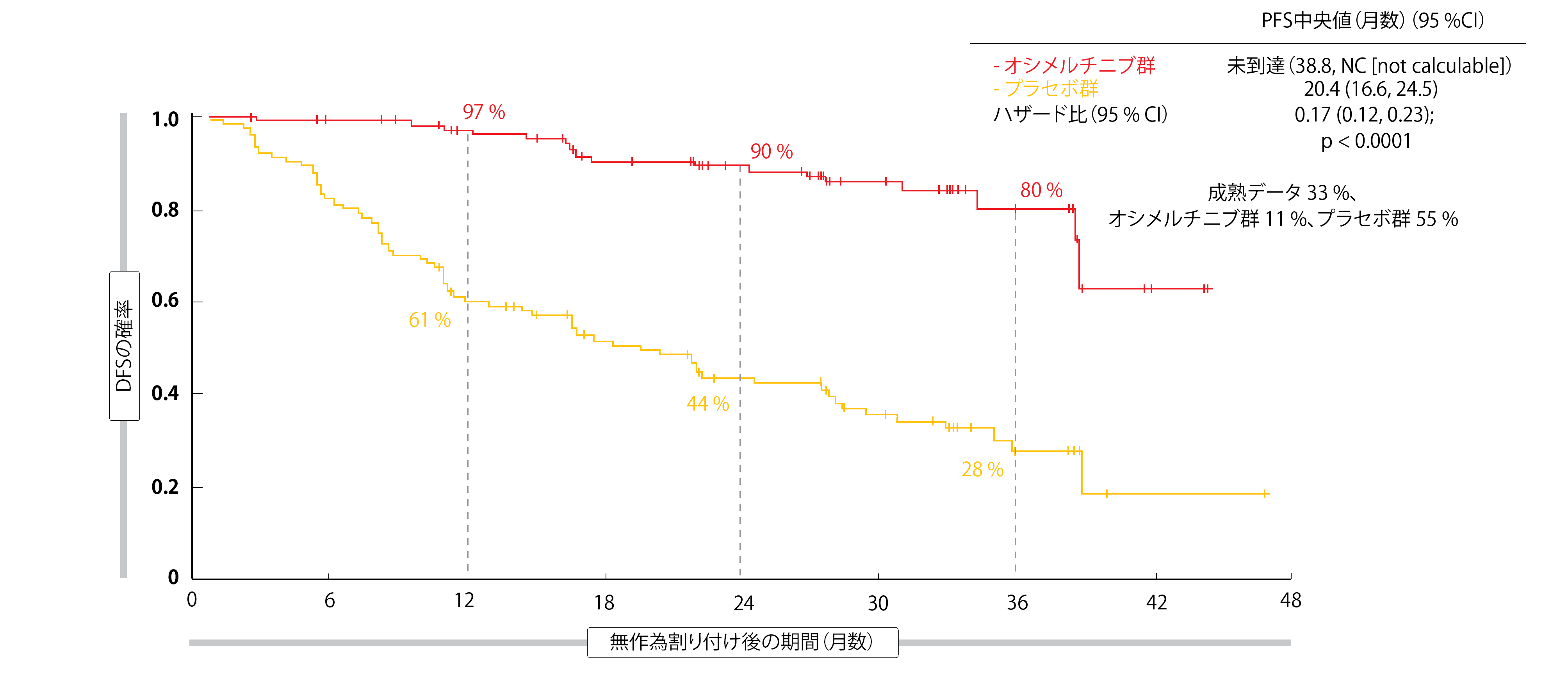
主要評価項目については、オシメルチニブによる治療によってII期/IIIA期の患者の再発・死亡リスクが83%減少した。試験治療群ではDFS中央値に達しておらず、対照群では20.4ヵ月であった(ハザード比 0.17、p < 0.0001、図1)。主な副次評価項目である全集団のDFSも満たされた。低リスクのIB期の患者を加えても、リスク減少は79%に達した (オシメルチニブ 未到達、対照 28.1カ月、ハザード比 0.2、p < 0.0001)。2年の時点で、DFSはオシメルチニブ群で89%、対照群で53%であった。
あらかじめ設定されたサブグループ全部に、オシメルチニブによる治療の有用性が認められた。特に、患者が術後化学療法を事前に受けていたかどうかに関係なく、DFSが改善された。病期別に解析したところ、オシメルチニブ群では、IB期(87%)、II期(91%)およびIIIA期(88%)のいずれも2年DFS率が高く維持されていたのに対し、プラセボ群では病期が進むにつれて急速に低下していた。したがって、ハザード比では、II期(0.17)とIIIA期(0.12)に最大のリスク低減が示された。OSの結果はまだ成熟していないが、中間解析ではすでに60%の有効性が示唆されている(ハザード比 0.40)。術後補助療法としてのオシメルチニブの安全性プロファイルは、確立されている安全性プロファイルと一致していた。最も多かった有害事象は、患者の46%に下痢がみられ、次いで爪囲炎(25%)、皮膚乾燥(23%)であった。有害事象は全般的に軽度であった。グレード1~2の間質性肺疾患は、オシメルチニブによる治療を受けた患者10人(3%)について報告され、QTc延長は22人(7%)に認められたのに対し、対照群では4人(1%)であった。
著者らは要約として、術後補助療法としてのオシメルチニブは、EGFR 遺伝子変異陽性のIB期/II期/IIIA期のNSCLC患者に対して、国際共同臨床試験で統計学的に有意であり臨床的に意味のあるDFSの改善を示した初めての標的治療薬であると指摘している。したがって、オシメルチニブは、腫瘍の完全切除後の実践を変えるような効果の高い治療法である。
図1:ADAURA試験の主要評価項目:II期/IIIA期の患者の無病生存期間
CTONG1104試験:全生存期間に関するゲフィチニブと化学療法の比較
第III相ランダム化比較試験のCTONG 1104試験では、完全切除したEGFR 遺伝子変異陽性のII期/IIIA期NSCLCに対して、第一世代EGFR-TKIのゲフィチニブ250mg/日を用いた補助療法が、ビノレルビンとシスプラチンによる標準的な2剤併用化学療法と比較して、DFSに有意な効果を確立した[8]。ASCO年次総会では、Wuらが追跡期間中央値80.0カ月後のOSの最終結果を発表した[9]。Intent-to-treat(ITT)解析対象集団では、各治療群の患者数が111人であったが、プロトコルごとの(per-protocol)(PP)解析対象集団では、ゲフィチニブ群が106人、化学療法群が87人であった。
解析によれば、ゲフィチニブは化学療法と比較して、両解析対象集団ともに全生存期間の中央値がゲフェチニブ群75.5カ月、化学療法群62.8カ月であり、この差は有意ではなかったが(ハザード比 0.92)、延命効果が認められた。5年OS率はITT集団でゲフィチニブ群が53.2%、化学療法群が51.2%であり、PP集団でも同様の結果が得られた。著者らは、今回ゲフィチニブ群にみられたOSは、過去のデータと比較して、完全切除後のIIB期/IIIA期NSCLCに対して最良の結果のひとつであると述べている[10]。DFSの最新所見では、ゲフィチニブの有意な有効性が示された(ゲフィチニブ 30.8カ月、化学療法 19.8カ月)。再発・死亡リスクはITT集団で44%(p = 0.001)、PP集団で49%(p < 0.001)減少した。しかし、この利点はOSの有意な差にはつながらなかった。
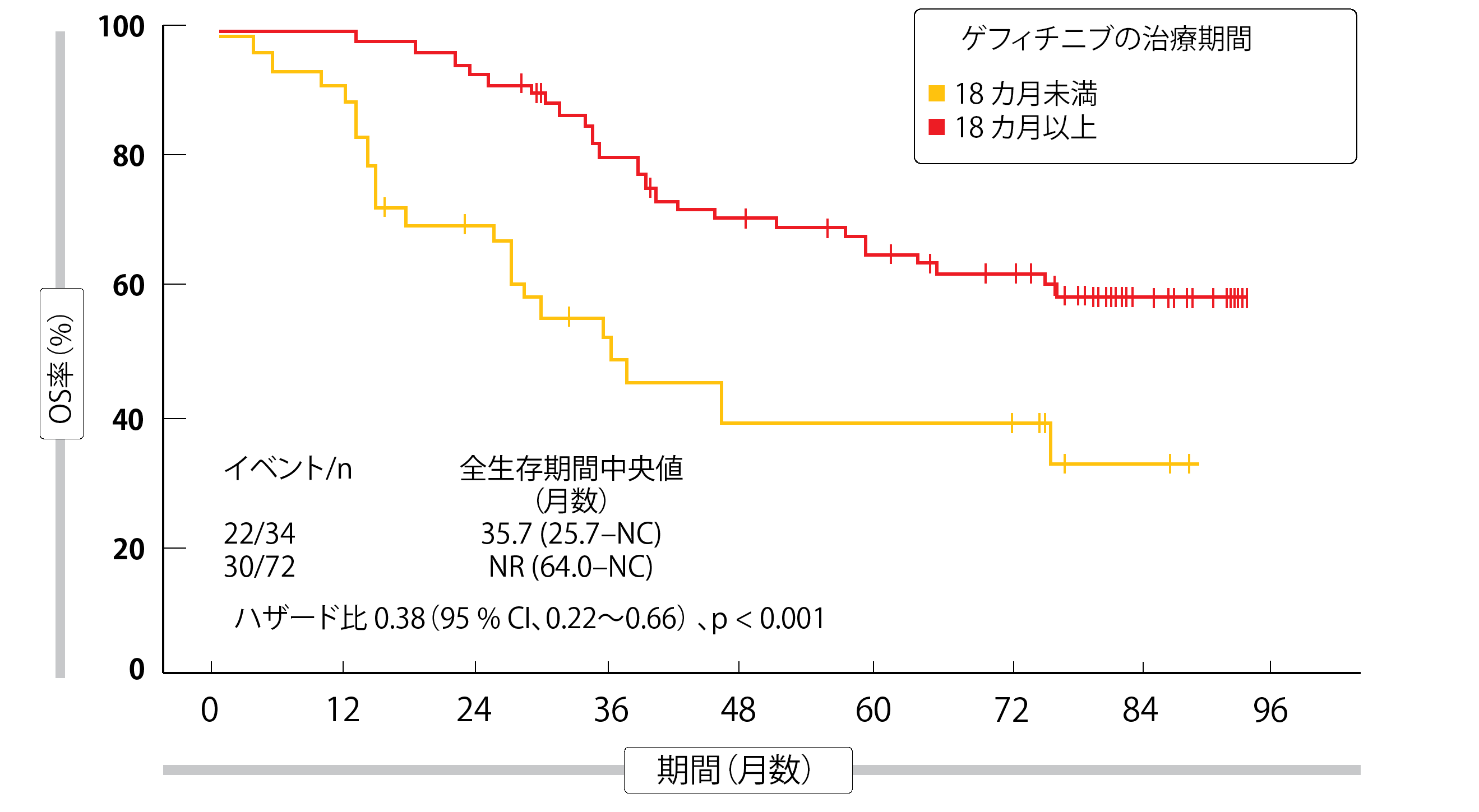
事後解析によれば、その後にTKI治療を受けたゲフィチニブ群の患者は、その後に他の治療を受けたか治療を全く受けなかった患者と比較して、両群間で最長のOSを達成した(p < 0.001)。ゲフィチニブ群の患者のうち、その後にオシメルチニブによる治療を受けた患者で奏効率が最も高く、55.6%であった。さらに、ゲフィチニブによる治療を18カ月以上受けた患者では、治療期間が18カ月未満の患者よりも有意に良好なOSが得られた(ハザード比 0.38、p < 0.001、図2)。著者らは結論として、完全切除後のEGFR 遺伝子変異陽性のII期/IIIA期NSCLC患者に対しては、DFSを改善してOSを延長させる可能性のある最適な治療法として術後補助療法にEGFR-TKI治療を検討するべきであると述べている。
図2:CTONG1104試験でのゲフィチニブによる術後治療期間と全生存期間の関係
化学放射線療法前のアテゾリズマブ
早期NSCLCに対するPD-1/PD-L1阻害薬による術前補助療法は、実行可能であり、高い病理学的奏効率と関連していることが示されている [11-14]。このため、第II相単群AFT-16試験では、切除不能なIIIA/B期NSCLC患者を対象に、根治的化学放射線療法(CRT)の前に補助療法としてアテゾリズマブを投与することのリスクと有用性を検討した[15]。解析に含まれたのは患者62人であった。参加者はCRTの前にアテゾリズマブ1,200mgを3週間に1回、合計4回の投与を受けた。CRTの後、補助療法としてアテゾリズマブを投与して1年間の治療を終了した。
主要評価項目である12週時点でのの病勢コントロール率は77.4%であった。ベースラインのPD-L1発現状態は、患者49人に関して得られた。PD-L1発現が1%未満のグループでは病勢コントロール率が82.4%、1%以上のグループでは90.9%であった。CRT前後のアテゾリズマブは忍容性に優れており、有害事象のほとんどがグレード1として報告された。特に注意を引いた有害事象には、甲状腺機能亢進症、甲状腺機能低下症、発疹、アナフィラキシー反応、大腸炎、ギラン・バレー症候群などがあり、計10人に認められた。著者らが指摘するように、III期の切除不能なNSCLCでは、免疫チェックポイント阻害薬による導入療法についてさらに研究が必要である。
SABRとアテゾリズマブの併用
定位的アブレーション放射線療法(SABR)は、手術不能な早期のNSCLCに使用されるが、局所病変および遠隔病変に対して無効となることが依然として問題である[16]。放射線療法と免疫チェックポイント阻害薬の相乗効果が実証されたデータがあり、治療の前の補助療法としてチェックポイント阻害薬を使用することが治療後の補助療法としてのみ使用するよりも優れている可能性が示唆されている[17, 18]。この観察結果に基づいて、Kellyらは高リスクの早期NSCLCを対象に、SABR前、SABR中、SABR後に投与したアテゾリズマブの安全性と最大耐量を評価するための第I相試験を実施した[19]。手術不能なNSCLC(T1~3 N0 M0)では、特定の腫瘍径や分化不良な組織型など、再発リスクが高いと予測される特徴が1つ以上認められる患者に対して、3つの用量設定でアテゾリズマブを6サイクル投与し、第3サイクルの期間中に同時にSABRを1回あたり10Gy~12.5Gyの線量で5回照射した。20人中15人の患者が全6サイクルを完了した。
アテゾリズマブ1,200mg/kgが第Ⅱ相推奨用量として確認された。アテゾリズマブの最初の2サイクル後に病期を再判定したところ、すでに抗腫瘍効果の徴候がみられ、22%に未確認の部分奏効が認められた。患者計20人のコホートのPFS中央値は25.5カ月であった。PD-L1陽性腫瘍群では、PFSはPD-L1陰性群のほぼ2倍(前者 30.0カ月、後者 16.3カ月)であった。全体的にみて、SABR前、SABR中およびSABR後のアテゾリズマブの投与は実施可能であり、忍容性に優れていることが証明された。治療関連有害事象(血球減少、疲労、発疹、下痢など)は、主にグレード1と2に限定されていた。患者2人に間質性肺炎が発現したが、グレード1と2であった。炎症を起こした腫瘍の微小環境が治療の奏効と関連している可能性があるため、血液と組織を使った追加のバイオマーカー解析が進行中である。さらに、アテゾリズマブとSABRの併用は現在、第III相ランダム化比較試験のSWOG/NRG S1914試験で検証されている。
周術期のデュルバルマブ
術前にシスプラチンおよびドセタキセルを3サイクル投与した後、術前にデュルバルマブ750mg/m²を2週間ごとに2サイクル投与する術前補助化学療法が、第II相多施設共同単群試験のSAKK 16/14試験で検討された[20]。術後にデュルバルマブによる治療が1年間継続された。本試験では、切除可能なIIIA期NSCLC(T1-3 N2 M0)の患者67人を対象とした。12カ月時点の無イベント生存期間(EFS)を主要評価項目とした。
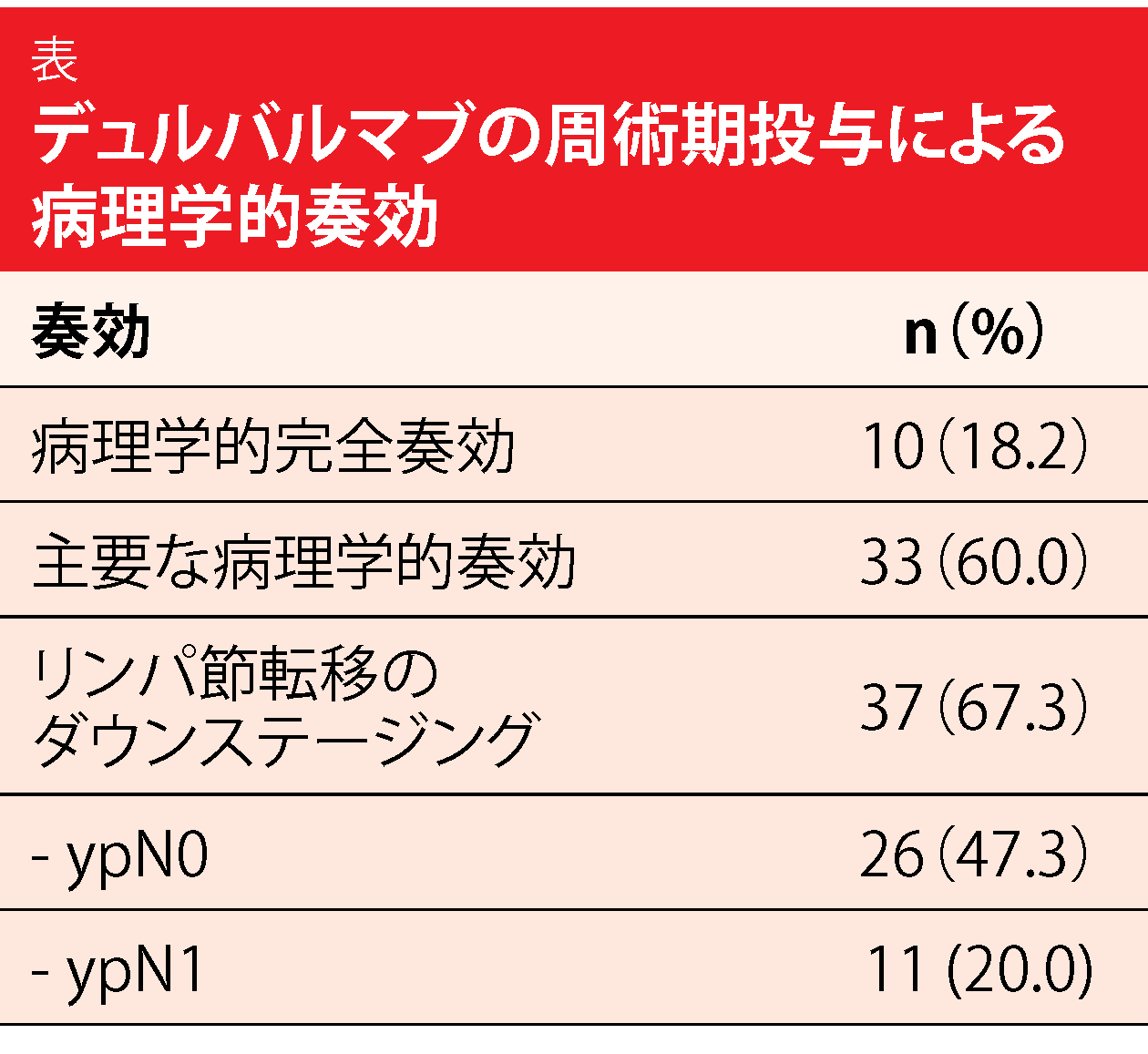
患者58人が術前補助療法としての免疫療法を終了し、55人が手術を受けた。そのうち91%にR0切除が達成された。患者の18.2%が病理学的完全奏効を達成し、67.3%にリンパ節転移のダウンステージングが得られた(表)。また、解析の結果、主要な病理学的奏効の割合が高いことが明らかになった。12カ月時点のEFSは73.3%となり、解析時にはEFS中央値に達していなかった。同様に、OS中央値は未到達である。術後30日の死亡率は1.8%であった。
著者らによれば、標準治療のシスプラチンとドセタキセルに加えて周術期にデュルバルマブを投与することは安全であり、1年のEFS率は化学療法単独の過去のデータを上回る有望な結果を示した。標準的な術前補助化学療法に加えて周術期にPD-L1阻害薬を投与することが、術前補助療法としての免疫調節放射線療法の有用性を評価するSAKK 16/18試験の土台となっている。
導入化学療法と放射線またはベバシズマブの併用
第II相ランダム化比較試験のPIT-1試験では、IIIA期(N2)非扁平上皮NSCLC患者88人を対象に、術前のプラチナ製剤による2剤併用化学療法との併用療法として、胸部放射線療法(TRT)およびベバシズマブを評価した [21]。TRT群とベバシズマブ群では、それぞれ37人と38人の患者が手術を受けた。R0切除が可能であったのは、TRT群が97%、ベバシズマブ群が89%であった。
主要評価項目である2年PFS率については、解析によれば、ベバシズマブ群の36.8%に対してTRT群は50%という優れた有効性が示された。また、TRT群では、著しい病理学的奏効が認められる頻度が高かった(TRT 49%、ベバシズマブ 14%)。2年OS率は両群とも80%であった。治療関連有害事象のほとんどはバランスが取れていたが、グレード1~3の高血圧はベバシズマブ群のほうが多く、グレード1~2の食道炎と皮膚炎はTRTをベースとしたレジメンに限定されていた。気管支胸腔瘻による致命的な手術合併症はベバシズマブ群にのみ認められた(2人)。以上の知見に基づき、著者らは、今後の第III相試験で検証する導入レジメンとして、ペメトレキセドとシスプラチンによる2剤化学療法とTRTの同時併用を選択した。
参考文献
- Datta D, Lahiri B, Preoperative evaluation of patients undergoing lung resection surgery. Chest 2003; 123(6): 2096-2103
- Le Chevalier T, Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? Ann Oncol 2010; 21 Suppl 7: vii196-vii198
- Cagle PT et al., Lung cancer biomarkers: Present status and future developments. Arch Pathol Lab Med 2013; 137(9): 1191-1198
- Kris MG et al., Adjuvant systemic therapy and adjuvant radiation therapy for stage I to IIIA completely resected non-small-cell lung cancers: American Society of Clinical Oncology/Cancer Care Ontario Clinical Practice Guideline update. J Clin Oncol 2017; 35(25): 2960-2974
- Pignon JP et al., Lung Adjuvant Cisplatin Evaluation: A pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552-3559
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378(2): 113-125
- Herbst RS et al., Osimertinib as adjuvant therapy in patients with stage IB-IIIA EGFR mutation positive NSCLC after complete tumor resection: ADAURA. J Clin Oncol 38: 2020 (suppl; abstr LBA5)
- Zhong WZ et al., Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): A randomised, open-label, phase 3 study. Lancet Oncol 2018; 19(1): 139-148
- Wu YL et al., CTONG1104: Adjuvant gefitinib versus chemotherapy for resected N1-N2 NSCLC with EGFR mutation – final overall survival analysis of the randomized phase 3 trial. J Clin Oncol 38: 2020 (suppl; abstr 9005)
- Goldstraw P et al., The IASLC Lung Cancer Staging Project: Proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol 2016; 11(1): 39-51
- Forde PM et al., Neoadjuvant PD-1 blockade in resectable lung cancer. N Engl J Med 2018; 378(21): 1976-1986
- Kwiatkowski DJ et al., Neoadjuvant atezolizumab in resectable non-small cell lung cancer (NSCLC): Interim analysis and biomarker data from a multicenter study (LCMC3). J Clin Oncol 37, 2019 (suppl; abstr 8503)
- Cascone T et al., Neoadjuvant nivolumab or nivolumab plus ipilimumab for resectable non-small cell lung cancer (NSCLC): Clinical and correlative results from the NEOSTAR study. J Clin Oncol 37, 2019 (suppl; abstr 8504)
- Provencio M et al., NEO-adjuvant chemo-immunotherapy for the treatment of stage IIIA resectable non-small-cell lung cancer (NSCLC): A phase II multicenter exploratory study – final data of patients who underwent surgical assessment. J Clin Oncol 37, 2019 (suppl; abstr 8509)
- Ross HJ et al., AFT-16: Phase II trial of atezolizumab before and after definitive chemoradiation (CRT) for unresectable stage III non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9045)
- Timmerman R et al., Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303(11): 1070-1076
- Young KH et al., Optimizing timing of immunotherapy improves control of tumors by hypofractionated radiation therapy. PLoS One 2016; 11(6): e0157164
- Dovedi SJ et al., Acquired resistance to fractionated radiotherapy can be overcome by concurrent PD-L1 blockade. Cancer Res 2014; (74)19: 5458-5468
- Kelly K et al., Atezolizumab plus stereotactic ablative therapy for medically inoperable patients with early-stage non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9011)
- Rothschild SI et al., SAKK 16/14: Anti-PD-L1 antibody durvalumab in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC) – a multicenter single-arm phase II trial. J Clin Oncol 38: 2020 (suppl; abstr 9016)
- Takamochi K et al., PIT-1: Randomized phase II trial of pemetrexed-cisplatin plus bevacizumab or concurrent thoracic radiation therapy followed by surgery in stage IIIA (N2) nonsquamous non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9014)
© 2019 Springer-Verlag GmbH, Impressum