MET遺伝子変異陽性NSCLC:分子レベルの理解と新規治療薬
肺がんのなかでも腺がんの3%~4%および扁平上皮がんの2%の患者には、間葉上皮転換(MET)遺伝子のエクソン14に発がん性の変異が発生する[1,2]。
MET 遺伝子エクソン14 (METex14) 変異はMET 増幅と同時に存在することが多い。このような変異を有する肺がん患者の治療のために複数の薬剤が開発段階にある。選択性の高い経口METチロシンキナーゼ阻害薬(TKI)のカプマチニブとテポチニブはすでに規制当局による承認済みである。
カプマチニブは、METex14 スキッピング変異またはMET 増幅を有する非小細胞肺がん(NSCLC)IIIB期/IV期の患者を対象に、進行中の第II相国際共同非盲検試験のGEOMETRY mono-1試験で検証されているところである。本試験から、METex14 スキッピング変異を有する患者に対して空腹時にカプマチニブを投与すると、迅速かつ深く持続的な奏効が得られることが明らかになった。この結果に基づいて、2020年5月、カプマチニブはMETex14 変異陽性の転移性NSCLC患者の治療薬として米国食品医薬品局から迅速承認された。
GEOMETRY mono-1試験:MET増幅のあるNSCLC
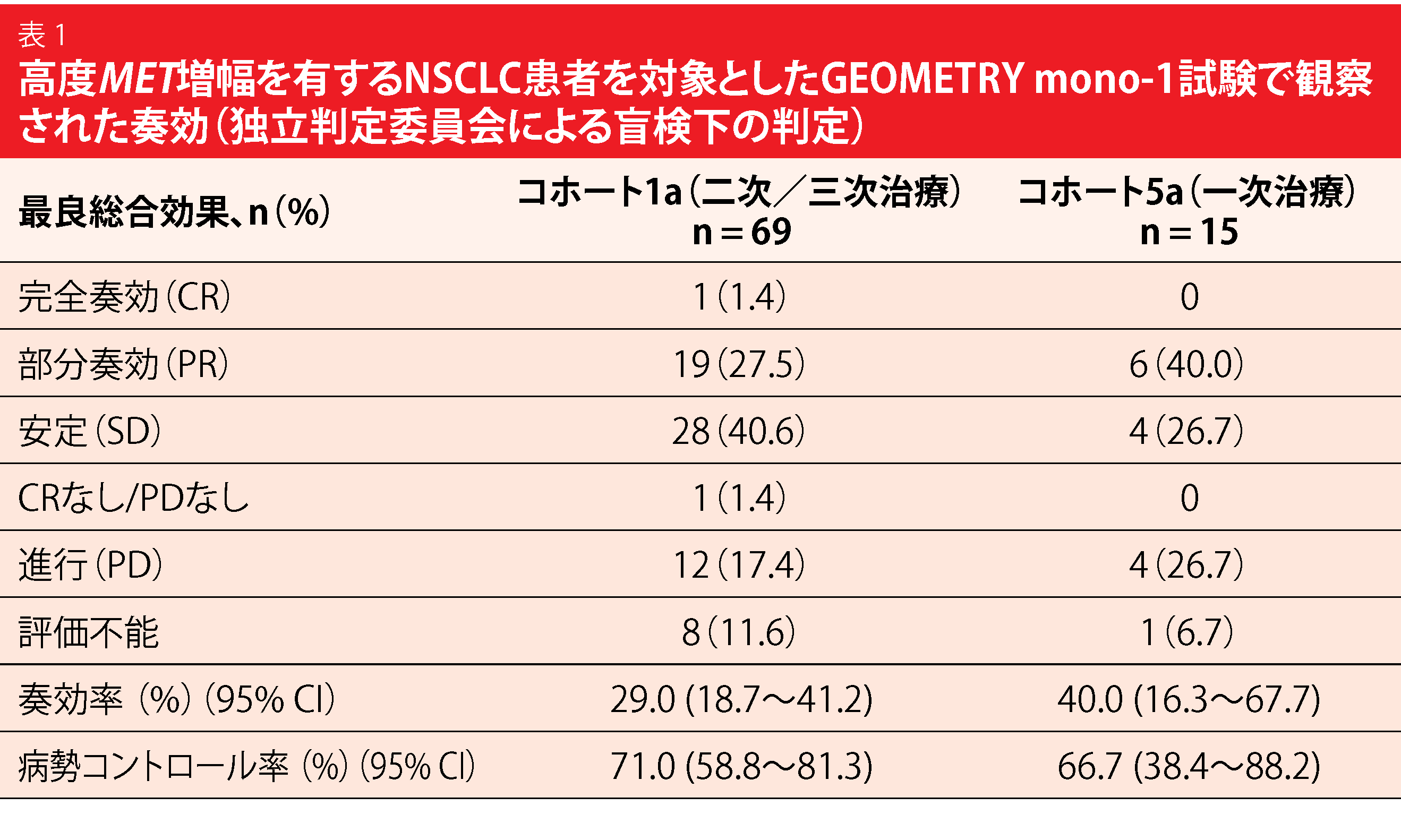
高度MET 増幅(遺伝子コピー数が10以上) は、MET遺伝子を標的とする治療薬の効果予測のためのバイオマーカー候補として現れた。ASCO 2020年次総会では、Wolfらが、GEOMETRY mono-1試験に参加した高度MET 増幅はあるが METex14変異はないNSCLC患者に対してカプマチニブ400mgを1日2回投与した結果を報告した [4]。患者は全身療法の一次治療または二次治療をすでに受けた(コホート 1a、n = 69)か、未治療(コホート 5a、n = 15)のいずれかであった。METex14変異陽性の患者が主に女性や非喫煙者であるのに対して、高度MET 増幅がある患者集団には男性や喫煙歴のある患者が多かった。主要評価項目は全奏効率(ORR)とした。独立判定委員会による盲検下の判定によれば、ORRはコホート1a で29.0%、コホート 5aで40.0% であった(表1)。コホート1a の患者1人では完全奏効を達成した。病勢コントロール率についてはコホート1aが71.0%、コホート 5aが66.7%であった。治療のどの段階にあるかがORRを左右したようであったが、それ以外の評価項目には影響がなく、いずれのコホートでもおおむね同じであった。患者に治療歴があるかないかに関係なく、中央値で約8カ月ほど奏効が持続した。無増悪生存期間(PFS)はコホート1aが4.07カ月とコホート 5aが4.17カ月、全生存期間はそれぞれ10.61カ月と9.56カ月であった。カプマチニブの安全性プロファイルは以前の報告と一致しており、良好であった。治療関連有害事象(AE)の大半はグレード1および2であった。
著者らは結論として、GEOMETRY mono-1試験のMETex14変異陽性コホートに対する一次治療および二次治療または三次治療で達成された奏効率(前者 67.9% および後者 40.6%)と比較して並みではあったが、この解析は高度MET 増幅がある進行NSCLC患者に対してカプマチニブに有効性があることを実証するものであるとした[6]。高度MET 増幅がある集団のサブグループにMET標的治療が特に有用であると仮定できる。今後、このグループの特徴をさらに詳細まで明らかにする必要がある。
空腹時服用の制限がないカプマチニブの使用
GEOMETRY mono-1試験のコホート6に対する有効性と安全性の結果がGroenらによって発表された[5]。この拡大コホートは、二次治療でカプマチニブ400㎎を1日2回服用しており、空腹
時服用の制限がない初めてのコホートであった。高度MET 増幅があり、 METex14変異がない患者(グループ1、n = 3)および、MET 遺伝子のコピー数に条件を設けず、METex14変異がある患者(グループ2、n = 31)を対象とした。
独立判定委員会による盲検下の判定によれば、奏効が認められたのはグループ2の患者のみであり、部分奏効に基づくORRは48.4%であった。一方、グループ1の患者全員が病勢安定を達成した。グループ2の奏効期間は6.93カ月であった。PFS中央値は、グループ2では8.11カ月であったが、グループ1では患者数が少なかったため評価できなかった。全体として、安全性プロファイルは管理可能であることが証明され、空腹時服用の条件下で観察された安全性プロファイルと一致していた。空腹状態での服用と比較して、空腹時という制限なしにカプマチニブを服用した場合、グレードに関係なく、消化器系の有害事象に数字上では減少傾向があったことが注目された。
要約では、著者らはカプマチニブの二次治療薬としての有効性が実証されたと結んでいる。これまでに報告された結果と併せて、治療の段階に関係なく、カプマチニブには効果があり、治療の初期に使用するほど奏効率が高いことが確認された。
METを標的とする抗体の混合物
Sym015は、遺伝子組み換えヒト化モノクローナル抗体2つを合成させた混合物であり、METにある複数の異なるエピトープに作用する。この抗体療法は、MET選択性を改善して標的以外のものによる毒性を抑えることと、キナーゼドメインの変異などMET-TKI に対して細胞内で耐性を獲得する機序を避けることを目的として開発された。第IIa相試験では、 患者計45人を対象に Sym015 の検証が行われ、第1サイクルの第1日目の初期投与量を18mg/kg として、その後の維持投与量は 12mg/kg を2週ごととした[6]。対象となった 患者のうち20人はMET 増幅またはMETex14欠失があるNSCLCであった。このコホートでは、MET遺伝子とEGFR遺伝子の両方またはいずれかの標的治療薬による事前の治療が認められており、MET-TKI 未治療患者が10人、MET-TKI 既治療患者が10人であった。この各グループには、MET 増幅がある患者およびMETex14欠失がある患者のいずれも含まれていた。
肺がん患者のなかでも奏効が認められたのは未治療患者のみ(n = 5、25%)であり、奏効期間の中央値は13.8カ月であった。既治療患者のなかで完全奏効または部分奏効が認められた者はいなかったが、一部に若干の奏効および病勢安定の延長がみられたことがデータから示唆される。病勢コントロール率(DCR)はMET-TKI 未治療患者で100%、MET-TKI 既治療患者では60%であった。NSCLCコホート全体のOS中央値はまだ達成されていないが、PFSは未治療患者が7.4カ月、既治療患者が5.4カ月であった。MET-TKI 未治療集団で得られた奏効率は、METex14変異およびMET 増幅があるNSCLCに対するMET-TKI 治療で観察された奏効率と同等であった。
Sym015は良好な安全性プロファイルを示し、最も多かった治療関連有害事象は末梢浮腫、AST(アスパラギン酸アミノトランスフェラーゼ)値上昇、悪心、無力症および食欲不振であった。対象患者全45人のうち6人にグレード3以上の有害事象が認められたが、投与量の減量を必要としたのは肺がん患者1人にとどまった。有害事象の発現により治療を中止した者はいなった。さらに、評価可能な患者9人を調べたところ、解析ではMETex14欠失に関する腫瘍組織と血中循環腫瘍DNA(ctDNA)との間に100%の一致があったため、 METex14欠失がある患者の選択にリキッドバイオプシー(液生検)が実施可能な選択肢となることが示唆された。一方、 MET 増幅の検出では一致が29%と低かった。これは腫瘍からの流出が少ないことや腫瘍があまり進化しないなどの要因によるのかもしれない。耐性の発現を遅らせるか耐性に対処するために、Sym015とMET-TKI治療の併用療法の評価が予定されている。
METex14 変異のサブタイプ
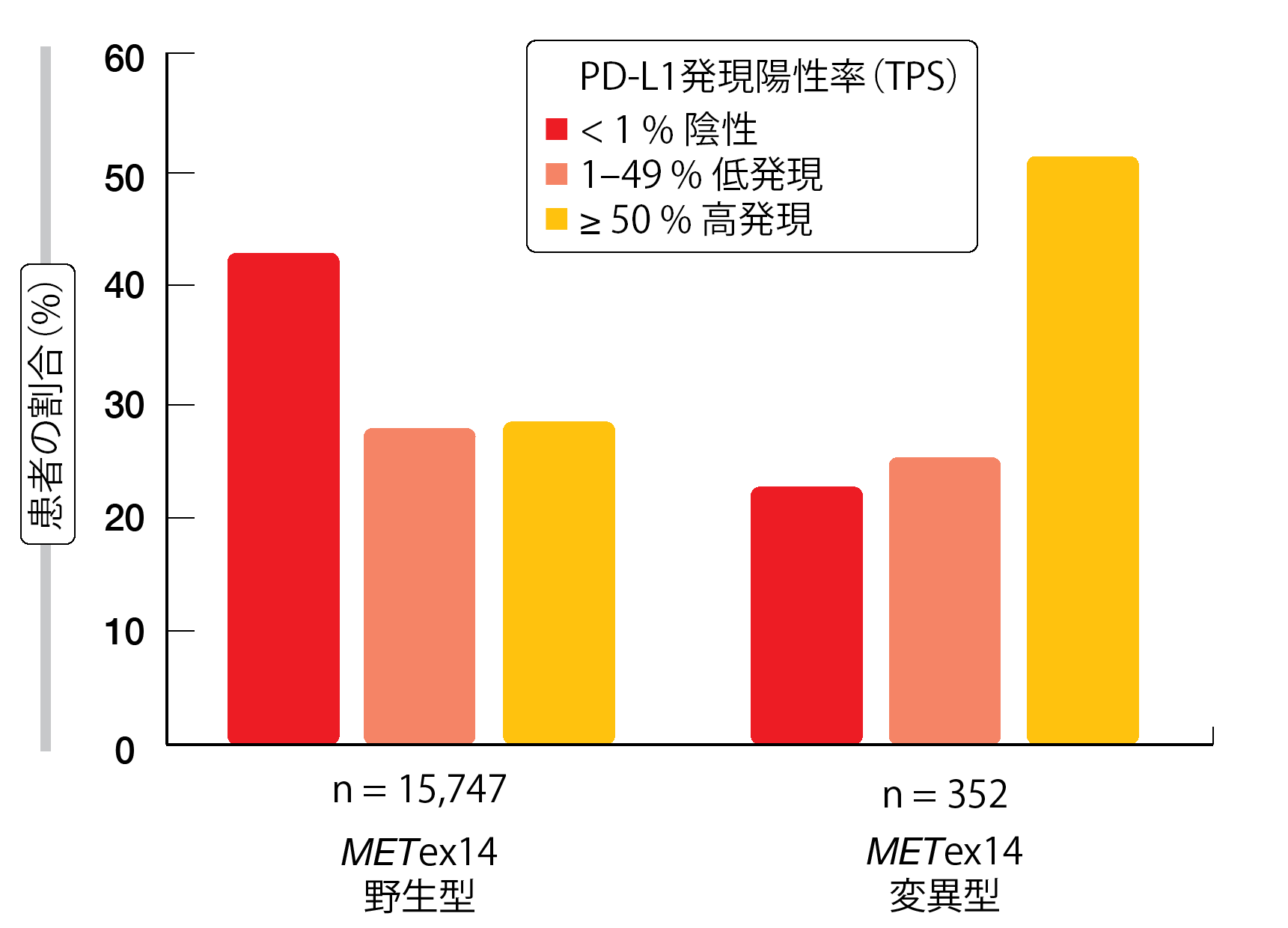
エクソン14スキッピング変異はエクソン14と隣接するイントロンでのさまざまなゲノムの異常によって生じる。Awadらは、さまざまなMETex14変異のサブタイプにみられるであろう異なる特徴を明らかにすることと、同時に発生している変異を評価するだけでなく、治療効果に影響を与えて併用療法の戦略に参考となるであろう免疫療法のバイオマーカーを評価することを目的として、NSCLC患者の検体を解析した [7]。NSCLC患者60,495人の腫瘍DNAをハイブリッドキャプチャー法によるNGS解析ゲノムプロファイル検査で調べたところ、 患者の2.3% (n = 1,387)にMETex14変異が認められ、複数の機能部位にサブセットとしてエクソン14のスキッピング、欠失またはY1003部位の変異が発生していた。METex14変異型の肺の腫瘍では、METex14 野生型の腫瘍と比較して、腫瘍遺伝子変異量(TMB)が有意に少ないことが示された(p < 0.001)。さらに変異型は、野生型の検体に比べて、PD-L1が高発現(50%以上)していることが多かった(48% 対 29%、図1)。
PD-L1陽性率はMETex14変異の機能部位のサブセット全体で比較的同じであった。いずれの場合もTMBとPD-L1発現との間に相関性は認められなかった。免疫療法の効果を予測するためのバイオマーカーとしての役割を判定するにはさらにデータが必要である。
また、MDM2、CDK4 およびMET の増幅など変異が共存している頻度はスプライシング部位全体でおおむね一貫していた。KRAS およびEGFR などドライバー遺伝子変異と同時に発生することはまれであり、その頻度はそれぞれ3.2%と0.65%である。BRAFV600E 遺伝子変異およびALK/ROS1/NTRK 融合遺伝子と同時発生することはない。
36対の検体の解析によれば、METex14の一次変異のサブタイプは耐性を獲得する可能性のある機序とは基本的に無関係であると考えられる。耐性変異は、再発したMET の二次変異(対象とした対の25%)、MET 増幅((対象とした対の8%)、およびEGFR/ErbB2 活性化、KRAS 増幅、PI3K 変異の個別例であった。
図1:肺がんにみられるMETex14変異型とMETex14野生型でのPD-L1発現率
DNAアッセイとRNAアッセイの比較
Jurkiewiczらは、METex14変異の検出にはDNAを用いた遺伝子パネル検査
(アッセイ)のみでは不十分であると仮定して、次世代シークエンサー(NGS)によって決定された肺腺がんの遺伝子プロファイリングデータを用いて、METex14変異の検出についてDNAアッセイとRNAアッセイの成績を比較した[8]。MET遺伝子エクソン2、14、16、18および19を標的とする、特注のDNAパネルを用いて患者644人の腫瘍プロファイルを得た。 DNAの検査ではドライバー遺伝子変異がなかった検体をNGSによるRNA融合遺伝子パネル検査によって再検査した。
DNA遺伝子プロファイリング検査によって21カ月間に患者の2.5%にMETex14スキッピング変異が検出された。一方、ドライバー遺伝子変異陰性の検体をRNA解析にかけたところ、 METex14変異がさらに9個確認され、合計3.9%となった。したがって、DNAパネルでは36%のMETex14変異が検出されなかったことになる。 RNAパネルでしか確認できなかった変異は、イントロン13スプライス受容部位をはじめ、スプライシングに関連する部位にあることが多かった。このような部位はDNAパネルに含まれていなかったが、イントロン14スプライス供与部位は含まれていた。著者らは、スプライス受容部位、分枝部位Aおよびポリピリミジン領域に変異が起こることがあると述べている。このような領域を網羅する特注のDNAパネルによって解析の感度を上げることはできるが、イントロンレベルのさらに詳細な解析が必要であるため、技術的な困難を伴う。
全般的に、DNAパネルを用いたNGSでは、パネルのプライマーがイントロン13の3’スプライス部位とイントロン14の5’スプライス部位の両方を標的としない場合、肺腺がんのMETex14 スキッピング変異を検出できない可能性がある。DNAの検査でドライバー遺伝子変異が検出されない場合、手順を逆行してRNAパネルで融合遺伝子を検索することによって、そのような変異を検出することが可能である。今後の研究では、さらに検討を重ねて、RNAアッセイでのみ検出される変異の組織的、臨床的および分子的な特徴を明らかにすることが必要とされる。
VISION試験:テポチニブ
第II相VISION試験では、 局所進行または転移があるNSCLC患者のうち、 METex14スキッピング変異があり、治療歴があっても二次治療までの患者を対象に、MET-TKI 治療薬テポチニブを1日500㎎投与して、その有効性と忍容性を評価した。この結果に基づいて、日本では2020年3月にテポチニブとコンパニオン診断が承認されている。同試験の患者選択基準を確認する前に、リキッドバイオプシーまたは組織生検によってMET 変異の検出が行われていた。無症候性の脳転移がある患者も登録が認められた。VISION試験の有効性に関する主要評価項目、安全性およびバイオマーカーの結果をLeらが報告した[9]。
ORRが主要評価項目に設定されており、独立判定委員会による判定によれば、リキッドバイオプシー陽性群のORRは48.5%、組織生検陽性群では50.0%、リキッドバイオプシーと組織生検の両方またはいずれかで陽性であった混合群では46.5%であった(表2)。全患者の89%に腫瘍縮小が認められた。混合群では、PFS中央値が8.5カ月、OS中央値が17.1カ月であった。ベースラインで脳転移があった患者(n = 11)の治療成績は、いずれの脳病変も標的ではなかったものの、全患者集団の成績に匹敵するものであり、ORRが54.5%、PFS中央値が10.9カ月であった。
患者の67%では遺伝子レベルのctDNAに奏効がみられた。つまり、 METex14変異のアレル頻度が減少した。このような患者では奏効率が高く、X線所見による奏効率が71%、病勢コントロール率は88%であった。テポチニブの忍容性プロファイルは管理可能なものであった。最も多かった有害事象は末梢浮腫、悪心および下痢であった。グレード3以上の治療関連有害事象が患者の27.6%にみられた。投与量の減量が必要となった患者は32.9%、治療中止は11.2%であった。
著者らは結論として、リキッドバイオプシーまたは組織生検で確認できるMETex14スキッピング変異を有するNSCLC患者に対して、テポチニブは持続的な臨床効果を示す有望な標的治療薬であるとした。
VISION試験のQOLデータ
ASCO年次総会では、VISION試験の健康関連QOLに関する結果が別途に発表された[10]。健康関連QOLのアウトカムは視覚的アナログスケール(VAS)のほか、EORTC QLQ-LC13、EORTC QLQ- C30およびEQ-5D-5Lの各質問表を用いて評価された。試験登録時、患者のほぼ全員に転移があり、他の治療介入が可能な遺伝子変異を有する患者よりも年齢が高かった(年齢中央値74.0歳)。患者の大半は全身状態がECOG PS 1であった。ベースラインのスコアから、全身機能状態およびQOLは中等度から高度、肺がん症状による負担感は中等度であることが示された。
QLQ-LC13による症状の評価では、ベースラインからの平均変化量によれば、咳嗽には有意義な改善があり、呼吸困難および胸痛には数値的な改善があったことが示された。QLQ-C30による全般的な健康感と全身機能に関するスコアおよびEQ-5D-5LによるVASスコアの平均変化量から、時間の経過に伴ってQOLが安定したことが実証された。以上のような所見は、VISION試験の有効性と安全性に関する結果とともに、METex14スキッピング変異があるNSCLC患者に対してテポチニブが有望な治療選択肢となることを裏付けている。
サボリチニブの安定した効果
中国の多施設共同単群の第II相試験では、METex14スキッピング変異陽性の切除不能または転移性の肺肉腫様がん患者(PSC、n = 25)およびNSCLCのその他のタイプの患者(n = 45)を対象に、高度選択性の経口MET-TKI サボリチニブを評価した[11]。対象とした患者は化学療法が不適(unfit)であったか、化学療法を受けても無効であった。PSCはNSCLCのなかでも稀なタイプあり、化学療法に抵抗性であることが多いうえに、臨床的に特に進行が早く予後不良である。サボリチニブは体重により用量調製して処方され、1日用量を50㎏以上の患者は600㎎、50㎏未満の患者は400㎎とした。
有効性の評価が可能であった対象では、サボリチニブは安定で持続的な効果を示し、ORRが49.2%であった。奏効期間の中央値は9.6カ月になった。PFS中央値は6.9カ月であった。PSC患者はNSCLCのその他のタイプの患者よりもPFSが短かった(前者 5.5カ月、後者 9.7カ月)。また、PFSは既治療群(13.8カ月)のほうが未治療コホート(5.6カ月)よりも長かったものの、これは未治療コホートのほぼ半数がPSCであったことを反映している。OS中央値は14.0カ月であった。
治療関連の重篤な有害事象として肝機能障害、薬物過敏症、発熱などが患者の25.7%に認められた。腫瘍崩壊症候群によって患者1人が死亡した。有害事象により治療中止に至ったのは14.3%であった。全体として、サボリチニブには抗腫瘍効果と許容範囲内の忍容性が期待されることが実証された。
MET遺伝子エクソン14変異陽性の早期肺がんの特徴
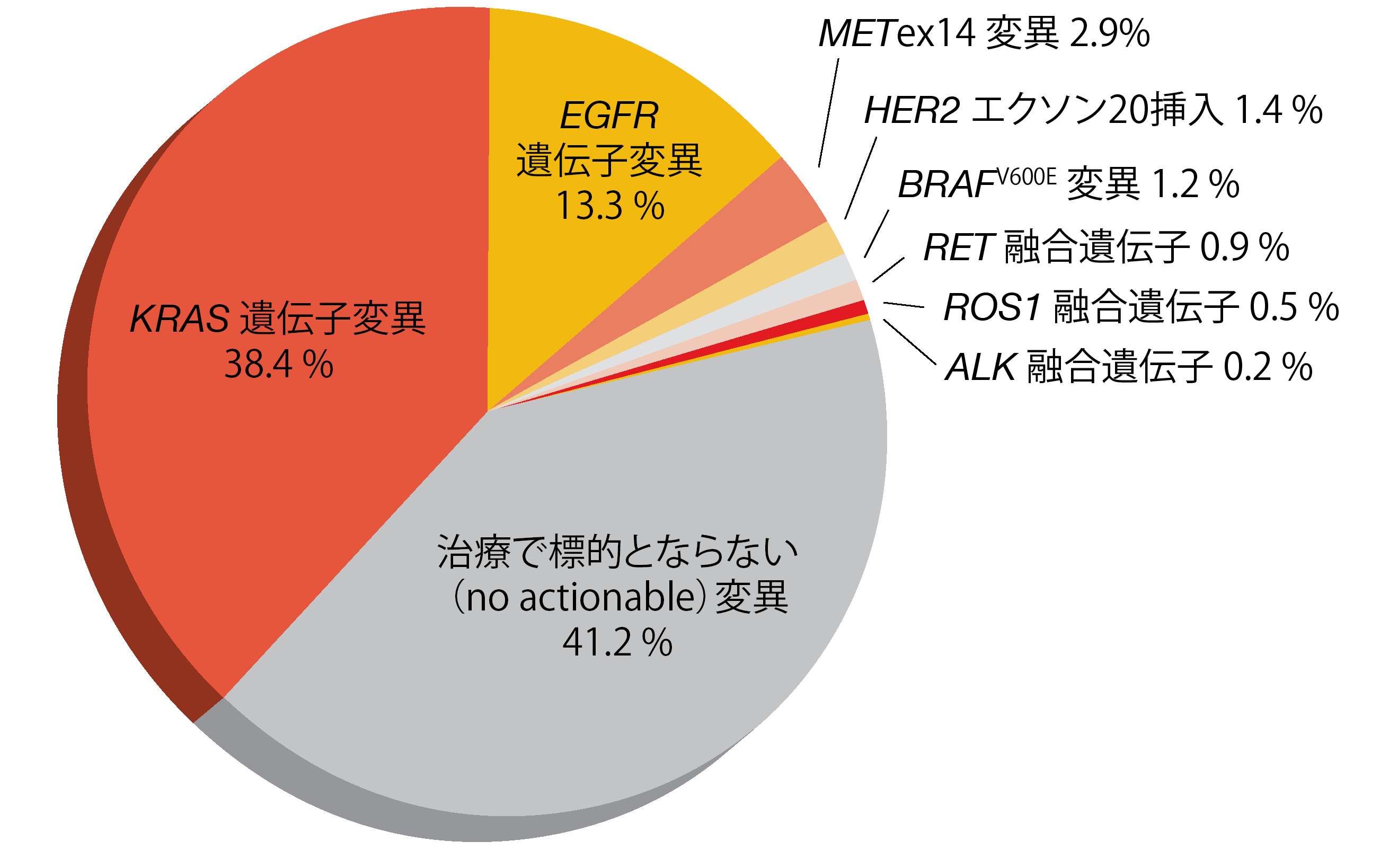
転移したがんでは、METex14変異陽性NSCLCの臨床的特徴およびゲノムの特徴が明らかにされている一方、早期がんでのこのサブタイプについてはそれほど知られていない。このため、Recondoらは、切除後のI期~III期NSCLC患者613人を対象コホートとして、METex14変異陽性肺がんのさまざまな特徴を後ろ向きに評価するとともに、IV期肺がんの特徴と比較した[12]。この患者群 のMETex14変異の発生率は2.8%であった。そのなかでも、非扁平上皮型(2.9%、図2)のほうが扁平上皮型(1.4%)よりも頻度が高かった。
ゲノム変異の同時発生に関しては、IV期よりもI期~III期のNSCLCほうが MET 増幅、TP53 変異およびCDKN2A/B 欠失の同時発生率が有意に低かった。MDM2 およびCDK4/6 の増幅に関する差は有意ではなかったものの、KRAS 変異/増幅およびEGFR 変異/増幅はIV期の腫瘍にのみ発生していた。I期およびII期では、腫瘍細胞のPD-L1陽性率(TPS)が50%以上のPD-L1高発現がみられる頻度は低い(I期 13.5%、Ii期 14.3%)のに対し、III期では大幅に高かった(36.0%)。しかしそれも、IV期で観察されたPD-L1高発現(TPSが50%以上)の頻度よりもまだ低かった。
臨床アウトカムに関しては、解析によれば、II期またはIII期の患者の約46%が根治を目的とした切除術後に再発していたことがわかった。このII期またはIII期の患者群では、術後の無病生存期間(DFS)の中央値がそれぞれ2.6年および2.1年にとどまった。一方、I期の患者のDFSは8.3年(p = 0.017)であった。試験担当医師らは、この患者集団を対象に術前および術後の補助療法としてのMET標的治療薬の役割を検討する臨床試験が必要であろうと強調した。
図2:切除後のI期~III期非扁平上皮NSCLCでの遺伝子変異サブタイプの内訳
参考文献
- Drilon A et al., Targeting MET in lung cancer: will expectations finally be MET? J Thorac Oncol 2017; 12: 15-26
- Tong JH et al., MET amplification and exon 14 splice site mutation define unique molecular subgroups of non-small cell lung carcinoma with poor prognosis. Clin Cancer Res 2016; 22: 3048-3056
- Wolf J et al., Capmatinib (INC280) in METΔex14-mutated advanced non-small cell lung cancer (NSCLC): Efficacy data from the phase II GEOMETRY mono-1 study. J Clin Oncol 37, 2019 (suppl; abstr 9004)
- Wolf J et al., Capmatinib in patients with high-level MET-amplified advanced non-small cell lung cancer (NSCLC): results from the phase 2 GEOMETRY mono-1 study. J Clin Oncol 38: 2020 (suppl; abstr 9509)
- Groen HJM et al., Capmatinib in patients with METex14-mutated or high-level MET-amplified advanced non-small-cell lung cancer (NSCLC): results from cohort 6 of the phase 2 GEOMETRY mono-1 study. J Clin Oncol 38: 2020 (suppl; abstr 9520)
- Camidge DR et al., Safety and preliminary clinical activity of the MET antibody mixture Sym015 in advanced non-small cell lung cancer (NSCLC) patients with MET amplification/exon 14 deletion (METAmp/Ex14Δ). J Clin Oncol 38: 2020 (suppl; abstr 9510)
- Awad M et al., Characterization of 1,387 NSCLCs with MET exon 14 (METex14) skipping alterations (SA) and potential acquired resistance (AR) mechanisms. J Clin Oncol 38: 2020 (suppl; abstr 9511)
- Jurkiewicz M et al., Efficacy of DNA vs. RNA NGS based methods in MET Exon 14 skipping mutation detection. J Clin Oncol 38: 2020 (suppl; abstr 9036)
- Le X et al., Primary efficacy and biomarker analyses from the VISION study of tepotinib in patients with NSCLC with MET exon 14 skipping. J Clin Oncol 38: 2020 (suppl; abstr 9556
- Paik PK et al., Tepotinib in NSCLC patients with MET exon 14 skipping: health-related quality of life. J Clin Oncol 38: 2020 (suppl; abstr 9575)
- Lu S et al., Phase II study of savolitinib in patients with pulmonary sarcomatoid carcinoma and other types of non-small cell lung cancer harboring MET exon 14 skipping mutations.
J Clin Oncol 38: 2020 (suppl; abstr 9519) - Recondo G et al., Clinical characteristics, genomic features, and recurrence risk of early-stage MET exon 14 mutant non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9042)
© 2019 Springer-Verlag GmbH, Impressum
More posts
まれな遺伝子変異:HER2、RET、ALK、BRAF
まれな遺伝子変異:HER2、RET、ALK、BRAF DESTINY-Lung01試験:トラスツズマブ デルクステカン トラスツズマブ デルクステカン(T-D
胸部がん患者にみられるCOVID-19:TERAVOLT
胸部がん患者にみられるCOVID-19:TERAVOLT 国際共同研究であるTERAVOLTは、新型コロナウイルス感染症(COVID-19)を発症した胸部悪性
抗血管新生療法の現状と今後の展望
抗血管新生療法の現状と今後の展望 経口トリプルアンジオキナーゼ阻害薬のニンテダニブは、化学療法による一次治療後の進行肺腺がんに対するドセタキセルとの併用療法と
早期がんの転帰を改善するための(術前)術後補助療法による戦略
早期がんの転帰を改善するための(術前)術後補助療法による戦略 NSCLC患者の約30%には、診断時に切除可能な病変が認められる [1-3]。早期NSCLCの主
EGFR遺伝子変異陽性がん:エクソン20挿入陽性の肺がんに対する早期併用療法と新たな治療法
EGFR遺伝子変異陽性がん:エクソン20挿入陽性の肺がんに対する早期併用療法と新たな治療法 少数転移に対する初期の放射線療法とTKIの併用 少数転移がんとは、
免疫チェックポイント阻害:包括的な利点はあるが、リスクがないわけではない
免疫チェックポイント阻害:包括的な利点はあるが、リスクがないわけではない CheckMate 227試験の3年間の結果 第III相ランダム化比較試験のChec