抗血管新生療法の現状と今後の展望
経口トリプルアンジオキナーゼ阻害薬のニンテダニブは、化学療法による一次治療後の進行肺腺がんに対するドセタキセルとの併用療法として、欧州連合(EU)をはじめとする国々で承認されている。ニンテダニブは、血管内皮増殖因子(VEGF)受容体1~3、血小板由来増殖因子(PDGF)受容体α/β、線維芽細胞増殖因子(FGF)受容体1~3、およびRET融合遺伝子を標的とすることによって作用する[1, 2]。
進行NSCLCの治療が変化していることを考えると、ニンテダニブとドセタキセルの併用による効果は、免疫チェックポイント阻害薬(ICI)による治療歴がある患者に対して特に関心の高いものとなる。この治療法を受けて進行したあとの最適な治療順序はまだ明らかではないが、基礎にある腫瘍の生物学的特徴が治療選択の手引きとなりうる。
血管新生は、VEGFの過剰な放出が免疫抑制性の腫瘍微小環境を作り出すことから、ICI耐性に一役を果たしている [3, 4]。したがって、VEGF、PDGFおよびFGFの阻害をはじめとする抗血管新生戦略が、血管の正常化を助け、免疫細胞が腫瘍に到達する環境を改善できる可能性がある。それによって、いわゆる「血管-免疫原性のスイッチ」で免疫を支持する腫瘍微小環境へとバランスが傾くことになるかもしれない。
ICI治療後のニンテダニブとドセタキセルの併用
ASCO年次総会では、Grohéらが、現在進行中の非介入前向き研究であるVARGADO試験のコホートBに含まれる患者57人の最新の結果を報告した[5]。このコホートでは、局所進行、転移性または局所再発の肺腺がん患者が、一次治療として化学療法、二次治療としてICI治療を受けたあと、ニンテダニブとドセタキセルの併用による治療を受けた。
最新の解析では、ニンテダニブとドセタキセルによる併用の臨床的有用性と管理可能な安全性プロファイルが引き続き示された。三次治療の開始以降、患者に無増悪生存期間中央値6.5カ月、生存期間中央値12.4カ月が観察された。一次治療開始からのOSは34.5カ月であった。20人の患者に治療が奏効し、ORRは50%であった (表)。患者の1人には完全奏効が認められた。患者の65%に治療関連有害事象が発現し、最も多かった有害事象は下痢(全グレード、37%)、口内炎(12%)、白血球減少(11%)であった。ニンテダニブでは26%、ドセタキセルでは19%の患者に少なくとも1回の減量が行われた。治療中に発現した有害事象により、30%の患者が試験治療を中止した。
著者らが指摘するように、上記のデータは、ニンテダニブとドセタキセルの併用を評価したLUME-BioNIs試験のICI治療歴のあるサブグループ解析[6]と、ニンテダニブの患者指名プログラム[7]の以前のデータと一致している。ICIによる治療後に抗血管新生薬を用いる理にかなった治療シークエンスは有望なアプローチであり、さらに検討が必要であると考えられる。
RELAY+試験:ラムシルマブとゲフィチニブの併用療法
前臨床試験および臨床試験では、EGFR 遺伝子変異陽性のNSCLCに対するVEGF経路とEGFR経路の二重阻害による効果が実証されている[8-11]。第III相RELAY試験では、抗VEGFR2抗体のラムシルマブとEGFR-TKIのエルロチニブの併用により、エルロチニブ単剤と比較してPFSが延長した(前者 19.4カ月、後者 12.4カ月、ハザード比 0.59)[12]。日本ではエルロチニブよりもゲフィチニブのほうが広く使用されているため、探索的非盲検RELAY+コホート試験では、治療歴のないEGFR 遺伝子変異陽性のIV期NSCLC患者80人を対象に、ラムシルマブ10mg/kgを2週間ごとに投与し、同時にゲフィチニブ250mgを1日1回投与して評価した[13]。
主要探索目的である1年PFS率は、RELAY試験ではラムシルマブとゲフィチニブ併用レジメン(65%)とラムシルマブとエルロチニブ併用レジメン(71.9%)の間でほぼ同等であった[12]。これはORR(前者 71%、後者 76%)と病勢コントロール率(前者 99%、後者 95%)でも同じであった。さらに、 RELAY+群のEGFR 遺伝子変異サブタイプ別にみると、1年PFS率はほぼ同じであった(L858R変異では63%、エクソン19欠失では67%)。ラムシルマブとゲフィチニブの併用は忍容されることが確認され、安全性プロファイル全体はEGFR 遺伝子変異陽性の転移性NSCLCを対象とする各薬剤の確立された安全性プロファイルと一致していた。
NEJ026試験:ベバシズマブとエルロチニブの併用にOS効果なし
第III相非盲検無ランダム化比較試験のNEJ026試験では、EGFR 遺伝子活性化変異がある、IIIB期/IV期または術後再発の非扁平上皮NSCLC患者を対象に、ベバシズマブとエルロチニブの併用をエルロチニブ単剤と比較検討した。PFSは、ベバシズマブとエルロチニブの併用群で有意に延長していた(併用 16.9カ月、単剤 13.3カ月、ハザード比 0.605、p = 0.016)[10]。しかし、併用戦略の優越性は時間の経過とともに弱くなっていった。この併用療法は、最初の進行後の二次治療の治療期間としたPFS2に関して、わずかな改善を示したに過ぎない(併用 28.6カ月、単剤 24.3カ月、ハザード比 0.773、p = 0.205)[14]。最後に、OSに関しては、エルロチニブにベバシズマブを追加してもそれ以上の効果は得られなかった(併用 50.7カ月、単剤 46.2カ月、ハザード比 1.007)。このレジメンから有意な生存効果が得られたサブグループはなかったようである。以上の観察結果は、ベバシズマブとエルロチニブの併用がエルロチニブ単剤よりも有意なPFSの改善を示した第II相JO25567試験の結果と一致しているが、OSに関しては両群で同等の結果が示された[15]。
著者らは、併用レジメンの有効性が失われたのは、進行後の生存期間が長期であったほか、試験治療終了時に二次治療としてオシメルチニブを開始したことが関係しているのではないかと推測している。本試験の両群で、オシメルチニブはオシメルチニブを使用しない治療よりも優れていた。リキッドバイオプシーを用いた複数の試験によれば、ベバシズマブとエルロチニブの併用は第一世代のEGFR-TKIと同様に、T790M耐性変異を高頻度で誘発した。
メタ解析:抗血管新生薬とエルロチニブの併用とエルロチニブ単剤の比較
Landreらは、EGFR 遺伝子変異陽性の進行NSCLCに対する一次治療で、VEGF阻害薬とエルロチニブの併用をエルロチニブ単剤と比較したランダム化比較試験5件のメタ解析を行った[16]。この解析では、NEJ026試験、ARTEMIS試験、RELAY試験、J025567試験およびStinchcombeらによる米国での試験を対象とした。RELAY試験はエルロチニブに加えてラムシルマブを使って実施されたが、他の試験はいずれもEGFR-TKIと併用する抗血管新生薬としてベバシズマブを用いた。いずれの試験でもPFSが主要評価項目であった。
解析結果によれば、VEGFとEGFRの阻害薬の併用は、エルロチニブ単剤と比較したときのPFSと奏効期間の有意な改善と関連していた。しかし、この戦略の有用性を確認するには、OSの成熟したデータが必要である。さらに結果から、EGFR-TKIに対する耐性の発現を遅らせる可能性が示唆された。ARTEMIS試験では、病勢進行時にT790Mなどの獲得耐性変異を発現していた患者数が、併用群では単剤群よりも少なかったことが示された。RELAY試験でも同じ傾向が観察された。
アンロチニブによるVEGF阻害
TKIのアンロチニブは、VEGFR2やVEGFR3をはじめ複数の受容体チロシンキナーゼを標的とする抗血管新生薬である。アンロチニブは経口投与であるため、静脈内投与のベバシズマブやラムシルマブに比べて利点がある。Huangらは、EGFR 遺伝子変異陽性のIIIB期、IIIC期またはIV期の非扁平上皮NSCLCで未治療の患者を対象に、アンロチニブと経口EGFR-TKIであるイコチニブの併用効果を検討する単群試験を実施した[17]。毒性について患者35人を評価して、そのうち30人を有効性についても評価した。
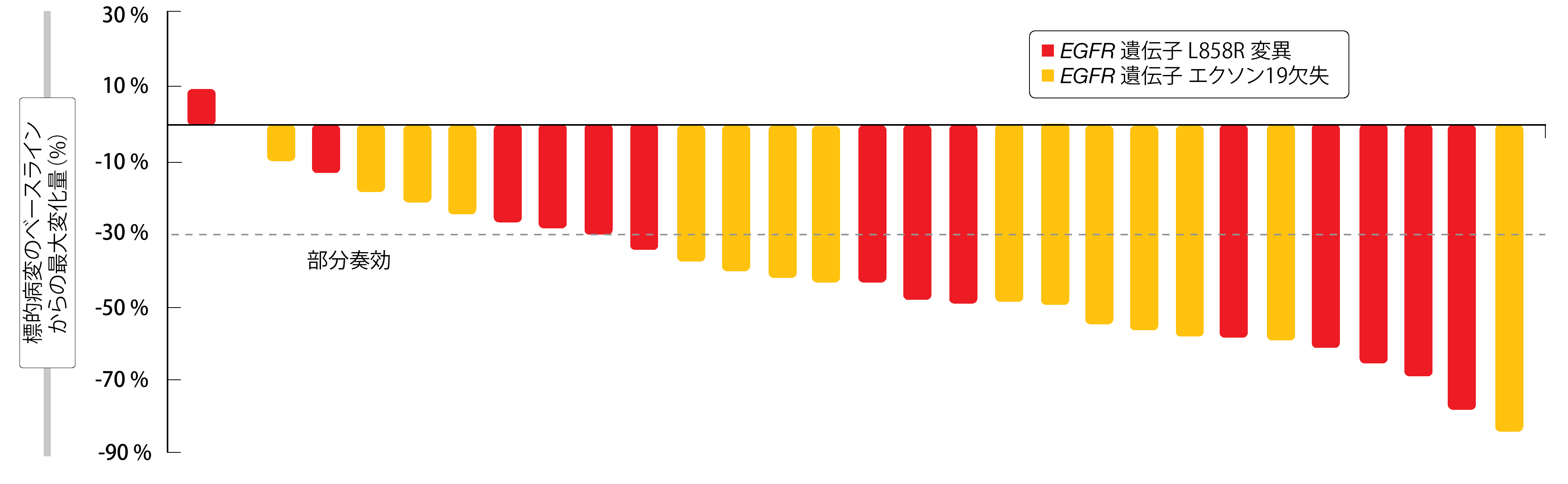
アンロチニブとイコチニブの併用は、一次治療で有望な有効性を示した。全体では21人(70.0%)に奏効が認められ、その全員が部分奏効に達した。部分奏効(PR)が得られたのは、エクソン19欠失がある患者11人(73.3%)およびL858R変異がある患者10人(66.7%、図)であった。患者の96.7%には病勢コントロールが認められ、さらに8人の患者が病勢安定となった。18人の患者では、さらに発がん性ドライバー遺伝子(PIK3CA またはAKT1)および腫瘍抑制因子(TP53、RB1、PTEN )またはそのいずれかの変異も陽性であった。この患者群のORRは83.3%であった。アンロチニブとイコチニブの併用が忍容性に優れており、有害事象は管理可能であることが証明された。最も多かった有害事象は、高コレステロール血症、高トリグリセリド血症、高血圧、下痢、発疹などであった。グレード3の有害事象では、高血圧(17%)と高トリグリセリド血症(6%)が最も多かった。グレード4の有害事象は高トリグリセリド血症のみであった(6%)。今後の評価を進めるにあたってさらに長期の追跡が必要であり、PFSとOSの結果が待たれている。
図:EGFR 遺伝子変異の種類別によるアンロチニブとイコチニブの併用に対する標的病変の反応
VEGF/Ang2阻害薬とチェックポイント阻害薬
抗血管新生療法に基づくもうひとつの可能性のある併用戦略が、免疫療法とVEGF/アンジオポエチン-2(Ang2)阻害薬の併用である。第Ib相試験では、VEGF/Ang2阻害ナノボディ® BI 836880と抗PD-1抗体BI 754091の併用による予備的な抗腫瘍効果が、それぞれ720mgと240mgを3週間に1回の投与量で確立された[18]。局所進行または転移性の非扁平上皮NSCLC患者12人中10人に部分奏効または病勢安定が達成された。そのうち3分の2の患者が試験登録前にすでにICIによる治療を受けていた。ICI治療歴のある患者とICI治療歴のない患者の両方に標的病変の変化が観察された。
この併用療法は管理可能な安全性プロファイルを示した。全グレードの有害事象は高血圧、嘔吐、悪心、無力症であった。グレード4の有害事象はなかった。現在、コホートを拡大しているところであり、今後の結果が期待される。
参考文献:
- Hilberg F et al., BIBF 1120: Triple angiokinase inhibitor with sustained receptor blockade and good antitumor efficacy. Cancer Res 2008; 68(12): 4774-4782
- Hilberg F et al., Triple angiokinase inhibitor nintedanib directly inhibits tumor cell growth and induces tumor shrinkage via blocking oncogenic receptor tyrosine kinases. J Pharmacol Exp Ther 2018; 364(3): 494-503
- Fukumura D et al., Enhancing cancer immunotherapy using antiangiogenics: Opportunities and challenges. Nat Rev Clin Oncol 2018; 15(5): 325-340
- van der Woude LL et al., Migrating into the tumor: A roadmap for T cells. Trends Cancer 2017; 3(11): 797-808
- Grohé C et al., Nintedanib plus docetaxel in lung adenocarcinoma patients following treatment with immune checkpoint inhibitors: updated efficacy and safety results of the ongoing non-interventional study VARGADO (NCT02392455). J Clin Oncol 38: 2020 (suppl; abstr 9604)
- Reck M et al., Nintedanib + docetaxel after immunotherapy in adenocarcinoma non-small cell lung cancer: first results from the non-interventional LUME-BioNIS study. Ann Oncol 2019; 30(Suppl. 11): abstract 180
- Corral J et al., Efficacy of nintedanib and docetaxel in patients with advanced lung adenocarcinoma treated with first-line chemotherapy and second-line immunotherapy in the nintedanib NPU Program. Clin Transl Oncol 2019; 21(9): 1270-1279
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): An open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Ichihara E et al., Phase II trial of gefitinib in combination with bevacizumab as first-line therapy for advanced non-small cell lung cancer with activating EGFR gene mutations: The Okayama Lung Cancer Study Group Trial 1001. J Thorac Oncol 2015; 10(3): 486-491
- Saito H et al., Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): Interim analysis of an open-label, randomised, multicentre, phase 3 Trial. Lancet Oncol 2019; 20(5): 625-635
- Byers LA, Heymach JV, Dual targeting of the vascular endothelial growth factor and epidermal growth factor receptor pathways: Rationale and clinical applications for non-small-cell lung cancer. Clin Lung Cancer 2007; 8(suppl 2): S79-S85
- Nakagawa K et al., Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): A randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(12): 1655-1669
- Nishio M et al., RELAY+: Exploratory study of ramucirumab plus gefitinib in untreated patients with epidermal growth factor receptor (EGFR)-mutated metastatic non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9564)
- Maemondo M et al., NEJ026: final overall survival analysis of bevacizumab plus erlotinib treatment for NSCLC patients harboring activating EGFR mutations. J Clin Oncol 38: 2020 (suppl; abstr 9506)
- Yamamoto N et al. Erlotinib plus bevacizumab (EB) versus erlotinib alone (E) as first-line treatment for advanced EGFR mutation–positive non-squamous non–small-cell lung cancer (NSCLC): Survival follow-up results of JO25567. J Clin Oncol 36, 2018 (suppl; abstr 9007)
- Landre T et al., Angiogenesis inhibitor plus erlotinib versus erlotinib alone as first-line for advanced non-small cell lung cancer harboring EGFR mutation. J Clin Oncol 38: 2020 (suppl; abstr 9569)
- Huang D et al., Study of anlotinib combined with icotinib as the first-line treatment in NSCLC patients harboring activating EGFR mutations (ALTER-L004). J Clin Oncol 38: 2020 (suppl; abstr 9573)
- Girard N et al., Phase Ib study of BI 836880, a VEGF/Ang2-blocking nanobody®, in combination with BI 754091, an anti-PD-1 antibody: initial results in patients with advanced non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9566)
© 2019 Springer-Verlag GmbH, Impressum
More posts
まれな遺伝子変異:HER2、RET、ALK、BRAF
まれな遺伝子変異:HER2、RET、ALK、BRAF DESTINY-Lung01試験:トラスツズマブ デルクステカン トラスツズマブ デルクステカン(T-D
胸部がん患者にみられるCOVID-19:TERAVOLT
胸部がん患者にみられるCOVID-19:TERAVOLT 国際共同研究であるTERAVOLTは、新型コロナウイルス感染症(COVID-19)を発症した胸部悪性
抗血管新生療法の現状と今後の展望
抗血管新生療法の現状と今後の展望 経口トリプルアンジオキナーゼ阻害薬のニンテダニブは、化学療法による一次治療後の進行肺腺がんに対するドセタキセルとの併用療法と
早期がんの転帰を改善するための(術前)術後補助療法による戦略
早期がんの転帰を改善するための(術前)術後補助療法による戦略 NSCLC患者の約30%には、診断時に切除可能な病変が認められる [1-3]。早期NSCLCの主
EGFR遺伝子変異陽性がん:エクソン20挿入陽性の肺がんに対する早期併用療法と新たな治療法
EGFR遺伝子変異陽性がん:エクソン20挿入陽性の肺がんに対する早期併用療法と新たな治療法 少数転移に対する初期の放射線療法とTKIの併用 少数転移がんとは、
免疫チェックポイント阻害:包括的な利点はあるが、リスクがないわけではない
免疫チェックポイント阻害:包括的な利点はあるが、リスクがないわけではない CheckMate 227試験の3年間の結果 第III相ランダム化比較試験のChec