早期肺がん:免疫療法の標準治療
IMpower010:アテゾリズマブのアジュバント投与
プラチナベースの化学療法やEGFR標的薬などの確立された戦略にもかかわらず、早期NSCLC(IB-IIIA期)の完全切除例において、改善されたアジュバント治療に対する高いアンメットニーズがある。そこで、グローバル第III相試験(IMpower010)では、肺葉切除術または肺切除術後に1~4サイクルの化学療法を受けたIB-IIIA期の肺がん患者を対象に、抗PD-L1抗体であるアテゾリズマブ 1,200mgを21日ごとに16サイクル投与し、最善の支持療法(BSC)と比較した。本試験では、EGFR変異とALK再配列は除外基準とはならなかった。この試験の主要評価項目は無病生存期間(DFS)とした。これは、PD-L1腫瘍細胞(TC)≧1%のII-IIIA期集団(n = 476)、全ランダム化II-IIIA期集団(n = 882)、ITT集団(IB-IIIA期; n = 1,005)の3つの主要解析集団において階層的に検証された。
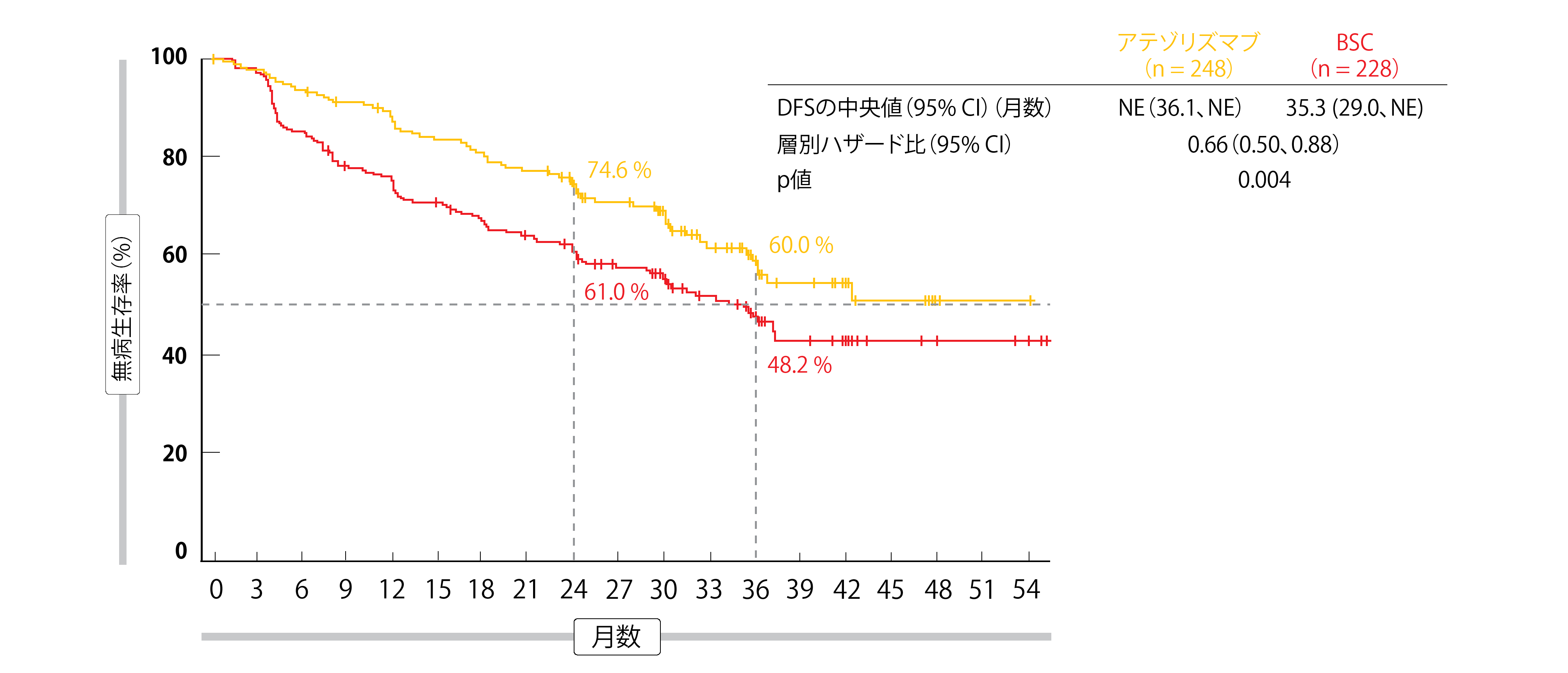
WakeleeらがASCO 2021の年次総会で発表した事前に計画された中間解析によると、アテゾリズマブは PD-L1 TC≧1%のII-IIIA期集団(未到達 対 35.3か月;ド比 0.66;p = 0.004; 図1)と全ランダム化II-IIIA期集団(42.3か月 対 35.3か月; ハザード比 0.79; p = 0.02)の両方で有意なDFSの延長をもたらした。曲線は早くから分離し、両集団ともに分離したままであった。全ランダム化コホートのサブグループ解析では、PD-L1 TCが50%以上、1%以上、1%未満のグループのリスク低減率がそれぞれ57%、34%、3%であったことから、PD-L1の発現に伴ってDFSベネフィットが増加することが示された。IB期の患者を含むITT集団では、DFSは解析時に有意差の境界を越えなかった(未到達 対 37.2か月; ハザード比 0.81)。このグループでの試験は継続される。
全生存期間(OS)データは未熟で、統計計画に従って正式に評価されなかった。しかし、PD-L1発現が1%以上のII-IIIA期集団では、OSが改善する傾向が見られた(ハザード比 0.77)。アテゾリズマブの安全性プロファイルは、適応症や治療ラインを問わず、単剤でのこれまでの使用経験と一致した。IMpower010試験は、プラチナベースの化学療法後のアジュバントNSCLCにおいて、DFSの改善を示した初のがん免疫療法第III相試験である。著者らは、PD-L1 TCが1%以上のII-IIIA期の非小細胞肺がん患者にとって、アテゾリズマブは治療を変えるアジュバント治療の選択肢と考えられると結論付けた。
図1:PD-L1腫瘍細胞が1%以上のII-IIIA期集団における無病生存率に対するアテゾリズマブとBSCの優越性
ネオアジュバントのニボルマブの追加
ランダム化第III相試験であるCheckMate 816試験では、新たに診断された切除可能なIB-IIIA期のNSCLC患者を対象に、ニボルマブ+化学療法のネオアジュバント療法と化学療法単独を検証した。Fordeらは、この併用療法により、忍容性のある安全性プロファイルを維持しながら、主要評価項目である病理学的完全奏効(pCR)の有意な改善が得られることを示した[2]。ASCO 2021では、追加の有効性データと主要な手術成績が報告された[3]。
各群に無作為に割り付けられた179人の患者のうち、最終的な手術を受けたのはニボルマブ投与群の方が多かった(83% 対 75%)。このグループでは、肺切除術を受けた患者が少なく、低侵襲手術が多く用いられた。ベースラインの病期はpCRの改善に影響しなかった。IB/II期では、ニボルマブと化学療法を併用した場合と化学療法を併用した場合の残存生存腫瘍率(中央値)は28%対79%、IIIA期では8%対70%であった。切除の完全性に関しては差がなかったが、R0切除に関しては実験群の方が数値的に有利であった。
ネオアジュバントのニボルマブと化学療法の併用療法は忍容性が高く、PD-1阻害剤の追加によって術後の合併症の発生率は増加しなかった。あらゆるグレードの手術関連有害事象は、41%対47%で認められた。全体として、CheckMate 816試験でこれまでに報告された安全性と手術成績のデータは、pCRの有意な改善とともに、切除可能NSCLC患者に対するネオアジュバントの選択肢としてのニボルマブと化学療法の併用を支持している。本試験では、もう一つの主要評価項目である無イベント生存率と、今後の結果に引き続き注力していく。
EGFR変異NSCLCにおけるゲフィチニブと化学療法の比較
シスプラチンベースのアジュバント化学療法は、II-III期のNSCLCの完全切除を受けた患者に対する標準的な治療法であるが、再発は頻繁に起こる。日本で実施された第III相ランダム化試験であるIMPACT試験では、EGFR-TKIのアジュバント治療がEGFR変異腫瘍患者の転帰を改善するという仮説が検証された[4]。本試験では、II-III期の腫瘍を完全切除した患者を、ゲフィチニブ250mg/日を24カ月間投与する群と、シスプラチン+ビノレルビンを3週間ごとに4サイクル投与する群に無作為に割り付けた。各群には患者116人が参加した。
IMPACT試験は主要評価項目を満たさず、ゲフィチニブは化学療法と比較してDFSを有意に延長しなかった(35.9か月 対 25.0か月; ハザード比 0.92; p = 0.63)。5年時点の無病生存率はゲフィチニブ投与群が31.8%、シスプラチン+ビノレルビン投与群が34.1%であった。しかし、探索的サブグループ解析によると、70歳以上の患者など一部の患者にゲフィチニブが有効であることが示された。OSの解析では、ほとんど重ね合わせたような曲線を描き、差は認められなかった。前述のように、サブグループ解析では、70歳以上のグループでEGFR阻害剤の有効性が示された。
ゲフィチニブのアジュバント治療の毒性は許容範囲内であった。シスプラチン/ビノレルビン投与群ではグレード3/4の好中球減少と白血球減少が頻繁に見られたが、ゲフィチニブ投与群ではこれはごくわずかで、トランスアミナーゼ上昇と発疹が最も多く見られた。シスプラチン/ビノレルビン投与群では、脳梗塞、自殺、肺炎により3名の治療関連死が発生した。著者らが結論づけているように、DFSとOSに関するゲフィチニブのアジュバント治療の明らかな非劣性は、選択された患者、特にシスプラチン/ビノレルビンによるアジュバント化学療法に適さないと判断された患者への使用を正当化できることが示唆される。
5年後も効果が持続:PACIFIC試験
ランダム化二重盲検プラセボ対照第III相試験であるPACIFIC試験は、プラチナ製剤を用いた化学放射線療法で病状が進行しなかった切除不能なIII期NSCLC患者の治療を大きく変えた。このような状況において、抗PD-L1抗体デュルバルマブは、プラセボと比較して、OS(p = 0.00251)およびPFS(p < 0.0001)を有意に改善したため、標準治療として確立された[5, 6]。最後の患者が無作為化されてから約5年後に、探索的な生存分析が行われた[7]。
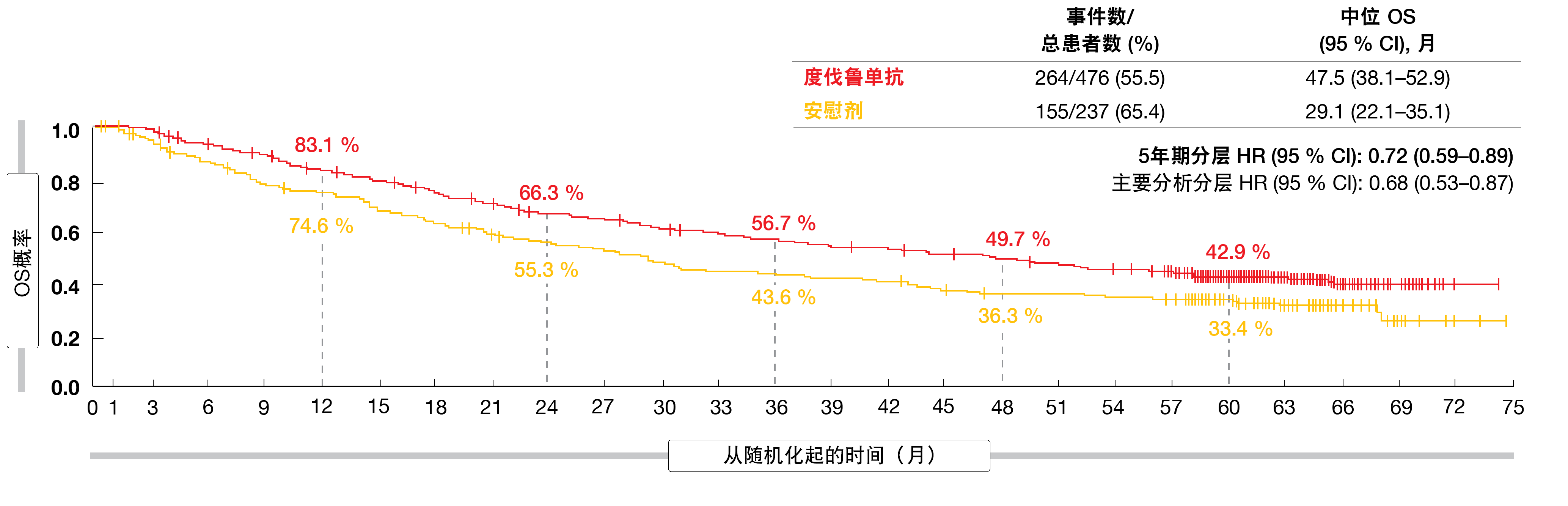
その時点で、無作為化されたすべての患者の追跡調査の中央値は34.2か月であった。その結果、デュルバルマブとプラセボを比較した場合のOSおよびPFSベネフィットは、主要解析結果と一致していた[5, 6]。5年目の時点でも、実験群の患者は死亡リスクが28%減少し、OS率は42.9%対33.4%であった(図2)。5年PFS率は33.1%対19.0%となり、進行や死亡のリスクが45%減少した。同様に、サブグループの更新されたOSおよびPFSは、主要解析時に報告された結果と一致した。
著者らは、これらの知見により、PACIFICレジメンによる強固で持続的なOSベネフィットと持続的なPFSベネフィットが示されたとしている。デュルバルマブを投与した患者の約3分の1が5年後も生存しており、病状の進行も見られなかったことから、この治療法における標準的な治療法の新たな基準が確立された。
図2:PACIFIC試験における長期OSの延長(デュルバルマブ対プラセボ)
早期再発の予測因子としてのctDNA
局所NSCLC患者の残存病変や再発を検出する目的で、循環腫瘍DNA(ctDNA)解析に基づくリキッドバイオプシーが検討されている。最小限の残存病変を評価することで、アジュバント療法が有効な患者を特定できる可能性がある。そこで、Galeらは、治癒を目的として治療を受けたIA-IIIB期のNSCLC患者において、再発時または再発前にctDNAを検出する可能性と転帰を検討するために、個人化シーケンシングアッセイを用いて連続血漿サンプル中のctDNAを評価した[8]。対象となったのは88人で、そのうち78.4%が手術を受け、21.6%が化学放射線療法を受けた。体細胞変異を同定するために腫瘍エクソームシーケンシングを行い、各患者に合わせたctDNAアッセイを開発した。治療前、治療後、3ヶ月目、6ヶ月目、9ヶ月目時点で血漿を採取した。17人の患者については、病状が進行した時点で追加の血漿が採取された。患者は中央値で3年間追跡調査された。
その結果によると、残存するctDNAが早期の再発を予測することが認められた。高感度の患者用血漿シーケンシングアッセイを用いて、再発時または再発前にctDNAをモニタリングすることが可能であることが示された。治療終了後2週間から4カ月後にctDNAの検出が、無再発生存期間 ハザード比 14.8; p < 10-5)およびOS(ハザード比 5.48; p < 0.0003)の短縮と関連していた。進行した患者では、ctDNAの検出が臨床的進行に212.5日(リードタイム中央値)先行していた。
これらの結果は、治癒を目的とした治療後で、臨床症状が進行する何ヶ月も前にctDNAモニタリングによって残存病変を確実に検出することができるという新たな証拠を裏付けるものであり、アジュバント療法が有効な患者を特定する機会を提供するものであると考えられる。
参考文献
- Wakelee HA et al., IMpower010: primary results of a phase 3 global study of atezolizumab vs best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 8500)
- Forde PM et al., Nivolumab + platinum-doublet chemotherapy vs chemo as neoadjuvant treatment for resectable (IB-IIIA) non-small cell lung cancer in the phase 3 CheckMate 816 trial. AACR Annual Meeting 2021, abstract CT003
- Spicer J et al., Surgical outcomes from the phase 3 CheckMate 816 trial: nivolumab + platinum-doublet chemotherapy vs. chemotherapy alone as neoadjuvant treatment for patients with resectable non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 8503)
- Tada H et al., Adjuvant gefitinib versus cisplatin/vinorelbine in Japanese patients with completely resected, EGFR-mutated, stage II-III non-small cell lung cancer (IMPACT. WJOG6410L): a randomized phase 3 trial. J Clin Oncol 39, 2021 (suppl 15; abstr 8501)
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-1929
- Antonia SJ et al., Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC. N Engl J Med 2018; 379(24): 2342-2350
- Spiegel DR et al., Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC – an update from the PACIFIC trial. J Clin Oncol 39, 2021 (suppl 15; abstr 8511)
- Gale D et al., Residual ctDNA after treatment predicts early relapse in patients with early-stage NSCLC. J Clin Oncol 39, 2021 (suppl 15; abstr 8517)
© 2021 Springer-Verlag GmbH, Impressum