KRAS、MET、ROS1、HER2:現在の見解
CodeBreaK100試験:ソトラシブ
肺腺がん患者の約13%は、KRASG12C変異を有している[1]。現在のところ、この発がん性ドライバーを標的とした薬剤は認可されていないが、免疫チェックポイント阻害剤を含むファーストライン治療で進行した後の肺腺がん患者集団の治療成績を改善することが求められている。画期的な不可逆的選択的KRASG12C阻害剤であるソトラシブは、単群第II相試験であるCodeBreaK100試験において、前治療歴のあるKRASG12C変異を有する局所進行性または転移性NSCLC患者において、持続的な臨床効果を示した[2]。本試験では、126人の患者に対し、ソトラシブ960mg/日の経口投与が行われた。参加者の81%は、プラチナベースの化学療法と免疫療法の両方の前治療歴を有した。ASCO 2021では、Skoulidisらが追跡期間中央値15.3か月後の成熟した全生存期間を含む最新の有効性と安全性のデータを発表し、さまざまな患者サブグループでの成果を報告した[3]。
ソトラシブは、OSの中央値が12.5か月、PFSの中央値が6.8か月と、持続的な臨床効果を示した。全体では37.1%の患者が奏効し、4人(3.2%)の患者が完全奏効を達成した。80.6%の患者で病勢がコントロールされ、奏効期間の中央値は11.1か月であった。治療関連有害事象(TRAE)はほとんどがグレード1/2で、概ね管理可能であった。グレード3のTRAEは19.8%の患者に発生した。下痢、吐き気、トランスアミナーゼの上昇が最も多く見られた。投与量の変更と中止はそれぞれ22.2%と7.1%であった。
ソトラシブを用いた治療は、様々な患者サブグループにおいて、広範かつ一貫した臨床効果を示した。ORRおよびOS中央値は、年齢、前治療の回数、前治療の種類などのベースラインの特徴にかかわらず、良好な結果が得られた。特筆すべきは、免疫チェックポイント阻害後、プラチナ製剤を使用した化学療法を受けていない13人の患者において、ソトラシブはORR 69.2%、OS中央値17.7か月を達成したことである。
STK11変異型疾患における活性の向上
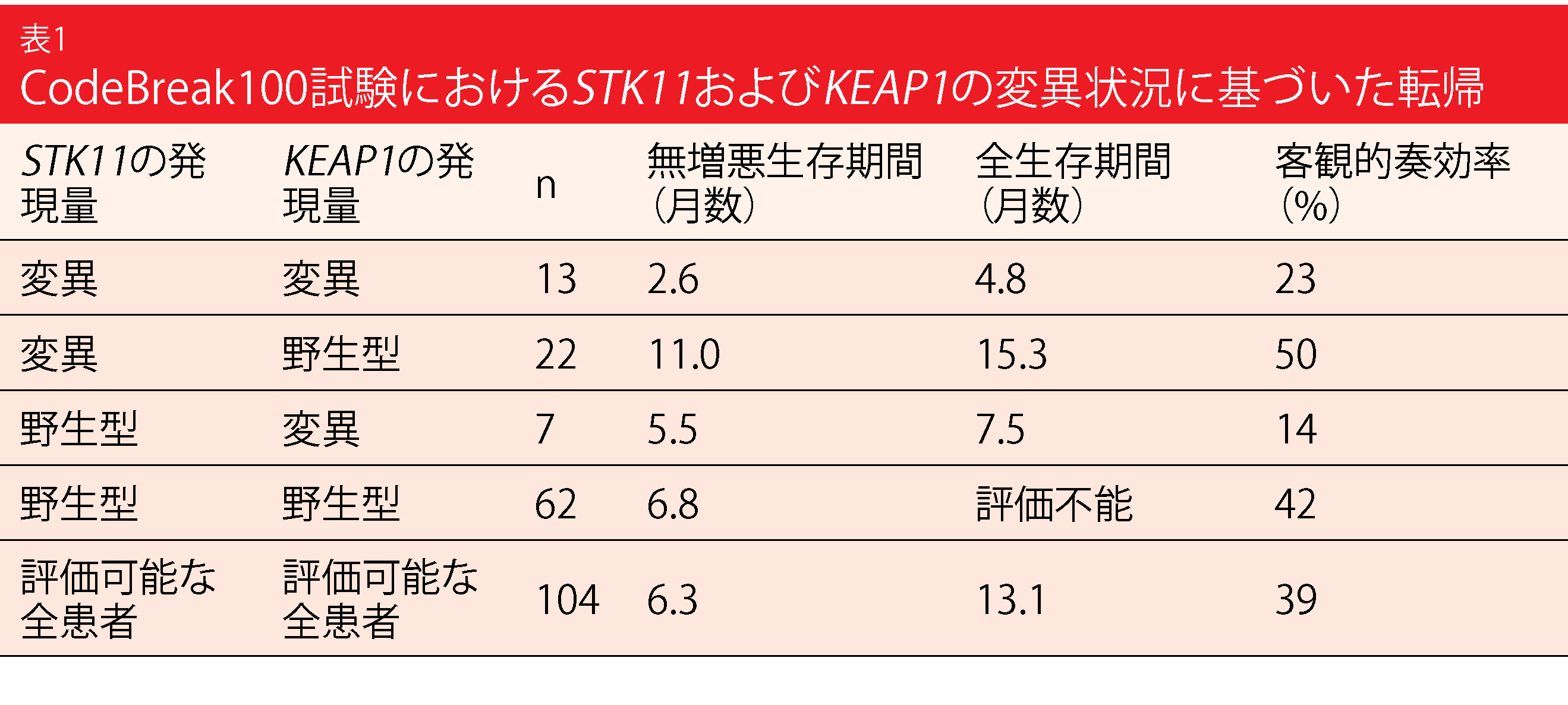
事前指定された探索的解析には、分子的に定義されたサブグループにおけるソトラシブの評価が含まれていた。これらの結果から、ORR達成の可能性はKRASG12C変異対立遺伝子の頻度とは無関係であることが示された。さらに、ORRは、腫瘍の変異負荷が高い患者(≥ 10 mut/mb)と低い患者(< 10 mub/mb)の間で差がなかった。評価項目は、STK11とKEAP1の変異を両方有する場合にも評価された(n=104)。これらの遺伝子の不活性化体細胞変異は、これまで化学療法や免疫療法などの標準的な治療法による患者の転帰の悪化と関連していたため、この結果は臨床的にも重要である。
ここでは、野生型KEAP1を発現したSTK11変異群において、ソトラシブ治療の有効性の向上が認められ、ORRは50%を示し、評価可能な全患者のORR39%を数値的に上回った。このグループのPFSの中央値は11.0か月で、STK11および野生型KEAP1を発現した患者では6.8か月、全コホートでは6.3か月であった(表1)。同様に、STK11変異と野生型KEAP1を有する集団では、OSの中央値が最も長くなった。一方、KEAP1変異群では、ソトラシブ治療の効果があまり得られなかったことが示された。しかし、これらの分析は、探索的な性質を持ち、サンプル数が少ないため、限界がある。現在、KRASG12C変異を有する前治療歴のあるNSCLC患者を対象に、ソトラシブとドセタキセルを比較する第III相CodeBreaK200試験が進行中である(NCT04303780)。
カプマチニブ:GEOMETRY mono-1試験のアップデート
非盲検マルチコホート第II相試験(GEOMETRY mono-1)において、経口投与型の高活性かつ選択的MET阻害剤であるカプマチニブは、IIIB/IV期のNSCLCでMETエクソン14スキッピング変異(METex14)を有する患者において、臨床的に意味のある有効性を示した[4]。カプマチニブは、進行したMETex14陽性のNSCLC患者の治療薬として、いくつかの国で承認されている。GEOMETRY mono-1試験には、MET増幅が認められる患者も登録されており、4つのMETex14コホートが含まれている。コホート5bおよび拡張コホート7には治療歴のない患者が含まれ、コホート4および拡張コホート6では前治療歴のある患者が評価されている。全体で160人の患者が4つのグループに割り付けられた。ASCO 2021では、 Wolfらがコホート7(n = 32)の予備データを報告するとともに、その他の最新の結果も報告した[5]。
解析結果によると、このグループのORRは65.6%で、これは以前に報告されたコホート5bのORR 67.9%と一致した[4]。PFSの中央値はコホート7において10.8か月で、OSの中央値は未到達であった。臨床的に意義のあるOSの結果は、コホート5bの未治療患者とコホート4の前治療歴のある患者で得られ、OSの中央値はそれぞれ20.8か月と13.6か月であった。著者らは、これらの集団においてカプマチニブがもたらす長期的な生存率の向上を強調した。セカンドラインおよびサードライン治療を受けた患者を含むコホート4では、ORRが40.6%であった。セカンドライン治療に限定したコホート6では、ORRは51.6%であった。奏効は早期に認められた。
カプマチニブの管理可能な安全性プロファイルは、長期の追跡調査の後も変化しなかった。治療関連有害事象では、末梢性浮腫と吐き気が最も多かった(いずれかのグレード、それぞれ46.1%と34.3%)。治療関連の致命的な重篤な有害事象が4件発生した(心停止、肝炎、組織性肺炎、肺炎)。結論として、著者らは、これらの最新の結果により、METex14がNSCLCにおいて標的となる発がん性ドライバーであることがさらに認められ、カプマチニブがこの設定において貴重な選択肢であるという証拠が強化されたと述べている。
MET増幅患者に対するテポチニブの投与
NSCLC症例の1~5%に発がん性ドライバーとして存在するMET増幅を有する肺がん患者[6]は、転帰が悪い[7]。この集団に対して、新しい治療法が緊急に必要とされている。経口1日1回投与の高選択的MET阻害剤であるテポチニブは、非盲検多施設共同第II相試験であるVISION試験のコホートAに基づき、METex14による転移性NSCLCの治療薬として日米で承認されている[8, 9]。ASCO 2021では、LeらがコホートBの最初のデータを報告した。このコホートでは、進行NSCLCで、リキッドバイオプシーで検出されたMET増幅を有する患者を対象に、METex14が存在しない場合にテポチニブを評価した[10]。コホートBに登録された患者は、EGFRとALKの野生型を有し、ファーストライン、セカンドライン、サードライン治療を受けていた。先行する免疫療法は認められた。24人の患者にテポチニブ 500mg/日が主にセカンドライン治療として投与された。独立審査委員会によるORRを主要評価項目とした。
リキッドバイオプシーでMET増幅が前向きに検出された進行NSCLCを対象とした初のMET阻害剤試験で、テポチニブは臨床的に意味のある高い活性を示した。全体として、41.7%の患者が治療に反応した。テポチニブをファーストラインで投与された患者は、治療に対する感受性が高いことが示唆された。サブグループ解析の結果、奏効率はファーストライン、セカンドライン、サードラインでそれぞれ71.4%、 30.0%、28.6%であった(表2)。全体では、PFSの中央値は4.2か月、9か月PFS率は40%であった。ファーストライン、セカンドライン、サードラインで9か月PFS率はそれぞれ51%、 58%、推定不能であった。奏効期間の中央値はまだ未熟であったが、9か月目には67%の患者で継続した奏効が認められた。
テポチニブの忍容性は良好で、治療関連有害事象はほとんどが軽度または中等度であった。最も多かった有害事象は末梢性浮腫(グレード不問、37.5%)で、次いで全身性浮腫、便秘であった。グレード3/4の治療関連有害事象は29.2%に発生したが、治療中止には至らなかった。著者らは、MET増幅を有する進行NSCLC患者において、テポチニブをさらに評価する必要があるとしている。
ROS1陽性NSCLC:ブリガチニブの活性
クリゾチニブは、ROS1融合遺伝子陽性のNSCLC患者の治療薬として初めて承認された薬剤である。しかし、クリゾチニブ耐性のROS1陽性疾患に対する標準的な治療法はこれまで導入されていない。単群多施設共同第II相バスケット試験であるBarossa試験では、第二世代のALK/ROS1阻害剤であるブリガチニブを、ROS1融合遺伝子陽性の進行性固形がんを対象に評価した。Dagaらは、9施設においてクリゾチニブ治療を受けた19人のNSCLC患者を対象とした本試験のコホート2の結果を報告した。ORRが主要評価項目として定義された[11]。
このグループでは、ブリガチニブのORRが26.3%、病勢コントロール率が57.9%と中程度の活性を示した。独立評価機関によるPFSの中央値は7.3か月、OSは12.2か月であった。1年後に生存していた患者は57.4%で、無増悪生存率は26.9%であった。下痢、トランスアミナーゼ上昇、アミラーゼ上昇などのブリガチニブの安全性プロファイルは、これまでの研究と同様であった。グレード4/5の有害事象は発現していない。ROS1阻害剤を使用していない患者を対象としたBarossa試験のコホート1の登録は現在進行中である。
HER2を標的としたアプローチ+ドセタキセル
1~2%の症例で発がん性ドライバーとなるHER2異常を持つNSCLC患者には、承認された治療法がほとんどない[12]。Mazieresらが発表した多施設共同単群第II相試験(IFCT-1703 R2D2)の目的は、この環境下で2種類のHER2指向性抗体とドセタキセルの併用療法を前向きに評価することであった[13]。III/IV期のNSCLCでHER2エクソン20挿入または変異を有する前治療歴がある患者46人に、ペルツズマブ 420mgおよびトラスツズマブ 6mg/kgならびにドセタキセル 75mg/m2を3週間ごとにサイクル2から投与した。
主要評価項目である確定ORRは本レジメンで28.9%であった。57.8%が安定状態となった。PFSとOSの中央値はそれぞれ6.8か月と17.6か月で、12か月奏効率はそれぞれ29.0%と68.3%であった。治療関連有害事象は、主に下痢、疲労、貧血、吐き気、口内炎、好中球数の減少などであった。グレード3/4の有害事象では、好中球数の減少が最も多く、次いで下痢が認められた。肺や心臓への毒性は認められなかった。
著者らが結論づけたように、トラスツズマブ、ペルツズマブ、ドセタキセルのトリプレット療法は、前治療歴を有するHER2陽性の進行NSCLCにおいて実行可能かつ有効である。これらの結果は、HER2抗体を用いた治療法が有効であることを示しており、該当する患者に対して考慮されるべきである。
参考文献:
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Li BT et al., CodeBreaK 100: registrational phase 2 trial of sotorasib in KRAS p.G12C mutated non-small cell lung cancer. WCLC 2020, PS01.07
- Skoulidis F et al., Overall survival and exploratory subgroup analyses from the phase 2 CodeBreaK100 trial evaluating sotorasib in pretreated KRAS P.G12C mutated non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9003)
- Wolf J et al., Capmatinib in MET exon 14-mutated or MET-amplified non-small-cell lung cancer. N Engl J Med 2020; 383(10): 944-957
- Wolf J et al., Capmatinib in MET exon 14-mutated, advanced NSCLC: updated results from the GEOMETRY mono-1 study. J Clin Oncol 39, 2021 (suppl 15; abstr 9020)
- Drilon A et al., Targeting MET in lung cancer: will expectations finally be MET? J Thorac Oncol 2017; 12(1):15-26
- Dimou A et al., MET gene copy number predicts worse overall survival in patients with non-small cell lung cancer (NSCLC); a systematic review and meta-analysis. PLos One 2014; 9(9): e107677
- Paik PK et al., Tepotinib in non-small-cell lung cancer with MET exon 14 skipping mutations. N Engl J Med 2020; 383(10): 931-943
- Paik PK et al., Tepotinib in patients with MET exon 14 (METex14) skipping advanced NSCLC: updated efficacy from VISION Cohort A. J Thorac Oncol 2021; 16(3S): S174 (MA11.05)
- Le X et al., Tepotinib in patients with advanced non-small cell lung cancer with MET amplification. J Clin Oncol 39, 2021 (suppl 15; abstr 9021)
- Daga H et al., Phase II study of brigatinib in ROS1-positive non-small cell lung cancer patients previously treated with crizotinib: Barossa cohort 2. J Clin Oncol 39, 2021 (suppl 15; abstr 9040)
- Mazières J et al., Lung cancer patients with HER2 mutations treated with chemotherapy and HER2-targeted drugs: results from the European EUHER2 cohort. Ann Oncol 2016; 27(2): P281-286
- Mazières J et al., Combination of trastuzumab, pertuzumab and docetaxel in patients with advanced non-small cell lung cancer harboring HER2 mutation. Results from the IFCT-1703 R2D2 trial. J Clin Oncol 39, 2021 (suppl 15; abstr 9015)
© 2021 Springer-Verlag GmbH, Impressum