免疫疗法临床应答的确定
在过去13年中,非小细胞肺癌(NSCLC)的治疗发生了翻天覆地的变化。两种新治疗方法(靶向治疗和免疫疗法)的出现推翻了之前医生和患者对NSCLC治疗标准的看法。然而,并非所有NSCLC的驱动致癌基因均得到了鉴别。仍有大量具有未知驱动致癌基因突变的患者无法从目前可用的靶向疗法中获益。此外,对这些靶向疗法的获得性耐药无一例外会发生。
免疫疗法的开发基于免疫系统的三大重要特征:特异性、适应性和记忆性。免疫疗法的概念以通过调节免疫微环境或破坏免疫耐受来消除癌细胞为基础,这与其他常规治疗概念不同。免疫疗法已被用于治疗各种癌症,并且已表现出可显著延长实体瘤患者的无进展生存期(PFS)和总生存率(OS)。在2017年CSCO年会上,NSCLC免疫疗法的主题主要集中于:1、一线和二线免疫疗法;2、确定免疫疗法应答;3、选择合适的生物标志物;以及4、使用免疫疗法的持续时间。
晚期NSCLC的免疫疗法现状:一线和二线治疗
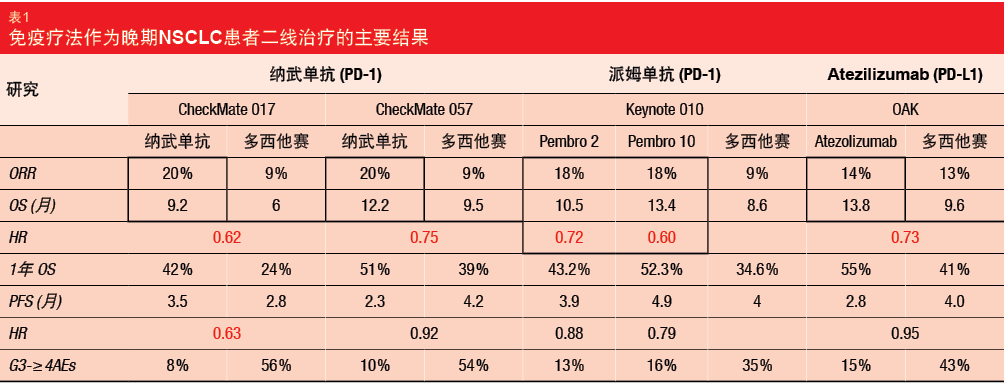
CheckMate 017和CheckMate 057试验对纳武单抗免疫疗法和多西他赛作为一线化疗失败的晚期NSCLC患者的二线治疗进行了比较。在这些研究中,与多西他赛相比,纳武单抗改善了客观缓解率(ORR:20%与9%)和OS(9.2-12.2个月与6.0-9.5个月;CheckMate 017:风险比[HR],
0.62;CheckMate 057:HR,0.75)。此外,免疫疗法的安全性结果也更占优势(3-4级不良事件:8%-10%与54%
-56%)。随后的Keynote 010和OAK研究验证了这些免疫疗法的获益,分别将派姆单抗(pembrolizumab)和atezolizumab与多西他赛在晚期NSCLC患者的治疗中进行了比较,结果具有可比性(即,使用免疫疗法获得改善的ORR和OS;表1)[1]。
免疫疗法作为晚期NSCLC患者的一线治疗也显示出疗效提高。KEYNOTE-024对单一免疫药物派姆单抗与铂类化疗作为PD-L1 ≥ 50%,
EGFR/ALK突变阴性晚期NSCLC的一线治疗进行了比较。其中,使用派姆单抗治疗患者的PFS改善(10.3与6个月;HR,0.50;95% CI,0.37-0.68;p <0.001),预计使用派姆单抗的患者在第6个月时的存活率为80.2%(95% CI,72.9%-85.7%),而使用化疗则为72.4%(95% CI,64.5%-78.9%)。两组均未达到中位OS,但使用派姆单抗相对于化疗的OS显著改善(死亡HR,0.60;95% CI,0.41-0.89;p = 0.005)[2]。
与单独使用化疗相比,免疫疗法联合化疗也表现出患者获益增加。KEYNOTE-021队列G对派姆单抗加化疗与单独使用化疗作为EGFR/ALK突变阴性晚期NSCLC患者的一线治疗进行了比较。联合治疗相对于单独化疗提供了改善的PFS(19.0与8.9个月;HR,0.54;95% CI,0.33-0.88;P =0.0067)和OS(未达到与20.9个月;HR 0.59,95% CI,0.34-1.05;p = 0.0344)[3]。派姆单抗加化疗达到19个月的PFS,这尤为鼓舞人心,因为该PFS高于ECOG 4599研究中血管内皮生长因子抑制剂贝伐珠单抗加化疗的PFS(PFS,12.5个月),而贝伐珠单抗加化疗已在美国成为晚期NSCLC的一线疗法 [4]。事实上,在2017年CSCO年会上,中国上海交通大学附属上海市胸科医院肺部肿瘤临床医学中心的陆舜教授指出,从KEYNOTE-021队列G的数据来看,派姆单抗加化疗已显示出相比贝伐珠单抗加化疗具有优效性。但是,当前结果均基于II期研究。如果KEYNOTE-189 III期研究提供相似结果,则派姆单抗加化疗可能由此取代贝伐珠单抗加化疗成为晚期NSCLC的一线疗法[5]。
联合使用不同免疫药物作为晚期NSCLC患者的一线治疗的研究也获得了有前景的结果。CheckMate 012对纳武单抗联合易普利姆玛与纳武单抗单药作为IIIB或IV期NSCLC患者的一线治疗进行了比较。在总患者人群中,与单独使用纳武单抗相比,联合治疗的ORR更高(43%与23%)。此外,对于联合治疗,PD-L1 ≥ 50%患者的ORR极大地提高到了92%。安全性结果显示,与单独使用纳武单抗相比,联合治疗的任何级别不良事件的发生率均略高,但目前的结果仍可接受[6]。
因此,陆教授得出结论认为,抗PD-L1/PD-1疗法应被考虑作为晚期NSCLC患者的二线治疗。仍需进一步研究来确定免疫疗法是否能成为这些患者的一线治疗[5]。
确定免疫疗法应答:EGFR突变和肿瘤突变负荷
虽然免疫疗法在晚期NSCLC患者治疗中的疗效已得到证明,但这些患者中仅有一部分从抗PD-L1/PD-1疗法中获益。Gainor JF等人[7]指出,EGFR野生型或重度吸烟者可能获益于PD-L/PD-1抑制剂,而EGFR突变患者或从未/轻度吸烟者则不行。CheckMate 057和Keynote 010试验获得了类似结果[8]。
为了确定EGFR野生型和EGFR突变患者的治疗效果为何不同,Gainor JF等人[7]分析了同时存在的PD-L1表达和CD8+肿瘤浸润淋巴细胞(TIL)。在该研究中,仅4.3%的患者显示同时存在的高PD-L1表达(PD-L1+;50%)
和高水平CD8+ TIL(TIL+)。Teng MW等人[9]报道,肿瘤微环境可影响抗PD-L1/PD-1治疗的效果,I型(TIL+/PD-L1+)肿瘤患者最有可能获益于抗PD-L1/PD-1单药疗法。他们还提出,较小比例的EGFR突变NSCLC患者同时存在TIL+/PD-L1+,这可能是在全患者组中观察到免疫疗法预后不良的原因[10]。
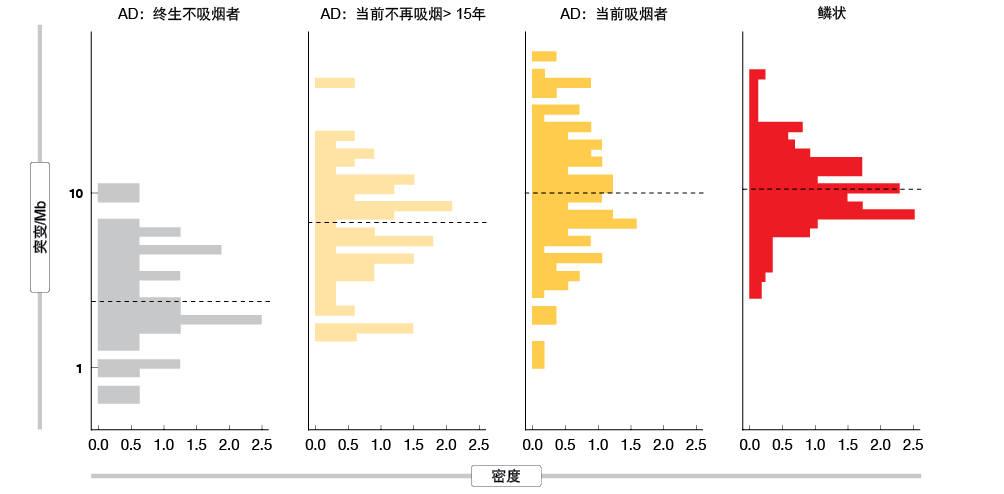
如前所述,肿瘤突变负荷(TMB)也可能是对治疗产生应答的一个因素[11]。Gibbons DL等人[12]对当前吸烟者与终身不吸烟者之间的TMB进行了比较,当前吸烟者的TMB显著更高(图1)。Rizvi NA等人[13]随后报道,高TMB的NSCLC患者可比低TMB的患者获得更长的存活期。因此,他们提出,TIL+/PD-L1+患者的比例较小意味着EGFR突变肿瘤通常对免疫疗法不敏感。此外,吸烟者亚组中的高TMB表明吸烟者相对于不吸烟者对免疫疗法更加敏感。
图1: 当前吸烟者与终生不吸烟者相比,肺腺癌和鳞状细胞癌的肿瘤突变负荷
PD-L1:良好的生物标志物?
PD-L1表达长期以来在临床试验中被用作预后因素或分层因素。然而,新近证据表明,PD-L1可能不是最佳的生物标志物。
CheckMate 012显示,与PD-L1 < 1%的患者相比,PD-L1 ≥ 1%患者的ORR提高2倍至3倍。然而,KEYNOTE-010显示,相比多西他赛,仅PD-L1 ≥ 50%的患者使用派姆单抗会具有更大的OS。当选择1%的PD-L1作为阈值时,使用派姆单抗的PD-L1 ≥ 1%亚组未观察到PFS获益。在CheckMate 026试验中也观察到类似结果,这再次表明,当选择1%的PD-L1作为阈值时,患者可能不会从免疫疗法中获益。因此,在2017年CSCO年会上,来自美国丹佛科罗拉多大学的Fred Hirsch教授表示,肺癌患者治疗指南应将50%的PD-L1表达作为阈值。然而,这些结果均来自II期研究,因此仍需III期研究进行证实[14]。
在CheckMate 026的探索性分析中,TMB的进一步分子特征也被认为是生物标志物,这将患者分为可能从免疫疗法获益的群体与不从免疫疗法获益的群体。在CheckMate 026的亚组分析中,与化疗相比,纳武单抗在高TMB患者中获得的中位PFS明显更高(9.7与5.8个月)。当使用TMB和PD-L1表达的组合作为分层因素时,对于接受纳武单抗治疗的患者来说,与低TMB或PD-L1 < 50%的患者相比,高TMB和PD-L1 ≥ 50%的患者显示出PFS改善。由此,Hirsch教授指出,TMB可能代表了选择可获益于免疫疗法的NSCLC患者的替代生物标志物。然而,仍需进一步研究将PD-L1表达与TMB和/或其他生物标志物的组合作为分层决定因素,以指导临床医生选择NSCLC患者的适当疗法。
免疫疗法的持续时间:连续治疗与治疗中止
CheckMate 153试验在晚期NSCLC患者中对连续纳武单抗与1年固定治疗时间的纳武单抗进行了比较。连续治疗组中患者的PFS(未达到与10.3个月)和6个月PFS率(80%与69%)均较高。与1年固定治疗时间的纳武单抗相比,除PFS改善之外,连续治疗组患者也得到改善的完全/部分缓解(未达到与10.6个月;HR,0.45;95% CI,0.24-0.85)和疾病稳定(未达到与9.6个月;HR,0.44;95% CI,0.17-0.19)。因此,正如陆教授所指出,连续治疗比仅一年的治疗提供改善的结果。但是,连续治疗是否优于2年治疗还有待观察[5]。
参考文献
- Horn L et al., Nivolumab versus Docetaxel in Previously Treated Patients with Advanced
Non–Small-Cell Lung Cancer: Two-Year Outcomes from Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol. 2017;35(35):3924-3933. - Reck M et al., Pembrolizumab versus Chemotherapy for PD-L1–Positive Non–Small-Cell Lung Cancer. N Engl J Med. 2016;375:1823-1833.
- Borghaei H et al., Updated Results from KEYNOTE-021 Cohort G: a Randomized, Phase 2 Study of Pemetrexed and Carboplatin (PC) with or without Pembrolizumab (pembro) as First-Line Therapy for Advanced Nonsquamous NSCLC. Annals of Oncology (2017) 28 (suppl_5): v605-v649. 10.1093/annonc/mdx440
- Tyagi P et al., Bevacizumab, When Added to Paclitaxel/Carboplatin, Prolongs Survival in Previously Untreated Patients with Advanced Non–Small-Cell Lung Cancer: Preliminary Results from the ECOG 4599 Trial. Clin Lung Cancer. 2005;6(5):276-278.
- Lu S et al., Progression of Immunotherapy for LC. CSCO 2017
- Hellman MD et al., Nivolumab plus Ipilimumab as First-Line Treatment for Advanced Non–Small-Cell Lung Cancer (CheckMate 012): Results of an Open-Label, Phase 1, Multicohort Study. The Lancet Oncol. 2017;18(1):31-41.
- Gainor JF et al., EGFR Mutations and ALK Rearrangements Are Associated with Low Response Rates to PD-1 Pathway Blockade in Non–Small Cell Lung Cancer: a Retrospective Analysis. Clin Cancer Res. 2016;22(18):4585-4593.
- Lee CK et al., Checkpoint Inhibitors in Metastatic EGFR-Mutated Non–Small Cell Lung Cancer – a Meta-Analysis. J Thorac Oncol. 2017;12(2):403-407.
- Teng MW et al., Classifying Cancers Based on T-cell Infiltration and PD-L1. Cancer Res. 2015;75(11):2139-2145.
- Gainor JF et al., The Role of Immunotherapy in Oncogene Driven Lung Cancer. CSCO 2017.
- Alexandrov LB et al., Signatures of Mutational Processes in Human Cancer. Nature. 2013;500(7463):415-421.
- Gibbons DL et al., Smoking, p53 Mutation, and Lung Cancer. Mol Cancer Res. 2014;12(1): 3-13.
- Rizvi NA et al., Cancer Immunology. Mutational Landscape Determines Sensitivity to PD-1 Blockade in Non–Small-Cell Lung Cancer. Science. 2015;348(6230):124-128.
- Hirsch FR et al., PD-L1 vs Tumor Mutation Burden and Other Immune Markers. CSCO 2017.
More posts
免疫疗法临床应答的确定
免疫疗法临床应答的确定 在过去13年中,非小细胞肺癌(NSCLC)的治疗发生了翻天覆地的变化。两种新治疗方法(靶向治疗和免疫疗法)的出现推翻了之前医生和患者对NSCLC治疗
ALK突变阳性NSCLC患者治疗新见解
ALK突变阳性NSCLC患者治疗新见解 间变性淋巴瘤激酶(ALK)是一种融合致癌基因,且NSCLC患者中ALK突变的发生率在不同种族间类似。在2017年CSCO年会上,治疗
用于治疗EGFR突变肺癌的最佳策略
用于治疗EGFR突变肺癌的最佳策略 EGFR TKI的出现改变了EGFR突变NSCLC患者的治疗标准。IPASS是在中国EGFR突变NSCLC患者中对第一代EGFR TKI
治疗鳞状细胞癌的不同疗法
治疗鳞状细胞癌的不同疗法 鳞状细胞癌(SqCC)是非小细胞肺癌(NSCLC)的组织病理学亚型之一,并且占到NSCLC患者中的20%至30% [1]。遗憾的是,很少有研究探索
EGFR突变NSCLC的诊断:从指南到现实
EGFR突变NSCLC的诊断:从指南到现实 在过去十年中,对驱动非小细胞肺癌(NSCLC)中肿瘤发生、维持和进展的关键分子和细胞机制的日益了解促进了各种新药物靶点的发现和新
中国NSCLC治疗指南:进展与争议
中国NSCLC治疗指南:进展与争议 肺癌(LC)是全球肿瘤死亡的首要诱因。每年有180万人被诊断出患有LC,并且每年死亡人数达160万。非小细胞肺癌(NSCLC)是最常