EGFR 突变阳性非小细胞肺癌:扩大用于既定治疗方案的数据 池
LUX-Lung 3 和 6 的亚群分析
伴有激活的表皮生长因子受体(EGFR )突变的非小细胞肺癌(NSCLC)代表了肺癌的一个确定的分子亚型,该亚型能够用 EGFR 酪氨酸激酶抑制剂(TKI)疗法进行靶向治疗。埃罗替尼(erlotinib)、吉非替尼(gefitinib)和阿法替尼(afatinib)都已被批准作为 EGFR 突变阳性NSCLC 的一线治疗选择。第一代 TKIs埃罗替尼和吉非替尼通过可逆抑制EGFR 来发挥效用,而第二代 TKI 阿法替尼则通过不可逆抑制更广泛的信号级联来起到 ErbB 家族阻断剂的作用。在一线治疗中使用的阿法替尼,其疗效已被两项 III 期试验 LUX-Lung 3 和6 所证实,这些试验一致显示,与标准的铂类双药化疗相比,使用阿法替尼实现了优异的无进展生存期(PFS)[1, 2]。在具有缺失 19 突变的患者中,总生存期(OS)也得到了显著提高[3]。
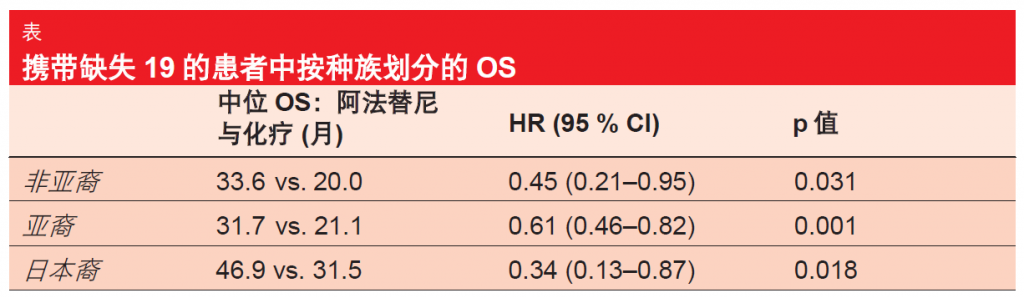
根据 ESMO 亚洲大会上介绍的对于 LUX-Lung 3 和6 试验的亚群分析, OS 结果在亚裔、非亚裔和日本患者间保持一致[4]。在所有种族亚群中,具有缺失 19 突变的患者身上均得到 10至 15 个月的显著 OS 提高(表),而在携带 L858R 突变的患者身上,治疗组之间中位 OS 无显著差异。
同样地,对 LUX-Lung 3 和6 的进一步亚群分析确定了阿法替尼治疗在年龄 ≥ 65 岁患者及一般研究人群中的相似疗效[5]。在 LUX-Lung 3 中,当存 在缺失 19 突变时,老年患者获得了显著 OS 提高(阿法替尼疗法和化学疗法的中位 OS 分别为 41.5 月与 14.3 月;危险比[HR]为 0.39;p=0.0073)。对于 LUX-Lung 6,这些结果也支持阿法替尼(34.1 月与 21.1 月),但显著性没有那么大。不良事件(AE)分布与整体人群相若。基于这些结果,还可以考虑将阿法替尼用于患有晚期EGFR突变阳性 NSCLC 的年龄≥65 岁患者。
LUX-Lung 7:阿法替尼与吉非替尼作为一线用药的对比
迄今为止,一直缺乏为临床决策制定提供指导的一线 TKI 直接比较。全球性的随机化 IIB 期 LUX-Lung 7 试验在患有 IIIB/IV 期肺腺癌并带有EGFR 突 变(缺失 19 及/或 L858R)的初治患者身上对阿法替尼和吉非替尼进行了比较[6]。在包括北美、欧洲、亚洲和澳大利亚在内的 13 个国家的 64 个中心里,参与者们被随机分配施用每日一次 40 mg 阿法替尼(n=160)或每日一次 250 mg 吉非替尼(n=159)。在研究者认为适宜的情况下,允许进行进展后的继续治疗。LUX-Lung 7 有三个协同主要终点:PFS、至治疗失败时间(TTF)和 OS。在 ESMO 2015 年亚洲大会上对该项试验的初步分析作了报告。
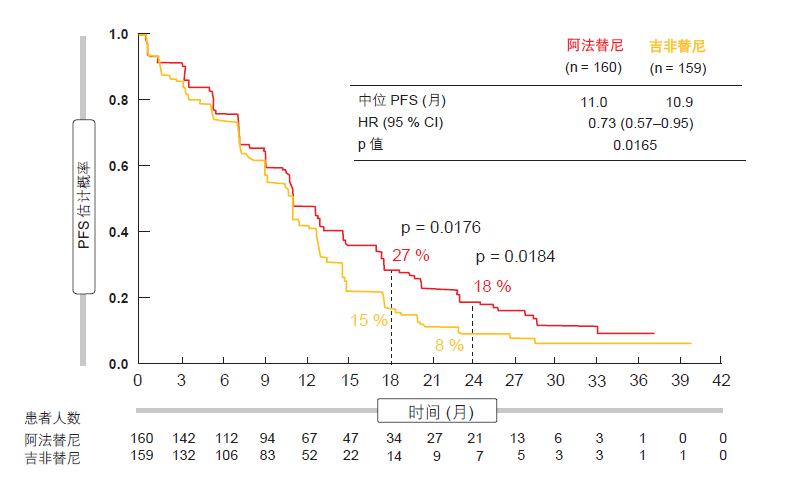
对于关键主要终点 PFS(经独立审查),结果显著支持阿法替尼(中位 PFS 为 11.0 月,相比于 10.9 月;HR 为 0.73;p = 0.0165;图1)。在第18 和 24 个月,两个治疗组之间出现了明显差异。阿法替尼相关 PFS 优势见于各亚群中,并且不受突变类型(缺失 19 突变与 L858R 突变)或其他因素的影响。关于第二协同主要终点TTF,分析显示阿法替尼治疗的患者趋于保持更长时间的治疗(中值 13.7月,相比于 11.5 月;HR 为 0.73;p=0.0073)。这一差异与 PFS 增益相 一致。OS 数据尚不成熟,但有望于2016 年间发布。
图 1: LUX-Lung 7 试验中阿法替尼与吉非替尼相比的 PFS 受益
LUX-Lung 7 中的反应及耐 受性结果
在阿法替尼和吉非替尼治疗组之间,客观反应发生率分别为 70 %和 56 %(p = 0.0083)。并且,反应期中位数在阿法替尼组中比吉非替尼组更长(分别为 10.1 月与 8.4 月)。在带有缺失 19 突变的患者中,阿法替尼疗法在 PFS(HR 为 0.76)、反应率(73 %比 66 %)和肿瘤缩小方面提供了显著受益。然而,这些受益在带有 L858R突变的患者身上甚至更加突出(PFS: HR 为 0.71;反应率为 66 %,相比于42 %)。
同时,试验结果还证实了这些药物的副作用在总体上可控制。AE 是可预测和可控制的,并且在发生率和严重度方面未偏离已知的毒性分布。尽管大多数患者都经历了某种类型的AE,但因 AE 而导致的停药率在两个治疗组中相同且较低,均为 6.3 %。在阿法替尼组中,腹泻是停药的首要原因,其次是疲劳和毒性皮疹。在吉非替尼治疗组中,最常见的停药原因是转氨酶升高和间质性肺病。总体而言,LUX-Lung 7 证实了在EGFR 突变阳性 NSCLC 的治疗中,阿法替尼产生的不可逆 ErbB 阻断作用与吉非替尼产生的可逆 EGFR 抑制作用相比更具优 势。这些研究结果可以用于支持临床实践中在一线 TKI 之间作出治疗决策。
LUX-Lung 8 更新
LUX-Lung 7 在一线条件下,比较了阿法替尼和吉非替尼对于 EGFR 阳性腺癌患者的治疗效果,而全球性、随机化、开放标签的 III 期 LUX-Lung 8 试验独立于突变状态,将阿法替尼与埃罗替尼在患有鳞状细胞癌的二线患者身上进行了比较。据初步分析,阿法替尼相比于埃罗替尼,在 PFS 和 OS方面实现了显著改善[7]。
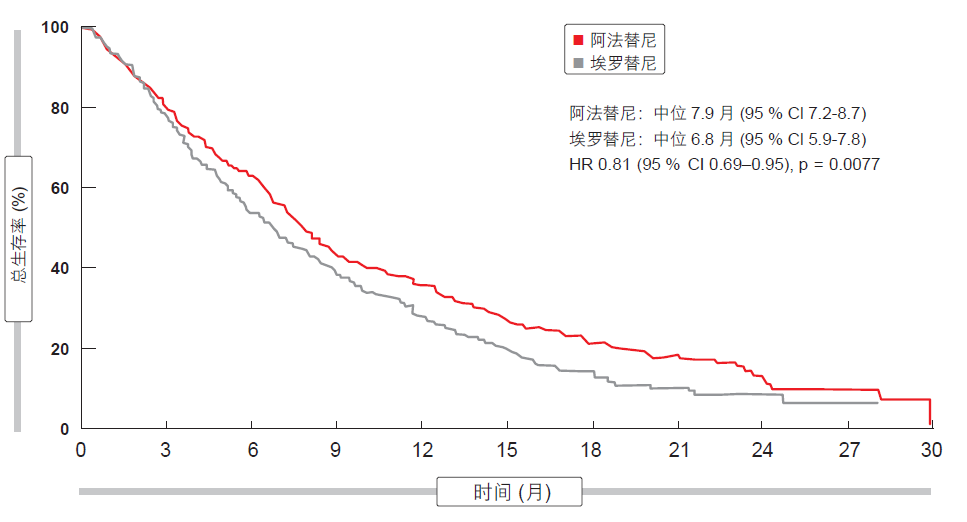
在 ESMO 亚洲大会上,研究人员报告了在 632 例死亡后的初步 OS 分析,以及更新的 PFS 结果和探索性肿瘤遗传学研究结果[8]。与埃罗替尼相比,阿法替尼的 OS 显著提高(中位数为 7.9 月,相比于 6.8 月;HR 为0.81;p=0.0077;图 2)。显著的 PFS优势也得到保持,中位数结果为 2.6 月和 1.9 月(HR 为 0.81;p=0.0103)。分子畸变的发生率与先前由癌症基因组图谱研究网络所观察到的相似。 TP53、LRP1B、MLL2 SVs、SOX2、 KLHL6、PIK3CA 和 MAP3K13 CNAs是最频繁出现的畸变。阿法替尼相关受益见于所有临床亚群和分子亚群。未发现遗传学改变与 OS 或 PFS 之间存在预测性联系。这些数据支持将阿法替尼作为肺鳞状细胞癌患者二线治疗中的首选 TKI。
图 2: LUX-Lung 8 试验中阿法替尼与埃罗替尼相比的 OS 提高
阿法替尼的生物标志物研究发现
吉非替尼和埃罗替尼单药治疗的疗效可通过皮疹的早期发展情况予以预测。为确定这一关系是否也适用于阿法替尼治疗,Bessho 等对在 2009 至2015 年间接受阿法替尼单药治疗的 49例患有EGFR 突变 NSCLC 的连续患者进行了回顾性评价[9]。百分之十的患者在第一周内出现≥2 级的皮疹。多因素分析揭示出随着≥2 级的早期皮疹出现,反应增加的趋势(p=0.071)。
研究暗示了循环游离 DN A (cfDNA)对于检测和监视 EGFR 突变的作用。Iwama 等人通过评估来自35 例阿法替尼治疗患者的肿瘤样本和血样,提供了阿法替尼的前瞻性数据;目的在于研究非侵入性液体活检 的实用性[10]。研究用样品取自治疗前、治疗中和治疗后。
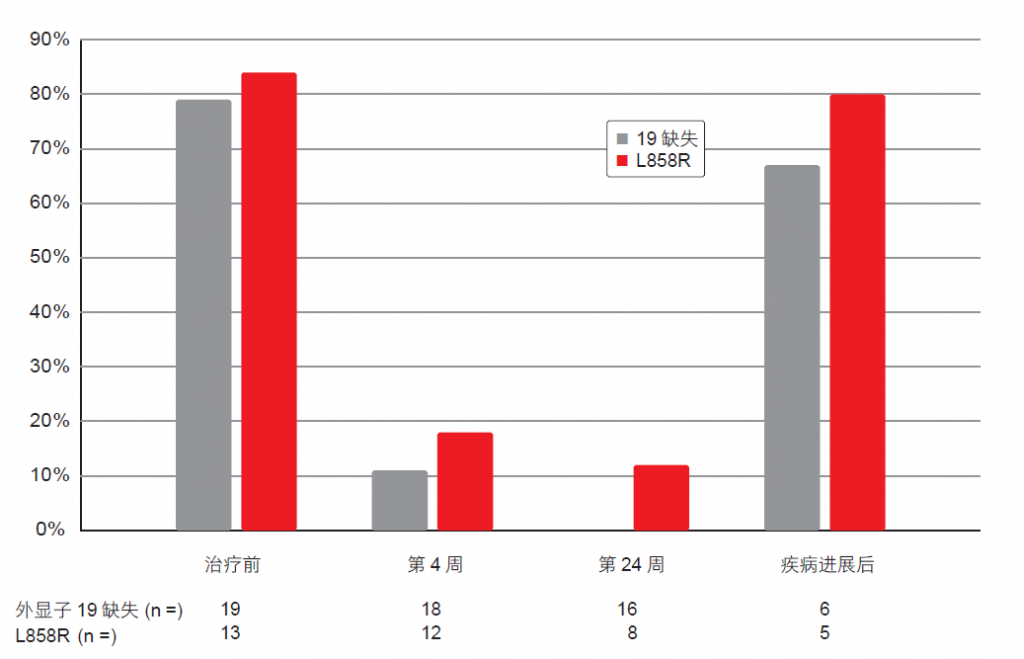
治疗的反应率为 77.1 %。疾病控制率实现 88.6 %,但在分析时尚未达到中位 PFS。在阿法替尼给药前, cfDNA 中活性突变检出率较高,使用蝎型探 针扩增 阻滞 突变系(S c or p i onA RM S)的检出率为59.4 %,数字聚合酶链反应的检出率为81.3 %,下一代测序的检出率为75.0 %。在开始治疗之后直到第四周, cfDNA 中 L858R 阳性等位基因的浓度急剧下降,并继而在病情不再发展的患者体内保持较低水平。外显子 19 缺失阳性等位基因的浓度情况也是如此。总体而言,在治疗前和进展后的 cfDNA 中活性突变检出程度远高于治疗期间(图 3)。因此,活性突变的量变反映出临床病程。
图 3: 在使用阿法替尼治疗前、治疗中和治疗后 cfDNA 中活性突变检出率差异
在特定情况下埃罗替尼联合贝 伐单抗
对于具有某些临床因素的患者,抗EGFR TKI 单药治疗可能不够充分。一种改善治疗功效的潜在策略是联合使用抗血管内皮生长因子剂。开放标签、随机化、多中心的 II 期 JO25567试验证明,在患有非鳞状 EGFR 突变阳性 IIIB/IV 期 NSCLC 的初次化疗患者身上,与单独使用埃罗替尼相比,埃罗替尼加贝伐单抗显示出 PFS 优势[11]。对于全组病例,埃罗替尼加贝伐
单抗与埃罗替尼单药治疗的中位 PFS分别为 16.0 月和 9.7 月(HR 为 0.54;p=0.0015)。
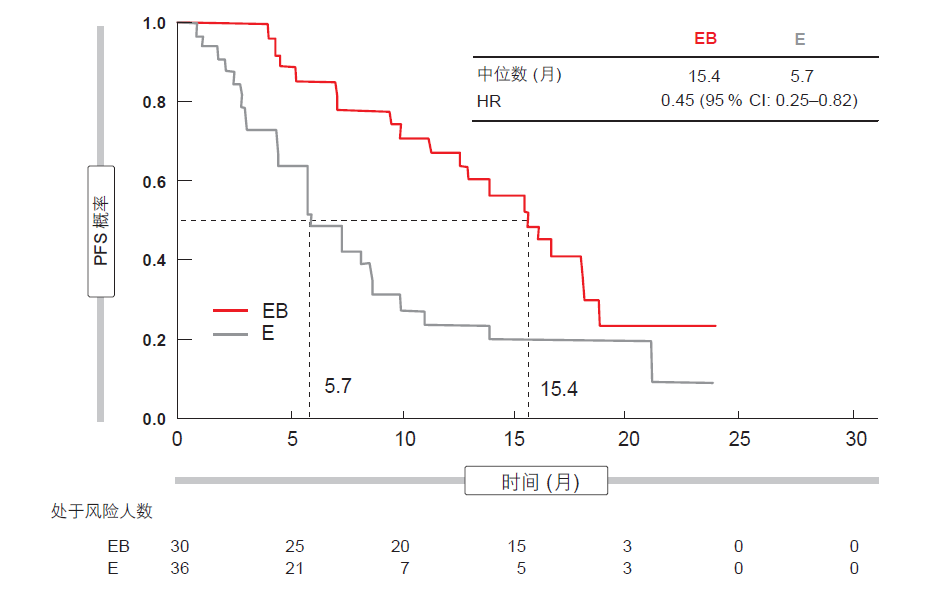
在 ESMO 亚洲大会上介绍的JO25567 试验亚群分析显示,无论患者特征如何,埃罗替尼联合贝伐单抗都会产生一致的受益[12]。与此同时,某些因素似乎与单药治疗组中较短的PFS 相关联,对于基线胸腔和/或心包积液(PCE)患者情况尤为如此。在患有 PCE 的患者中,接受单一埃罗替尼治疗病人的中位 PFC 仅为 5.7 月,相比之下,联合治疗组的这一数据为15.4 月(HR 为 0.45;图 4)。而在无PCE 的患者中,这种差异要小得多(埃罗替尼加贝伐单抗疗法与单一埃罗替尼疗法的中位 PFS 分别为 16.4 月和 11.1 月;HR 为 0.62)。
不论是否存在 PCE,在联合治疗组中的客观反应率都约为 70 %。另一方面,在单药治疗组中,具有 PCE 的患者的反应率(56 %)低于无 PCE 患者(71 %)。基线 PCE 的进展在单药治疗组中的发生率(30.6 %)比联合治疗组(16.7%)更高,这表明添加贝伐单抗能够改善控制。不论是否存在基线 PCE,都没有观察到新的安全性信号。
图 4: 在具有胸腔和/或心包积液的患者中,使用埃罗替尼加贝伐单抗相比单独使用埃罗替尼明显降低疾病进展和死亡风险
参考文献
- Sequist LV et al., Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327-3334
- Wu YL et al., Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non–small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15: 213-222
- Yang JC et al., Afatinib versus cisplatin-based chemotherapy for EGFR-mutation-positive lung adenocarcinoma (LUX-Lung 3 and LUX-Lung 6): analysis of overall survival data from two randomised, phase 3 trials. Lancet Oncol 2015; 16: 141-151
- Wu YL et al., Overall survival with afatinib versus chemotherapy in patients with NSCLC harbouring common EGFR mutations: subgroup analyses by race/ ethnicity in LUX-Lung 3 and LUX-Lung 6. ESMO Asia 2015, abstract 445P
- Wu YL et al., Afatinib versus chemotherapy for EGFR mutation-positive NSCLC patients aged ≥ 65 years: subgroup analyses of LUX-Lung 3 and LUX-Lung 6. ESMO Asia 2015, abstract 446P
- Park K et al., Afatinib versus gefitinib as first-line treatment for patients with advanced non-small cell lung cancer harbouring activating EGFR mutations: LUX-Lung 7. ESMO Asia 2015, abstract LBA2_PR
- Soria J-C et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16: 897-907
- Park K et al., Phase III trial of afatinib versus erlotinib in patients with squamous cell carcinoma of the lung (LUX-Lung 8): EGFR molecular aberrations and survival outcomes. ESMO Asia 2015, abstract 443P
- Bessho A et al., Development of skin rash within the first week is a potential surrogate marker of effect in afatinib for EGFR mutant NSCLC: Okayama Lung Cancer Study Group experience. ESMO Asia 2015, abstract 453P
- Iwama O et al., A multicentre prospective biomarker study in afatinib-treated patients with EGFR-mutation-positive non–small-cell lung cancer. ESMO Asia 2015, abstract 484PD
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non–small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Hosomi Y et al., Erlotinib plus bevacizumab versus erlotinib alone as first-line treatment for advanced non-squamous non-small-cell lung cancer with activating EGFR mutation: JO25567 exploratory subgroup analysis. ESMO Asia 2015, abstract 420O