SCLC:基因组改变为靶向方法铺平道路
转移性疾病的快速生长和早期发展是小细胞肺癌(SCLC)的特征,而小细胞肺癌占到所有肺癌病例的大约15 %[1]。局限期疾病有可能通过放化疗获得治愈。然而,68 %的患者存在广泛期 SCLC(ES-SCLC)。虽然观察到对铂基化疗和放疗的高初始反应,但通常会发生化疗难治性疾病复发。
目前,缺乏对复发性 SCLC 的有效疗法是肺癌患者治疗中未得到解决的最大需求之一。几乎所有 SCLC 病例均可归因于吸烟,这暗示了这些病例的突变情况,并从而对某些治疗的潜在使用具有意义。
SCLC 患者的基因组谱分析
Ali 等人使用综合基因组谱分析方法考察了 883 名 SCLC 患者[2]。重要的是,鉴定了所有类型的基因组改变(即,碱基对取代、插入/缺失、拷贝数改变、重排)。这项研究描述SCLC 患者在临床护理过程中的基因组谱,是迄今为止规模最大的同类研究。
这些结果表明,SCLC 中存在频繁的基因组改变。包括 MYCL1 融合在内的基因组改变与已发表文献中的情况一致。最常见发生改变的基因是TP53(90 %)、RB1(69 %)、MLL2 (12.0 % )、LRP1B (10.9 % )、 PTEN(8.5 %)、MYCL1(8.0 %)、 RICTOR ( 6.5 % )和 MYC (6.1 %)。局灶扩增频繁发生,包括8 号染色体上的 RICTOR/FGF10 和 1号染色体上的 MYCL1 。在 68 名(7.8 %)患者中发现 MYCL1 扩增。7名患者携带 MYCL1 融合,其中 5 名同时具有 MYCL1 扩增。
这些患者中包括一名从不吸烟者的独特指标病例,其肿瘤携带 JAZF1- MYCL1 但不具有 MYCL1 扩增。当利用处于研究阶段的极光 A 激酶抑制剂alisertib(MLN8237)治疗时,该患者体验到超过 18 个月的持久完全缓解,以及对纳武单抗(nivolumab)的持久部分反应。这种情况的生物学意义在于 JAZF1-MYCL1 可能使功能性MYCL1 表达异位稳定,从而超激活下游靶标极光激酶,以及超抑制下游靶标 PD-L1。MYCL1 扩增可能代表下游活性较不明显的升高,但其仍然带来针对极光激酶抑制剂和 PD-1 抑制剂的敏感性。因此,一些患者,特别是携带 MYCL1 扩增的患者,可能从极光激酶抑制剂和免疫治疗药物的组合中获益。
据计算,SCLC 中的肿瘤突变负荷(TMB)为 9.9 突变/兆碱基。相比之下,黑色素瘤的 TMB 为 12.6 突变/兆碱基,而在其它肿瘤中 TMB 则较低。假设 TMB 与 PD-1/PD-L1 抑制剂的疗效相关,TMB 在 SCLC 中的分布表明与 NSCLC 中的免疫治疗相似的反应。
极光 A激酶抑制联合紫杉醇
极光 A 激酶(AAK)是有丝分裂的关键调节子。它可以在一系列实体瘤和血液系统恶性肿瘤中过度表达或扩增。对 AAK 的抑制导致有丝分裂中断和细胞死亡,从而使得 AAK 成为抗癌治疗的潜在靶标。AAK 抑制剂似乎在 SCLC 细胞系中有效,特别是在具有 Myc 扩增和/或高表达的细胞系中有效[3,4],而 Myc 是许多癌症中的主要致癌驱动基因。过度表达的 Myc扩增发生在 18 %至 31 %的 SCLC中,并且在化疗难治性疾病中更加常见[3]。
在一项随机化 II 期研究中,将处于研究阶段的口服选择性小分子 AAK 抑制剂 alisertib 与紫杉醇组合进行测试[5]。之前已经接受一种铂基化疗方案治疗,并且在完成治疗后未满 180天内遭遇复发的 SCLC 患者参与这项研究。对照组的患者接受安慰剂加紫杉醇。每个研究组招募 88 名患者。
c-Myc 表达肿瘤中的活性
对于定义为主要终点的 ITT 人群PFS,分析揭示了 alisertib 组合的显著优势(3.32 个月与 2.17 个月;HR, 0.71;p = 0.038)。患有耐药性或难治性复发的患者也体验到了显著的PFS 获益(2.86 个月与 1.64 个月;HR,0.659;p = 0.037)。对于 OS、 DCR 和 ORR,结果暗示使用 alisertib组合可获得有利结果,但差异未达到显著性。
alisertib 和紫杉醇具有重叠的毒性。alisertib 联合紫杉醇更频繁发生≥ 3 级 AE(76 %与 51 %),药物相关严重 AE 也是如此(32 %与 7 %)。使用 alisertib 组合最常见的 AE 包括腹泻、疲劳、中性粒细胞减少、贫血和口腔炎。在≥3 级 AE 中以中心粒细胞减少为主(38 %与 6 %)。实验组中所有≥3 级 AE 的发生频率比对照组至少高 2 倍。AE 相关停药在实验组中更频繁发生(15 %与 6 %),AE 所致剂量减少也是如此(38 %与 10 %)。
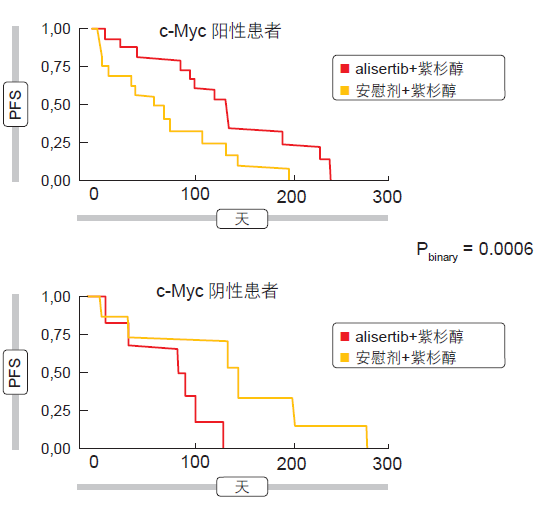
在认为 c-Myc 蛋白表达可用作生物标志物的情况下,预先设定的探索性分析产生了与 PFS 的强关联。在本研究中,添加 alisertib 在 c-Myc 阳性患者中产生了明显优于单纯使用紫杉醇的临床 PFS 获益(HR,0.29),而在 c-Myc 阴性亚组中则观察到相反的模式(HR,11.8;图 1)。需要进行前瞻性研究以进一步验证 c-Myc 的预测价值。
图 1:根据 c-Myc 蛋白表达,向紫杉醇中添加 alisertib 对 PFS 的影响
使用 atezolizumab 的初步结果
人源化单克隆抗 PDL1 抗体atezolizumab 已经在多项 NSCLC 临床试验中显示出喜人的临床活性和可承受的安全特性。由于 SCLC 表现出高频率的体细胞突变,因此这些肿瘤可能适于用 PD-1/PD-L1 抑制剂治疗。Sequist 等人介绍了针对 ES-SCLC队列获得的结果,该队列是研究局部晚期或转移性实体瘤中 atezolizumab作用的更大规模 Ia 期临床试验的一部分[6]。前五名患者是根据 PD-L1 选定的;此后,招募继续进行而与 PD-L1表达状态无关。在安全性和疗效分析中对 17 名患者进行了评价。
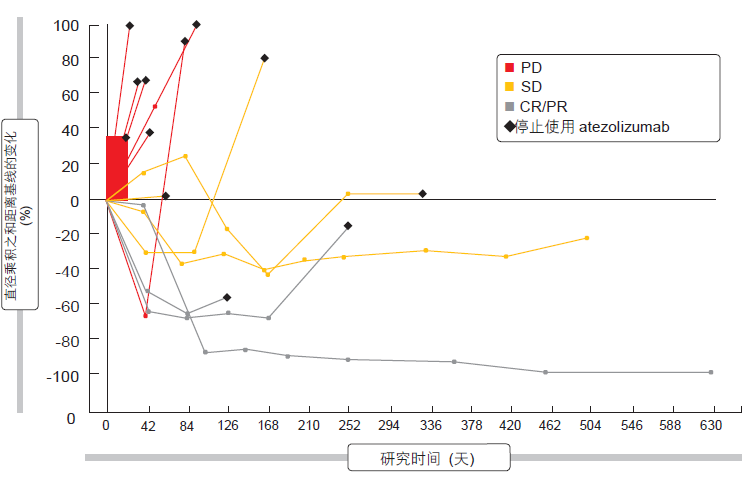
使用 atezolizumab 的治疗一般耐受性良好,大多数 AE 为 1 级或 2级。atezolizumab 显示出令人鼓舞的单一药物活性。图 2 中描绘的蜘蛛图显示根据免疫相关反应标准(irRC)实现的反应。在 17.6 % 的患者中发生了根据 irRC 的客观反应。在 41.2 %的患者中获得了疾病控制。在所有患者中,根据 irRC 的中位 PFS 为 2.9 个月,中位 OS 为 5.9 个月。在表达 PD-L1 的肿瘤中,PD-L1 mRNA 和 T 效应基因标签的更高表达对应于改善的PFS(根据 irRC)和 OS 的趋势。 atezolizumab 的临床获益在典型影像学进展发生后继续存在。一项针对 ES-SCLC 患者中 atezolizumab 或安慰剂联合卡铂(carboplatin)/依托泊苷(etoposide)作用的 III 期随机化研究正处在招募阶段(NCT02763579)。
图 2:ES-SCLC 患者对 atezolizumab 的经证实反应(根据 irRC)
其它新型药物
Chu 等人介绍了关于以 fucosyl-GM1为靶标的单克隆抗体 BMS-986012 的令人鼓舞的数据;fucosyl-GM1 在化学上被定义为一种单唾液酸神经节苷脂,其在正常组织中表现出有限表达 ,而在 SCLC 肿瘤细胞表面高度表达[7]。BMS-986012 被开发作为首创全人免疫球蛋白 G1 单克隆抗体。该药物的抗肿瘤活性基于抗体依赖性细胞介导的细胞毒性、补体依赖性细胞毒性和抗体依赖性细胞吞噬作用。
I/II 期剂量递增和剂量扩大CA001-030 研究在复发性和难治性SCLC 患者中开展。根据来自该试验 I期单药治疗部分的初步数据,BMS-986012 耐受性良好,并且患者对治疗有反应。然而,由于这部分研究中患者数量少及其异质性,尚不能得出关于 BMS-986012 疗效的明确结论。 BMS-986012 的药代动力学与单克隆抗体预期可能的药代动力学一致,并且在接受治疗的患者中没有检测到抗药物抗体。该试验的 II 期单药治疗部分的招募正在进行当中。进一步研究目前正在探究采用 BMS-986012 作为与纳武单抗和化疗的组合方案的一部分。
相比之下,使用针对细胞周期蛋白依赖性激酶的口服高效小分子抑制剂 roniciclib 获得了阴性试验结果[8]。在 ES-SCLC 患者中进行的 II 期随机化双盲安慰剂对照研究将顺铂(cisplatin)/依托泊苷与卡铂/依托泊苷进行比较,与 roniciclib 或安慰剂组合用作一线疗法。就 PFS、OS、ORR和进展时间而言,添加 roniciclib 未观 察到改善。此外,该组合耐受性差,接受 roniciclib 的患者相对于对照组患者表现出更高的临床重要 AE 和致命AE 发生率。该研究在初步完成后终止。
参考文献
- Alvarado-Luna G, Morales-Espinosa D, Treatment for small cell lung cancer, where are we now? -a review. Trans Lung Cancer Res 2016; 5: 26-38
- Ali S et al., Small cell lung carcinoma harbors gene fusions including MYCL1 fusions which can respond to aurora kinase inhibitors. ESMO 2016, abstract 14240
- Sos ML et al., A framework for identification of actionable cancer genome dependencies in small cell lung cancer. PNAS 2012; 109: 17034- 17039
- Hook et al., AACR 2010, abstract 2615
- Owonikoko TK et al., Randomized phase 2 study of the investigational aurora A kinase (AAK) inhibitor alisertinb (MLN8237) + paclitaxel versus placebo + paclitaxel as second-line therapy for small cell lung cancer (SCLC). ESMO 2016, abstract 14230
- Sequist LV et al., Clinical activity, safety and predictive biomarker results from a phase Ia atezolizumab trial in ES-SCLC. ESMO 2016, abstract 1425PD
- Chu Q et al., A phase 1/2 trial of a monoclonal antibody targeting fucosyl-GM1 in relapsed/refractory small cell lung cancer (SCLC): safety and preliminary efficacy. ESMO 2016, abstract 1427PD
- Reck M et al., Phase II study of roniciclib in combination with cisplatin/etoposide or carboplatin/ etoposide as first-line therapy in patients with extensive-disease small-cell lung cancer. ESMO 2016, abstract 1426PD
More posts
SCLC:基因组改变为靶向方法铺平道路
SCLC:基因组改变为靶向方法铺平道路 转移性疾病的快速生长和早期发展是小细胞肺癌(SCLC)的特征,而小细胞肺癌占到所有肺癌病例的大约15 %[1]。局限期疾病有可能通过
罕见驱动突变:小患者人群中的可喜结果
罕见驱动突变:小患者人群中的可喜结果 除了 ALK 融合突变和 EGFR 突变,对NSCLC 患者遗传谱的研究已经确定了其它可能用于额外靶向治疗的突变。其中,ROS1 和
EGFR 靶向疗法:在正确的时间使用在正确的患者身上
EGFR 靶向疗法:在正确的时间使用在正确的患者身上 大约 11 % 的非小细胞肺癌(NSCLC)白种人患者具有携带EGFR 突变的肿瘤[1],该突变发生于EGFR 基因的
“靶向抑制血管生成可以延长生命”
“靶向抑制血管生成可以延长生命” Anders Mellemgaard, MD, PhD, Clinical Associate Professor, Department
克唑替尼(crizotinib)失效后,新一代 ALK 抑制剂表现优异
克唑替尼(crizotinib)失效后,新一代 ALK 抑制剂表现优异 ALK 融合基因阳性肺癌在晚期非小细胞肺癌(NSCLC)患者中的发生率达5 % [1]。ALK 抑制
免疫检查点抑制:图景正慢慢变得完整
免疫检查点抑制:图景正慢慢变得完整 KEYNOTE-024:一线 PD-L1 集人群 抗 PD-1 抗体派姆单抗(pembrolizumab)已被批准用于治疗PD-L1 表