免疫療法: 進歩の最先端でもう一度
PACIFIC:
ステージIII NSCLCでのデュルバルマブ
非小細胞肺癌(NSCLC)患者の約1/3がステージIIIの局所進行疾患を示している。良好な一般状態であって、切除不可能な腫瘍のあるそれらの患者の場合、標準治療はプラチナベース二剤化学療法と併用放射線療法である。数年間にわたってこの条件では大きな進展が生じなかったため、生存率を引き上げる新規治療方法に対する顕著なニーズが満たされていない。転移性疾患でのチェックポイント阻害剤の有効性に関して、ステージIIIの局所進行、切除不可能NSCLC患者の免疫チェックポイント阻害を評価するため、最初の無作為化フェーズIII試験として国際二重盲検PACIFIC試験が開始された。
PACIFICでは、少なくとも2サイクルのプラチナベース併用化学放射線療法後に進行しなかった患者でPD-L1阻害剤デュルバルマブを評価した。これらの患者を、最長12ヶ月間、2週間ごとにデュルバルマブを10mg/kg投与する群(n=476)またはプラセボ群(n=237)のいずれかに無作為に割り付けた。これは、PD-L1発現状態に関する制限なしに全患者集団であった。各治療群の患者の半数が扁平上皮と非扁平上皮組織構造をそれぞれ有した。化学放射線療法の終了時に、大多数は部分奏効(PR)または安定(SD)を得た。RECISTガイドライン1.1版に従った独立第三者評価機関(BICR)による無増悪生存期間(PFS)と全生存期間(OS)が複数の主要評価項目を構成した。
11ヶ月以上のPFS差
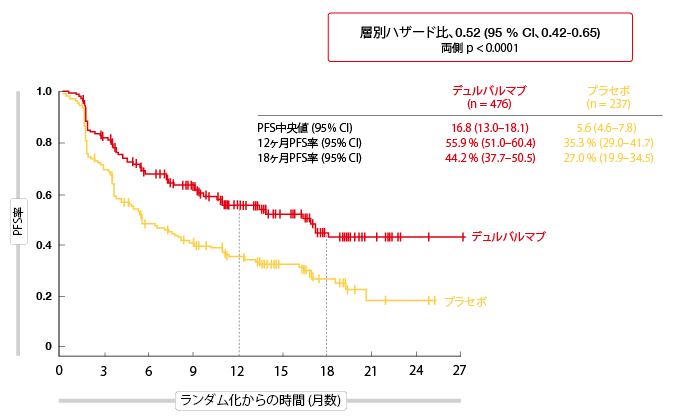
14.5ヶ月間の追跡期間中央値の後に、2017年ESMO学会で発表されたPFSに関して計画された中間解析の結果から、デュルバルマブはステージIII条件での有望な治療選択肢であることが示された [1].。プラセボと比較すると、デュルバルマブは11ヶ月以上の中央値の改善で、統計的に有意で、揺るぎないPFSの利益を示した(16.8ヶ月対5.6ヶ月; HR, 0.52; p < 0.0001; 図1)。治療開始後2ヶ月目の間に、PFS曲線は離れ始めた。すべての予め規定した集団が、組織構造、化学放射線療法に対する最良効果、PD-L1発現状態などの特徴に関わらず、同程度でデュルバルマブ治療から恩恵を受けた。
同様に、デュルバルマブ治療群で臨床的に意義のある程度に客観的奏効率(ORR)が改善された(28.4%対16.0%; p < 0.001)。このことは、奏効期間にも当てはまる(未達成に対して13.8ヶ月; HR, 0.43)。その結果、脳転移を含むあらゆる部位での新たな病変はプラセボ群よりも試験群で少ない頻度で発症した(20.4%対32.1%)、そして、BICRによる遠隔転移または死亡までの時間は有意に延長された(23.2ヶ月対14.6ヶ月; HR, 0.52; p < 0.0001)。
デュルバルマブは、より進行した疾患での以前の報告と一致する好ましい安全性プロファイルを示した。咳、肺臓炎、発熱、肺炎、発疹、および甲状腺機能低下が最も多い有害事象(AE)の1つに数えられる。化学放射線治療後には新たな安全性の兆候は表れなかった。肺臓炎/放射線肺臓炎に関して、デュルバルマブ群とプラセボ群の差は小さかった(すべてのグレード、33.9% vs. 24.8%)。AEによって治療を中止した患者の10%と比較して15%であった。全グレードの免疫関連AEが24.2%対8.1%で見られ、グレード3/4事象では低い割合であった(3.4%対2.6%)。目標死者数に達した後にOSの最終分析が行われるため、試験はOSに対してまだ盲検化されたままである。
図1:PACIFIC臨床試験でのデュルバルマブ対プラセボによる無増悪生存率
PD-L1–陰性患者でのアテゾリズマブ活性の確認
無作為化OAK [2]およびPOPLAR [3]試験から、二次以降の抗-PD-L1 抗体アテゾリズマブによる治療が、PD-L1発現または組織構造に関わらずドセタキセルに対してOSで臨床的に意義のある改善を生じさせることが分かった。OAKの一次解析によると、アテゾリズマブとドセタキセルのOSの中央値はそれぞれ13.8ヶ月と9.6ヶ月であった(HR, 0.73; p = 0.0003) [2]。OAK結果の目立つ特徴は、SP142分析によるとPD-L1状態が陰性の患者を含み、アテゾリズマブはPD-L1発現サブグループのすべてにわたってOSを改善したことである。この群では、OSのHRは0.75で、結果として0.73の全体HRと類似していた。また、アテゾリズマブとドセタキセルによるOSの中央値はそれぞれ、12.6ヶ月対8.9ヶ月であった。
OAK試験のレトロスペクティブ予備解析によって、アテゾリズマブがPD-L1状態に関わらずすべての患者で生存率の利益をもたらすことを確認し、利用される分析に関わらず、PD-L1-陰性腫瘍のある患者でのOSの改善を実証した[4]。最後まで、治験責任医師は2種類のFDA承認PD-L1免疫組織化学(IHC)診断分析SP142および22C3を比較した。22C3分析を用いて、PD-L1発現に関してOAKに登録された患者400人の腫瘍を遡及的に分析した。これらの結果を、元のSP142分析の400の腫瘍に関して作製されたPD-L1スコアと比較した。
治験責任医師は、SP142 PD-L1–陰性患者の大半(77%)は22C3分析によるPD-L1–陰性でもあることを発見した。アテゾリズマブは、どちらかの分析によるとPD-L1–陰性腫瘍患者の生存率を有意に向上させた(HRs、SP142と22C3でそれぞれ,0.55と0.61)。腫瘍が両方の分析でPD-L1–陰性と定義された患者は、ドセタキセルと比較してアテゾリズマブによってOSが向上することが分かった(9.9ヶ月対7.7ヶ月; HR, 0.63; p= 0.0347)。このOSに関する恩恵は全般的なOAK試験結果と一致した。
腫瘍変異負荷量に関する新規の血液ベース分析
OAKとPOPLAR試験に基づく別の分析から、血液中で腫瘍変異負荷量(TMB)を測定でき(bTMB)、bTMBは免疫チェックポイント阻害剤治療によるPFSの改善に関連していることが実証された[5]。Gandara等はbTMBの測定のための新規の血液ベース分析を試験し、bTMBとアテゾリズマブの有効性の関連性を評価した。腫瘍組織で測定した時のTMBはNSCLCでのアテゾリズマブの有効性と相関関係を持つことが以前示されたが[6]、新たに診断されたNSCLC患者の約1/3での分子検査には組織が不十分なため、診断材料の代替供給源が求められる。
394の遺伝子に基づく次世代配列解析を用いて、bTMBに関してPOPLARとOAKからの血漿試料を遡及的に評価した。POPLARからの273試料中の211試料とOAKの797試料中583試料がバイオマーカーで評価可能で、試験のバイオマーカー評価可能集団(BEP)を構成した。循環無細胞DNAを抽出した。0.5%以上の対立遺伝子頻度の全塩基置換が計数される一方で、生殖細胞変異と予測ドライバー変異が取り除かれた。全体として、これらの結果がbTMBスコアを構成した。
いくつかのレベルのbTMBでのPOPLAR試験でPFSとOS両方の改良が観察されたが、bTMBが16レベル以上の時に分析結果が最も良好であった(PFSのHR, 0.57; OSのHR, 0.56)。これらのデータに基づき、OAK試験での確認分析には16レベル以上のbTMBが選択された。16以上のbTMB集団はBEPの27 %の割合を占めた。
高いbTMBは大きなPFS利益を予測する
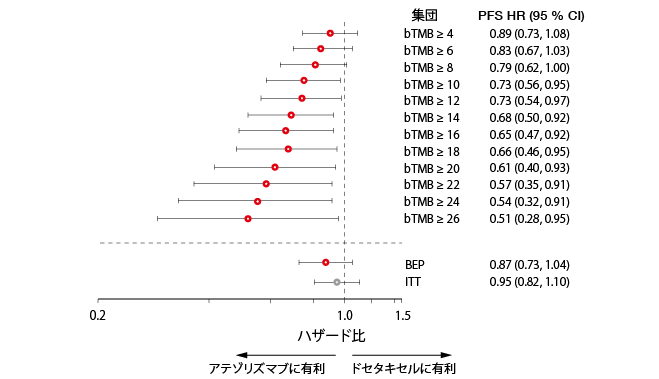
OAK試験では全般的なPFSの改善がなかった後、16以上のbTMBのサブグループはドセタキセルと比較してアテゾリズマブによってPFS利益を示した。しかし、予後効果は一切見られなかった。bTMB16以上のドセタキセル治療患者群はbTMB16未満の患者群と比較してPFSが改善しなかった。OSに関して、ドセタキセルよりもアテゾリズマブに有利に働く危険率はbTMBが16以上と16未満の群にわたって類似していた(それぞれ、0.64と0.65)。この結果は、特にドセタキセルコホートで進行後の後継治療の影響を反映するかもしれない。bTMBが16以上のサブグループのOS中央値は、アテゾリズマブとドセタキセルそれぞれで13.5対6.8であった。予備解析から、高いbTMBカットポイントによってPFS利益が線形に増加することが分かった(図2)。OSに関して、この効果は多少緩和された。基本特性とbTMBサブグループの間の相関関係の分析によれば、高いbTMBスコアは喫煙と関連していた。転移部位の最長寸法または数の合計で判断されるため、bTMBと臨床腫瘍体積の間にも相関関係が存在する可能性があった。
bTMBとの組織ベースTMB分析の比較によって、 64%の陽性一致率(PPA)と88%の陰性一致率(NPA)となった(スピアマン相関係数、0.59)。比較的低いPPAは腫瘍内不均一性、さまざまな計算方法、さまざまな検体収集時間などの要因の影響を受けた可能性がある。同じ循環腫瘍DNAを使用した場合、PPAとNPAが改善され、bTMB16以上のカットポイントの使用を支持した。別の問題は、bTMB16以上とPD-L1発現の間の相関関係の可能性と関連していた。ここで、IHCで評価した場合に患者229人中の30人だけが16以上のbTMBと高いレベルのPD-L1発現の両方を示し、重複は有意ではなかった。
著者が要約した通り、bTMBは分子検査を実施するのに十分な組織が不足している患者の最大30%にとって特に有益であるかもしれない。bTMB分析を用いた第一選択条件での前向き試験が継続中である。
図2:OAKにおいてbTMBカットポイントを引き上げることによるアテゾリズマブのPFS利益の増加
CheckMate 017と057の3年の経過観察
抗-PD-1抗体ニボルマブは、進行NSCLC患者と、CheckMate 017 [7]とCheckMate 057 [8]の国際無作為化非盲検フェーズIII臨床試験に基づいた化学療法中または後に疾患が進行した患者の治療用に多くの国で承認を受けている。CheckMate 017は扁平上皮組織構造を持つ患者でニボルマブを研究し、一方で CheckMate 057は非扁平上皮NSCLC患者を含めた。両方の臨床試験において、ドセタキセル群と比較してニボルマブ群でOSのプロファイル有意な改善と良好な安全性を示した。Felip等は少なくとも3年の経過観察に基づくCheckMate 017とCheckMate 057からの最新の有効性と安全性データを発表した[9]。
ニボルマブは、両方の臨床試験でOSとPFS曲線が水平状態で長期的な利益を実証し続けた。CheckMate 017の3年OS比率は、ニボルマブとドセタキセルを用いてそれぞれ16 %対6 %であった。CheckMate 057では、18 %対9 %であった。周知の通り、PD-L1発現はCheckMate 057に含まれた非扁平上皮群でOS利益を予測し、一方で扁平上皮組織構造を持つCheckMate 017集団ではこの効果はあまりはっきりとしなかった。3年PFS比率は、CheckMate 017では12%対計算不能で、CheckMate 057では10%対1%未満であった。
奏効した患者のうち、ニボルマブの治療を受けた患者はドセタキセル治療群よりも長い奏効期間中央値を経験した。ニボルマブが奏効したCheckMate 017とCheckMate 057の患者のそれぞれ26%と23%で腫瘍の奏効が継続中であった(表1)。2つの臨床試験のドセタキセル治療群では奏効の継続は見られなかった。長期経過観察から、ニボルマブの新たな安全性の兆候はないことが分かり、治療関連AEの比率は過去に見られたものと類似していた。
高齢者でのニボルマブに関するデ
ータ
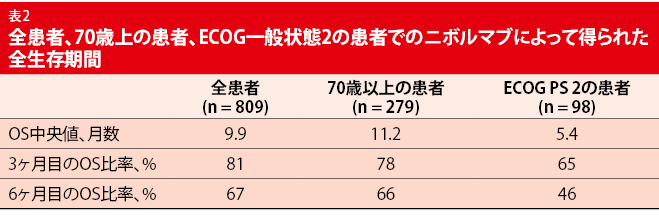
CheckMate 171の大規模継続中試験からの暫定的結果は、70歳以上の患者または2のECOG一般状態(PS)の患者を含む、事前に治療を受けた進行扁平上皮NSCLC患者での治療選択肢としてニボルマブを支持する[10]。大部分の肺癌患者は高齢時に診断され、そのため、高い頻度で併存疾患を示す。しかし、これらの患者での治療選択肢に関するデータは無作為化臨床試験では一般的に少なすぎるため、限定される。CheckMate 171の単一群フェーズII臨床試験は、70歳以上の患者(n = 279)とECOG PS 2の患者(n = 98)を含め、プラチナベース化学療法での進行後にニボルマブ単剤治療を受けた前治療歴の多い患者(n = 809)での安全性と生存転帰を調査している。
3ヶ月と6ヶ月時のOS予想中央値のほか、OS比率も全集団と70歳以上の患者で同等であることが分析から分かった(表2)。ECOG PS 2の患者はわずかに悪い結果を示した。第9週時のPR比率は、全集団、70歳以上の患者、ECOG PS 2の患者でそれぞれ、14%、14%、11%であった。ニボルマブの安全性プロファイルは、グレード3/4治療関連AE、全グレードAE、中止につながるAEの比率を含め、これら3集団にわたって同等であった。
どのくらいの期間、ニボルマブを投与する必要があるのか?
PD-(L)1阻害剤による治療の最適期間は重要な疑問として残っている。ニボルマブのデータの大多数が、疾患の進行または許容不可能な毒性までの治療に基づく一方で、CheckMate 003のフェーズI臨床試験からの所見は、約2年のニボルマブ単剤療法が、以前治療を受けたNSCLS患者の長期臨床的利益にとって十分であることを示す[11]。CheckMate 153は、PD-(L)1阻害剤による治療期間を評価する最初の無作為化臨床試験であった[12]。この試験では、1年に限定されたニボルマブ治療に対してニボルマブの継続投与を比較した。少なくとも1回の事前全身治療を受けた扁平上皮または非扁平上皮組織構造の進行または転移NSCLC患者が適格とされた。0~2のECOG一般状態のほか、治療済み中枢神経系転移も認められた。これは前治療歴の多いコホートであり、各治療群の1/4が少なくとも3回の事前治療を受け、1/3が2回の治療を受けた。
患者の全員(n=220)が、1年間、標準用量のニボルマブ(隔週3mg/kg)による治療を受けた。その後、患者をニボルマブによる継続治療または進行時に再治療を受ける機会のある治療中止のいずれかに無作為に割り付けた。無作為化時に疾病のコントロールができた患者(すなわち、完全奏効[CR]、PR、SD)のみを有効性分析に含めた。このことは、継続治療群の76人の患者と治療中止群の87人の患者に当てはまる。
所見が継続治療を支持
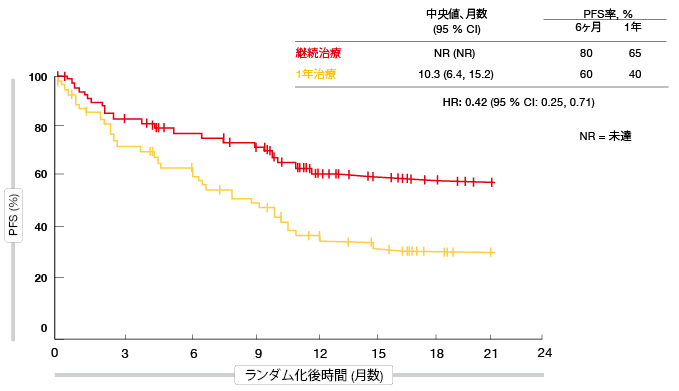
この群のうち、患者は無作為化のPFSに関してニボルマブの継続治療から非常に有意に大きな利益を得た(未達成対10.3ヶ月; HR, 0.42; 図3)。1年時点でPFS比率は65%対40%であった。さらに、ニボルマブ継続治療では、無作為化時の奏効状態とは無関係に高い活性を示した。CRまたはPRの患者の場合、PFS中央値は未達成対10.6ヶ月(HR, 0.45)で、SDの患者の場合、未達成対9.6ヶ月(HR, 0.44)であった。多変量解析では、性別、組織構造、最良総合効果、PD-L1状態の調整後でもニボルマブ継続治療を支持した(HR、0.43)。OSは、統計上有意な程度ではなかったが、ニボルマブの継続治療で長かった。
治療中止に割り付けられた患者のうち、43人がその後の疾患の進行を経験した。このうちの34人がニボルマブによる再治療を受けた。再治療期間の中央値は3.8カ月であった(範囲、0.1~17.5ヶ月)。一部の患者が治療利益を経験したが、大部分の患者は標的病変サイズの増加を示した。無作為化後の安全性に関して、1年の治療群と比較して継続治療群で治療関連(重度)AEの発生率が一般的に高くなった。1年後にわずかな新規発症事象が生じた。臨床試験治療群のいずれでも治療関連死は報告されず、全コホートで新たな安全性の兆候は生じなかった。
図3:ニボルマブ継続投与対1年後の投与中止:無増悪生存期間
KEYNOTE-021の最新結果
KEYNOTE-021試験のコホートGは、ペメトレキセド/カルボプラチン単独と比較して抗-PD-1抗体ペンブロリズマブとペメトレキセド/カルボプラチン化学療法の組み合わせを調査する非盲検無作為化フェーズII臨床試験であった。事前に治療を受けていない進行非扁平上皮NSCLC患者が登録された。10.6ヶ月の経過観察中央値後に行われた一次解析によると、ペンブロリズマブベースの併用はORR(55%対29%; p=0.0016)およびPFS(HR、0.53; p = 0.010) に関して有意な改善をもたらした[13]。その時点で、OSのHRは0.90であった。2017年ASCO学会で発表された最新分析で、ORRとPFSの利益が維持され、一方で死亡リスクが減少した(OSのHR、0.69; p = 0.13)ことが分かった[14]。一次と二次解析の両方によって、併用の管理可能な安全性プロファイルがもたらされた。
2017年ESMO学会では、Borghaei等が18.7ヶ月の経過観察中央値後の最新所見を発表した[15]。再び、ORRとPFSで有意な改善が維持された。ORRは56.7%対31.7%であった。予め規定した分析と比較すると、3つの追加の奏効が観察され、1つは試験治療群で、2つは対照群で観察された。各群で、1件のCRが生じた。いずれの群の奏効期間中央値も達成されなかった;患者の50%対40%は継続中の奏効を示した。ペンブロリズマブ治療群と化学療法単独の治療群のPFSはそれぞれ19.0ヶ月対8.9ヶ月であった(HR 0.54)。OSに関して、交差内外で抗-PD-(L)1治療を受けた対照群の患者のかなり大きな割合(治療意向集団の63%)にも関わらず、漸進的な利益が増加し続けた(HR, 0.59)。しかし、患者数が少なかったためOSの差は統計的に有意ではなかった。
同様に、前回の最新情報と比較して毒性の変化は限られていた。1件の追加AEが各治療群での治療中止につながった。毒性プロファイルは予想通りだった。免疫が原因の可能性があるグレード5のAEは生じなかった。
急速進行の罹患率と影響
免疫療法との関連での急速進行性疾患(HPD)が、初期段階の臨床試験で免疫療法による治療を受けた131人の進行癌患者の9%で述べられた[16]。 Lahmar等は、NSCLC患者89人の10%で腫瘍体積の50%を超える増加を報告した[17]。フランスの5施設で行われた後ろ向き研究では、免疫療法を受けた進行NSCLC患者の大規模コホートでのHPDの罹患率、その予後値、臨床的特徴とのその相関関係を評価した[18]。免疫療法の開始前に2回、治療中に1回のCTスキャンが必要だった。基準CTスキャンと治療開始の間隔は6週間以内にする必要があった。RECIST 1.1に従って、CTスキャンを一元的に評価した。スクリーニングを受けた患者365人のうち、242人(66%)が含まれた。
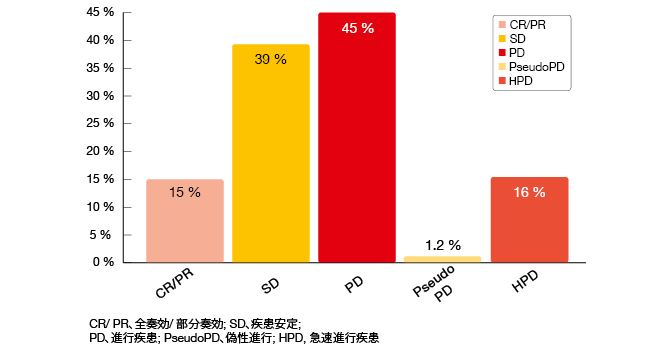
この分析によると、免疫療法の投与によって患者の36%で腫瘍の成長を早めた一方で、64%が退行またはSDのいずれかを示した。40症例(16 %)でHPDが生じた(図4)。これは治療開始前後での腫瘍成長率の50%を超える差違と定義された。疑似進行は1.2%で起こった。
進行状態による臨床的特徴の分析によると、治療開始前に2つ以上の転移部位が存在することでHPDのリスクが増加した。HPDは悪い予後因子として認識された:HPDを発症している患者はたった3.3ヶ月のOS中央値を示したのに対して、HPDではない進行を経験している患者の場合、OS中央値は5.7ヶ月であった(HR, 0.39; p = 0.011)。
図4:免疫療法の治療を受けた肺癌患者での奏効パターン
参考文献
- Paz-Ares L et al., PACIFIC: a double-blind, placebo-controlled phase III study of durvalumab after chemoradiation therapy in patients with stage III, locally advanced, unresectable NSCLC.ESMO 2017, abstract LBA1_PR
- Rittmeyer A et al., Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial.Lancet 2017; 389(10066): 255-265
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial.Lancet 2016; 387(10030): 1837-1846
- Gadgeel S et al., Clinical efficacy of atezolizumab in PD-L1 selected subgroups defined by SP142 and 22C3 IHC assays in 2L+ NSCLC: results from the randomised OAK trial.ESMO 2017, abstract 1296O
- Gandara DR et al., Blood-based biomarkers for cancer immunotherapy: tumour mutational burden in blood (bTMB) is associated with improved atezolizumab efficacy in 2L+ NSCLC (POPLAR and OAK).ESMO 2017, abstract 1295O
- Kowanetz M et al., Tumor mutation burden (TMB) is associated with improved efficacy of atezolizumab in 1L and 2L+ NSCLC patients.WCLC 2016, abstract OA20.01
- Brahmer J et al., Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer.N Engl J Med 2015; 373: 123-135
- Borghaei H et al., Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer.N Engl J Med 2015; 373: 1627-1639
- Felip E et al., Three-year follow-up from CheckMate 017/057: nivolumab versus docetaxel in patients with previously treated advanced non-small cell lung cancer.ESMO 2017, abstract 1301PD
- Popat S et al., Nivolumab in previously treated patients with metastatic squamous NSCLC: results of a European, single-arm, phase 2 trial (CheckMate 171) including patients aged ≥ 70 years or with poor performance status.ESMO 2017, abstract 1303P
- Brahmer J et al., AACR Annual Meeting 2017, abstract 8356
- Spigel DR et al., CheckMate 153: randomised results of continuous vs. 1-year fixed-duration nivolumab in patients with advanced non-small cell lung cancer.ESMO 2016, abstract 1297O
- Langer CJ et al., Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study.Lancet Oncol 2016; 17: 1497-1508
- Papadimitrakopoulou P et al., First-line carboplatin and pemetrexed (CP) with or without pembrolizumab (pembro) for advanced nonsquamous NSCLC: updated results of KEYNOTE-021 cohort G. J Clin Oncol 2017; 35 (suppl; abstr 9094)
- Borghaei H et al., Updated results from KEYNOTE-021 cohort G: a randomised, phase 2 study of pemetrexed and carboplatin with or without pembrolizumab as first-line therapy for advanced nonsquamous non-small-cell lung cancer.ESMO 2017, abstract LBA49
- Champiat S et al., Hyperprogressive disease is a new pattern of progression in cancer patients treated by anti-PD-1/PD-L1.Clin Cancer Res 2017; 23(8): 1920-1928
- Lahmar J et al., Immune checkpoint inhibitors induce paradoxical progression in a subset of non-small cell lung cancer (NSCLC).Ann Oncol 2016; 27 (suppl_6): 1222P
- Ferrara R et al., Hyperprogressive disease (HPD) is frequent in non-small cell lung cancer (NSCLC) patients treated with anti PD-1/PD-L1 monoclonal antibodies (IO) and predicts poor survival.ESMO 2017, abstract 1306PD
More posts
ALK-陽性NSCLC:クリゾチニブおよびアレクチニブに関する最新情報
ALK-陽性NSCLC:クリゾチニブおよびアレクチニブに関する最新情報 PROFILE 1014は、ALK-陽性肺癌患者の第一選択治療でのALK阻害剤クリゾチニブの役割を定
形質転換に起因するSCLCの特性および転帰
形質転換に起因するSCLCの特性および転帰 GFR TKI療法に対する耐性の取得時にEGFR-変異腺癌の少ないが有意な割合がSCLCに形質転換する[1]。さらに、EGFR
悪性中皮腫で前例のない転帰範囲に到達
悪性中皮腫で前例のない転帰範囲に到達 悪性胸膜中皮腫(MPM)は希ですが、予後不良の侵襲性の強い癌です。ベバシズマブの有無にかかわらず、プラチナおよびペメトレキセドとの併用
インタビュー:生存は複数の治療ラインの結果である
インタビュー:生存は複数の治療ラインの結果である Nicolas Girard, MD, PhD Institut Curie, Institut du Thorax Cu
EGFR-変異肺癌:新たなデータを考慮した大きな話題としての優先順位付け
EGFR-変異肺癌:新たなデータを考慮した大きな話題としての優先順位付け EGFR TKI治療失敗後のオシメルチニブによる長期結果 第一世代上皮成長因子受容体チロシンキナー
早期NSCLCの切除後のCTベースの経過観察に関する無作為化所見
早期NSCLCの切除後のCTベースの経過観察に関する無作為化所見 早期NSCLCの手術後の最適な経過観察に関して、ESMOガイドラインでは、病歴、身体検査、そしてできれば1