EGFR阳性肿瘤:多线中的最佳疗法问题
FLAURA:一线奥希替尼(osimertinib)的OS
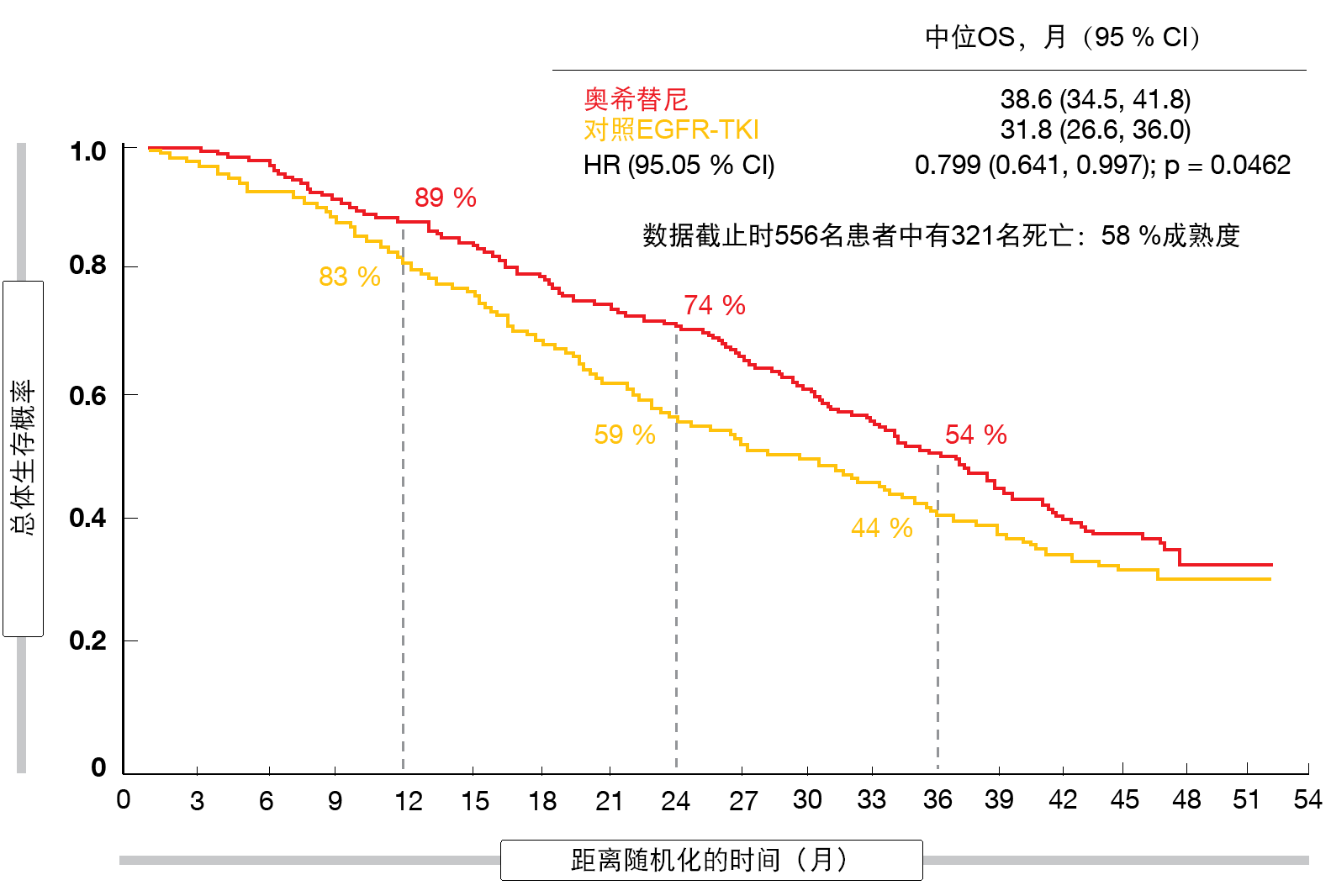
在晚期EGFR阳性NSCLC患者中,EGFR酪氨酸激酶抑制剂(TKI)代表前线治疗标准。三代TKI均广泛可用,但理想的顺序目前未知。III期双盲随机化FLAURA试验在前线条件下比较了第三代EGFR TKI奥希替尼与第一代药物吉非替尼(gefitinib)和厄洛替尼(erlotinib)。在初步分析时显示奥希替尼带来的显著PFS获益(18.9与10.2个月;HR,0.46;p < 0.001),但生存期结果尚未成熟[1]。Ramalingam等人在2019年ESMO大会上介绍了OS的最终结果,其被定义为研究的关键次要终点[2]。 FLAURA证明了奥希替尼与吉非替尼或厄洛替尼相比具有统计上显著且临床上有意义的OS改善(38.6与31.8个月;HR,0.799;p = 0.0462;图1)。24个月时,74 %与59 %的患者存活;36个月时,这一比例为54 %与44 %。由于OS是次要终点,因此试验未能评估每个亚组的OS效应。然而,与对照组相比,所有患者均从第三代TKI治疗得到OS获益,尽管非亚洲亚组的获益幅度大于亚洲队列。对于亚洲患者,Kaplan Meier曲线表明在研究的前三年具有生存优势。36个月时,高程度的审查和较少的事件使解释变得困难。
图1:FLAURA试验中,奥希替尼与吉非替尼或厄洛替尼的最终总体生存结果
后续治疗
在奥希替尼组中观察到的至首次后续治疗或死亡的持续时间是对照药物所得到的持续时间的近两倍(25.5与13.7个月;HR,0.478;p < 0.0001)。36个月时,有28 %与9 %的患者仍在接受研究治疗。两个试验组中均有30 %的患者无法接受任何后续治疗,其中大多数在发生疾病进展后死亡。在奥希替尼组中,经历进展的患者中有47 %继续进行二线抗癌治疗,其主要包括细胞毒性化疗(68 %)。对照组中有65 %的患者接受了二线治疗,其中奥希替尼是最常用的药物(47 %)。该组中向22 %的患者给予化疗。 尽管FLAURA中实验组的暴露时间延长,超过对照组的暴露时间(20.7与11.5个月),但奥希替尼显示与已知发现一致的有利的毒性特征。接受第三代TKI治疗的患者中有相对较小的比例发生可能的治疗相关≥3级不良事件(18 %与29 %)。作者指出,FLAURA的最终OS分析支持将奥希替尼作为EGFR突变晚期NSCLC患者的前线治疗的标准治疗。奥希替尼是首个与另一种EGFR TKI相比显示统计上显著OS获益的EGFR TKI单药疗法。
进展早期迹象的液体监测
FLAURA研究的探索性分析探究了将连续循环肿瘤DNA(ctDNA)用于进行性疾病和耐药机制的早期分子检测[3]。在FLAURA中进行随机分配的556名患者中,122名有资格进行ctDNA分析(奥希替尼和对照组中分别为42和80名)。C797S和T790M是仅进行测试的耐药性突变。
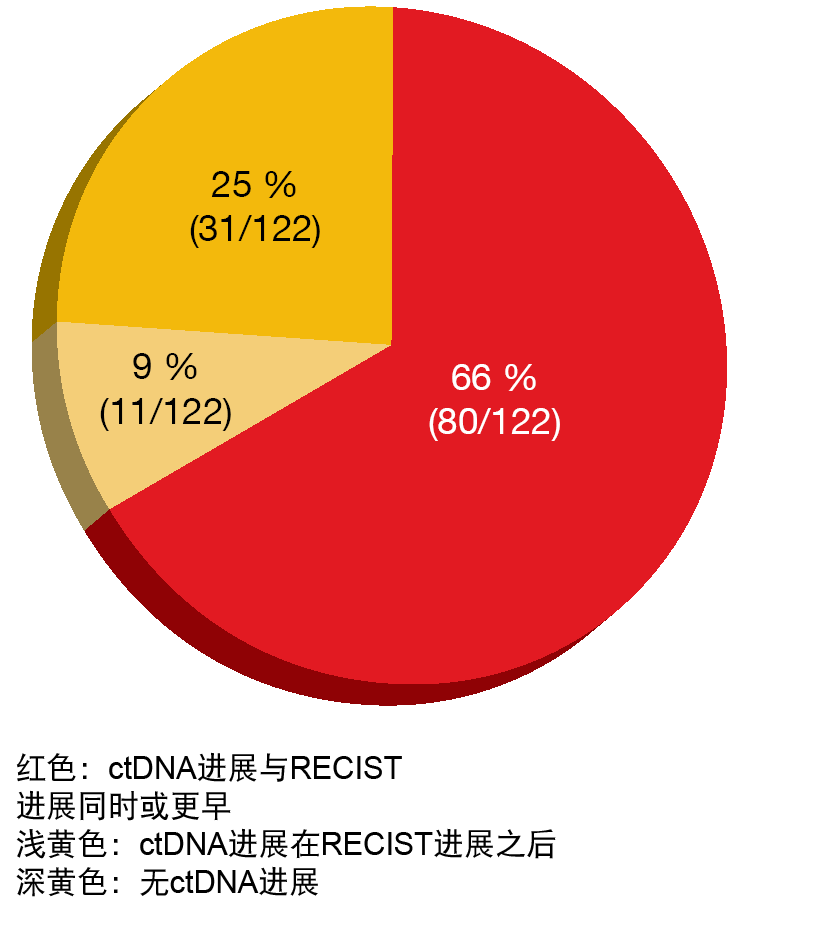
根据RECIST,在两个治疗组中均有66 %的患者在疾病进展之前或与之同时发生ctDNA进展(图2)。奥希替尼和对照EGFR TKI治疗的至中位ctDNA进展时间相似(3.0个月与2.6个月)。在122名具有ctDNA进展的患者中,有47 %出现了耐药性突变。在16.7个月的中位时间后,测试在8 %的奥希替尼治疗人群中鉴定出C797S突变,而在对照组中在8.4个月后发现74%具有T790M。总体而言,从检测到耐药性突变到RECIST疾病进展的中位时间为1.4个月。根据该分析,纵向ctDNA监测有可能在疾病进展之前检测到进展和获得性耐药突变的早期迹象。使用新一代测序的进一步分析正在进行中。
图2:在一线奥希替尼情况下相对于发生RECIST进展的ctDNA进展发生时间
对奥希替尼耐药性的见解
基于前瞻性MATCH-R研究中纳入的31名患者的数据,通过另一项分析鉴定了对奥希替尼治疗的耐药机制[4]。这项研究评估了来自接受靶向药物治疗患者的肿瘤克隆架构的演变。在接受奥希替尼发生进展时并且可选地在进展之前进行组织和血浆活检。审查所有分子致癌改变并将其分类为确定的/潜在的耐药机制或伴随的遗传改变。
该分析表明,对奥希替尼的耐药机制是异质的,并且比预期更加复杂。在45%的患者中检测到超过一种改变;19%的患者具有一种耐药机制,29 %具有两种耐药机制,16 %具有三种耐药机制。TP53突变是最常见的并发畸变(71 %)。同时发生的遗传改变与耐药机制的数量显著相关(p = 0.002)。标靶机制(例如,EGFR畸变、RET和MET重排)占39 %,而脱靶畸变(例如,NTRK1重排、KIF5B-RET融合、MET扩增、KRAS和NRAS突变)占26 %。在35 %的患者中,耐药机制仍然未知。
与保持T790M的患者相比,T790M丢失有更高频率与未知的耐药机制同时发生,并且与更具侵袭性的进展模式相关,导致至治疗中止时间更短(13个月与22个月;HR,2.16;p = 0.046)。总体而言,分析显示有相当数量的确认融合(16 %),其中一些是潜在可靶向的。科学家指出,可能需要组合治疗策略来改善临床结果。
GioTag:阿法替尼(afatinib)随后奥希替尼
EGFR TKI治疗后的进展不可避免,这引发了后续治疗的问题。一些考虑因素为阿法替尼和奥希替尼的顺序使用提供了依据。看门EGFR T790M突变代表第一代和第二代EGFR TKI的获得性耐药的主要机制。据估计,第二代药物阿法替尼的T790M发生率为50 %至70 %[5-8],对于缺失19阳性疾病患者甚至达到75 %[9]。因此,大多数阿法替尼进展患者将有资格接受二线奥希替尼,后者在AURA3试验中显示出明显的对抗T790M阳性疾病的活性[10]。相反,尚未确定在接受奥希替尼发生进展后的单一主导耐药机制[11, 12]。此处缺乏靶向选择,大多数情况下将随后进行化疗。
基于这些观察结果,全球观察性GioTag研究评估了在阿法替尼一线治疗时发生T790M突变后转用奥希替尼的患者的临床结果。欧洲、亚洲和北美十个国家的地点参与了这项研究。相当一部分GioTag入选患者由于ECOG表现状态(PS)下降或脑部病灶而将被排除在临床试验之外。分别有15 %和10 %存在ECOG PS ≥ 2和稳定的脑转移。
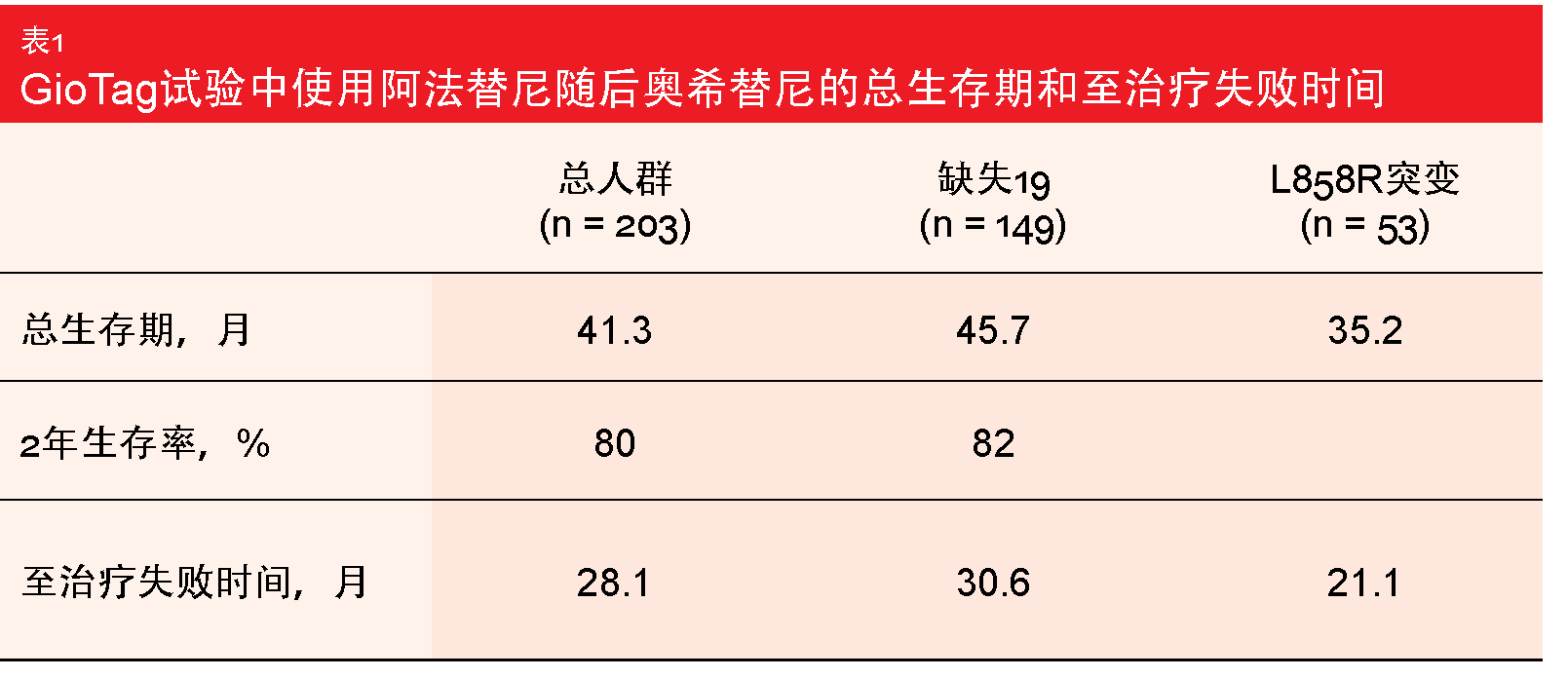
Hochmair等人在2019年ESMO大会上报告了中期更新分析,显示203名患者的总人群的中位OS为41.3个月(表)[13]。80 %的患者在24个月时存活。在缺失19阳性肿瘤组中,中位OS为45.7个月,且2年生存率达82 %。整个组和缺失19患者的中位至治疗失败时间(TTF)分别为28.1和30.6个月。
对于单独的奥希替尼治疗,TTF为15.6个月,这表明该药物在阿法替尼后的二线条件下能够达到显著临床获益。在FLAURA试验中,一线奥希替尼的中位暴露时间为16.2个月[1]。作者得出结论认为,对于EGFR突变NSCLC患者,阿法替尼随后奥希替尼的顺序是可行的策略。需要前瞻性数据来评价接受不同EGFR TKI和顺序方案治疗的患者的OS。
德国和法国用药顺序数据
进一步的现实分析增添了支持顺序治疗的证据。在于德国49个中心进行的前瞻性非干预性现实GIDEON研究中,151名晚期EGFR阳性NSCLC患者接受了前线阿法替尼。从29名接受阿法替尼并随后在任何后线接受奥希替尼治疗的患者获得的数据表明,该方案可能提供最佳结果[14]。在阿法替尼治疗起始两年后,89.3 %的患者存活。在分析时,中位OS数据尚未达到成熟。与已发表的数据[15]一致,GIDEON研究中接受后线奥希替尼治疗患者的数量在缺失19亚组中高于其他EGFR突变亚组。
此外,基于法国全国性声明和住院数据库的TKIseq研究将该顺序鉴定为具有获得性T790M突变的患者的可行策略[16]。Girard等人在现实条件下评估了接受第一代或第二代EGFR TKI随后接受奥希替尼治疗的患者的治疗时间、OS、医疗资源和费用。分析共纳入576名晚期EGFR突变NSCLC患者。中位治疗时间(即从声明首次递送第一代或第二代TKI到奥希替尼中止或死亡的持续时间)为34个月。24个月时,64.8 %的患者仍在接受EGFR TKI治疗;36个月时,这一比例为48.2 %。给予一线治疗的中位时间为13.6个月,给予奥希替尼的中位时间为11.9个月。顺序策略的总生存期达37.1个月。36个月时,51.6 %的患者存活。对于总人群,每名患者每年的平均直接医疗费用共计62,806 €。TKI治疗的费用占总额的77 %。
现实条件下的一线阿法替尼
现实证据强调了阿法替尼作为前线药物的活性。全球性前瞻性单组IIIb期1200.55研究在EGFR突变NSCLC患者人群中评价了一线阿法替尼的疗效和安全性[17]。在分析时,共有479名患者得到治疗。其中大部分具有ECOG PS 1(57 %),17 %存在脑转移。因此,研究人群中有一定比例的患者可能无资格进行临床试验。
尽管如此,中期疗效和安全性结果与关键LUX-Lung 3、6和7试验[18-20]的发现一致。中位至症状进展时间(TTSP)和PFS分别为14.9和13.4个月。临床获益在一系列亚组中均有发生,这些亚组包括具有ECOG PS 2、无症状脑转移、罕见EGFR突变和≥ 1种先前治疗线的患者。在具有缺失19(TTSP和PFS分别为19.3和15.9个月)和ECOG PS 0/1(分别为15.8和13.8个月)的患者中观察到延长的疗效。46 %的患者对治疗有应答,86 %实现了疾病控制。腹泻和皮疹是最常见的不良事件;两者通常都可以通过剂量减少来控制,并且导致很少的治疗中止(腹泻和皮疹分别为3 %和1 %)。
一项综合分析汇总了在1200.55研究和另一项在现实条件下在EGFR TKI初治患者中评价阿法替尼的大型前瞻性IIIb期试验中获得的结果[21]。总体而言,纳入了1,020名患者,其中68.8 %具有ECOG PS 1。各有18 %在基线时存在脑转移和罕见EGFR突变。31 %的患者接受过一条或多条先前治疗线。
这项汇总分析显示出令人鼓舞的疗效以及与LUX-Lung试验[18-20]的发现一致的可预测且可控的安全性特征。总人群的中位TTSP和PFS分别为14.6和12.9个月。客观缓解的发生率为52.7 %且持续12.9个月。近90 %的患者实现了疾病控制,且持续13.9个月。在40.5 %的情况下,进行从40 mg/d到30 mg/d的剂量减少;在另外12.1 %的情况下,剂量进一步减少至20 mg/d。
实施用药顺序的障碍
由于在临床实践中通常难以实施EGFR TKI用药顺序,因此于德国进行的回顾性分析评价了接受第一代/第二代TKI治疗并在批准接受奥希替尼后进行了最后随访的EGFR突变NSCLC患者的临床病程[22]。分析旨在更好地了解现实条件下的患者处置和局限性。
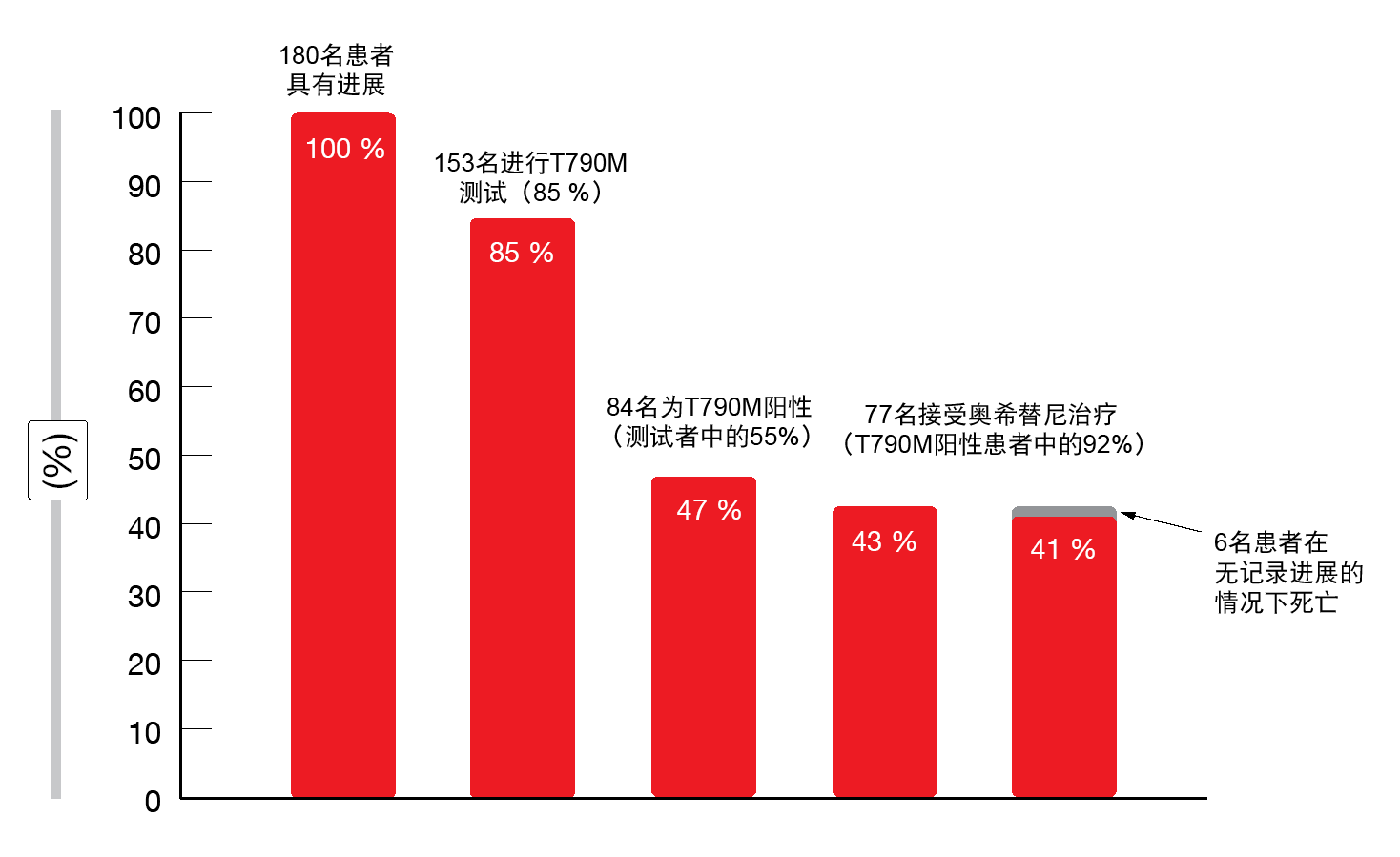
最初的TKI治疗主要包括阿法替尼(49 %),随后厄洛替尼(36 %)和吉非替尼(15 %)。在186名第一代/第二代TKI失败患者的组中,对153名个体(85 %)进行了T790M测试,其中有84名(55 %)鉴定出T790M突变(图3)。六名患者在无记录发生进展的情况下死亡,但他们具有主要由于不良事件导致的治疗中止或改变。最终,最初接受第一代或第二代EGFR TKI治疗的患者有41 %接受了奥希替尼。前线TKI失败组从治疗起始计的中位OS为35个月。在此后服用奥希替尼的患者相比于接受其他下一线药物或未进行后续治疗的患者表现显著更佳(中位OS,52与25个月;p < 0.001)。 作者指出,顺序EGFR TKI治疗的主要障碍是缺乏T790M测试和T790M阴性进展。大约25 %的患者在一线EGFR TKI失败后未接受下一线治疗;这一比例在未接受T790M测试的组中(77 %)比经T790M测试的患者组中(14 %)要高得多。超过90 %的T790M阳性患者最终接受了奥希替尼
图3:186名第一代和第二代EGFR TKI治疗失败患者的T790M测试和奥希替尼治疗率
参考文献
- Soria JC et al., Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018; 378(2): 113-125
- Ramalingam SS et al., Osimertinib vs comparator EGFR-TKI as first-line treatment for EGFRm advanced NSCLC (FLAURA): final overall survival analysis. ESMO 2019, abstract LBA5_PR
- Gray JE et al., Longitudinal circulating tumour DNA (ctDNA) monitoring for early detection of disease progression and resistance in advanced non-small cell lung cancer (NSCLC) in FLAURA. ESMO 2019, abstract LBA85
- Enrico D et al., Multiple synchronous mechanisms may contribute to osimertinib resistance in non-small-cell lung cancer (NSCLC) patients: insights of the MATCH-R study. ESMO 2019, abstract 1526P
- Hochmair MJ et al., Liquid-biopsy-based identification of EGFR T790M mutation-mediated resistance to afatinib treatment in patients with advanced EGFR mutation-positive NSCLC, and subsequent response to osimertinib. Target Oncol 2019; 14(1): 75-83
- Arcila ME et al., Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay. Clin Cancer Res 2011; 17(5): 1169-1180
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3(75): 75ra26
- Yang JC et al., Osimertinib in pretreated T790M-positive advanced non-small-cell lung cancer: AURA study phase II extension component. J Clin Oncol 2017; 35(12): 1288-1296
- Jenkins S et al., EGFR mutation analysis for prospective patient selection in two phase II registration studies of osimertinib. J Thorac Oncol 2017; 12(8): 1247-1256
- Mok TS et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376: 629-640
- Ramalingam SS et al., Mechanisms of acquired resistance to first-line osimertinib: preliminary data from the phase III FLAURA study. Ann Oncol 2018; 29(suppl): LBA50
- Schoenfeld AJ et al., Tissue-based molecular and histological landscape of acquired resistance to osimertinib given initially or at relapse in patients with EGFR-mutant lung cancers. J Clin Oncol 37, 2019 (suppl; abstr 9028)
- Hochmair MJ et al., Afatinib followed by osimertinib in patients with EGFR mutation-positive advanced NSCLC: updated data from the GioTag real-world study. ESMO 2019, abstract 1532P
- Brückl W et al., Sequential treatment with afatinib followed by 3rd generation EGFR-TKI: subgroup analysis of the GIDEON trial – a prospective non-interventional study in EGFR-mutated NSCLC patients in Germany. ESMO 2019, abstract 1527P
- Mok T et al., Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017; 376: 629-640
- Girard N et al., TKIseq study: efficacy and burden of TKI sequence of first and second generation followed by osimertinib in non-small-cell lung cancer in the French real-world setting. ESMO 2019, abstract 1528P
- De Marinis F et al., Afatinib in EGFR TKI-naïve patients with EGFR mutation-positive NSCLC: interim analysis of a phase IIIb, multi-national, open-label study. ESMO 2019, abstract 1472P
- Sequist LV et al., Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327-3334
- Wu Y-L et al., Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15: 213-222
- Park K et al., Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17: 577-589
- De Marinis F et al., A combined analysis of two phase IIIb studies of afatinib in EGFR TKI-naïve patients with EGFR mutation-positive NSCLC. ESMO 2019, abstract 1474P
- Christopoulos P et al., Real-world implementation of sequential targeted therapies for EGFR-mutated NSCLC. ESMO 2019, abstract 1538P
More posts
即便是罕见的可操作驱动因子也至关重要
即便是罕见的可操作驱动因子也至关重要 Stephen Liu,MD, 美国华盛顿特区乔治城大学伦巴狄综合癌症中心 在NRG1定向治疗的临床评估方面,我们如今进展如何? N
CNS疾病不妨碍成功治疗
CNS疾病不妨碍成功治疗 诊断时的神经症状负荷影响生存 脑转移在约35 %的转移性NSCLC患者中有发生,并与多种神经症状以及不良预后相关[1]。然而,关于诊断时CNS病灶
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新
罕见突变ALK、ROS1、NTRK、NRG1条件下的创新 BFAST:基于血液的NGS作为独立测试 致癌基因定向治疗需要分子检测,但是众所周知,与组织收集和基于组织的测试有
探索抗血管生成药物与免疫疗法之间的协同作用
探索抗血管生成药物与免疫疗法之间的协同作用 在无可操作驱动突变的非鳞状晚期NSCLC的条件下,免疫检查点抑制剂治疗的出现导致新标准的实施。可以预计来自抗血管生成治疗的协同作
EGFR和血管生成靶向药物的前线组合
EGFR和血管生成靶向药物的前线组合 在未经治疗的EGFR突变肿瘤患者中,已显示向第一代EGFR TKI添加抗VEGF抗体贝伐珠单抗(bevacizumab)会引起PFS获
EGFR阳性肿瘤:多线中的最佳疗法问题
EGFR阳性肿瘤:多线中的最佳疗法问题 FLAURA:一线奥希替尼(osimertinib)的OS 在晚期EGFR阳性NSCLC患者中,EGFR酪氨酸激酶抑制剂(TKI)代