不断变化治疗格局中的EGFR靶向选择
Amivantamab+拉泽替尼(lazertinib)
正在晚期NSCLC患者中探索将amivantamab(一种同时靶向EGFR和MET的双特异性抗体)与有效的第三代EGFR TKI拉泽替尼组合使用。Amivantamab在携带激活和抗性突变的各类EGFR突变型NSCLC中已展现了临床活性[1],并且被FDA指定为具有外显子20插入的EGFR突变型NSCLC在铂类化疗进展后的突破性疗法。同样,拉泽替尼在具有激活EGFR突变、T790M耐药性突变和CNS疾病的NSCLC患者中被证明是有效的[2, 3]。与其他第三代EGFR抑制剂一样,拉泽替尼治疗的EGFR相关毒性(如皮疹和腹泻)发生率较低。假设这些药物的组合可能具有延迟或防止出现耐药性且不增加毒性的潜力。
在I期CHRYSALIS研究中,用amivantamab+拉泽替尼治疗患有转移性或不可切除EGFR突变型(即外显子19缺失或L858R突变)NSCLC的患者[4]。已发现推荐的II期剂量与每种药物单一疗法的推荐剂量相等:体重< 80 kg的患者为amivantamab 1,050 mg,体重≥ 80 kg的患者为1,400 mg,而拉泽替尼为240 mg。Amivantamab静脉给予,在第1周期中每周一次,在随后的周期中每两周一次,而拉泽替尼则每天口服一次。剂量递增和剂量扩展队列分别包含26名和65名患者;在剂量扩展队列中,有45名对奥西替尼耐药且化疗初治,而有20名未经治疗。在91名患者构成的总群组中,有37%在基线时具有脑转移。先前治疗线的数量范围为0至9。59%的患者接受了第一代或第二代EGFR TKI,而58%的患者接受了第三代TKI。
快速且持久的应答
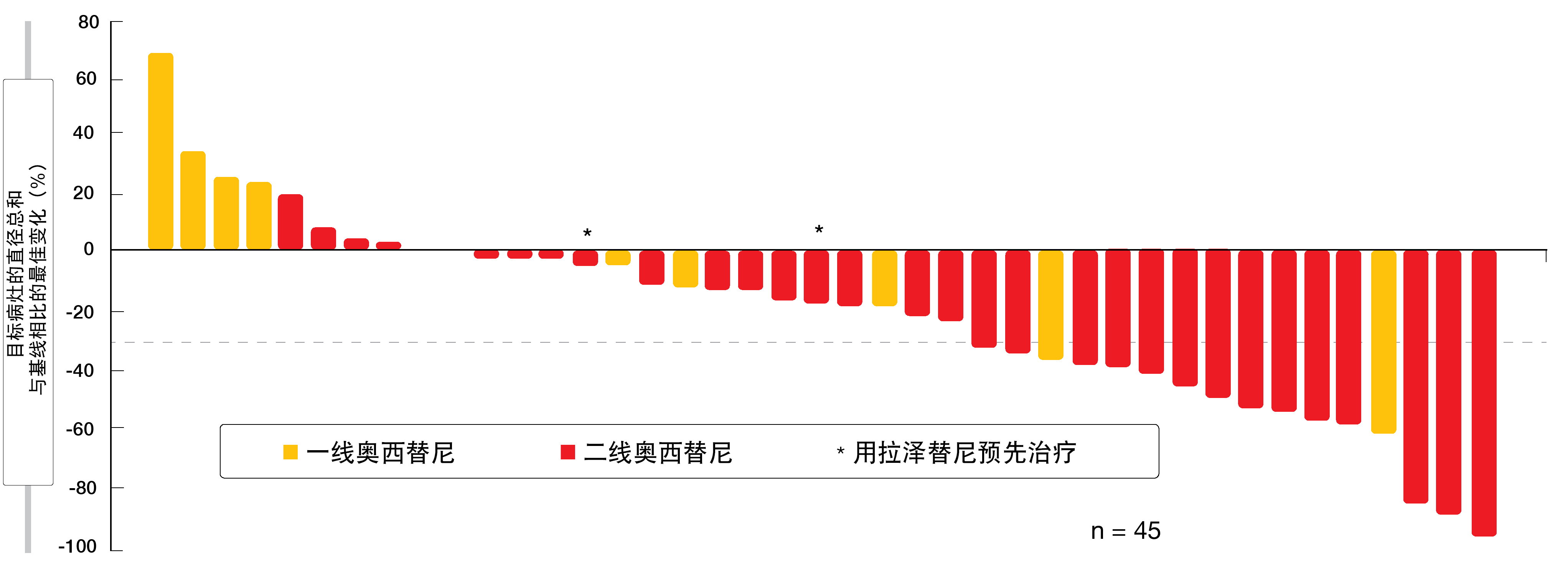
在对奥西替尼耐药且化疗初治的群体中,有36%的患者获得了ORR,其中分别有1名和15名获得了完全缓解和部分缓解。临床受益率为60%。不论使用奥西替尼的先前治疗线如何,均观察到了肿瘤消退,并且在先前接受拉泽替尼发生进展的患者中也发生了肿瘤消退(图1)。在大多数情况下都出现缓解。该群组的生物标志物和CNS分析将在未来的会议上介绍。在治疗初治群组中,ORR和临床获益率均为100%。无论EGFR突变基因型如何,患者均表现出深度缓解。至首次应答的时间很短,中位数为1.5个月。中位随访7个月后,所有患者均在接受治疗。
Amivantamab和拉泽替尼的组合是安全且耐受性良好的。在剂量递增期间未发生剂量限制性毒性。AE主要为1级和2级;与治疗有关的严重AE和≥ 3级AE分别占6%和11%。正如预期的那样,最常见的事件是皮疹,发生率达85%,其次是输注相关反应(占65%)。输注相关反应大多在首次给药期间观察到,并没有引起治疗中止或剂量调整。AE导致剂量中断或减少一种或两种药物的情况均为19%。但是,必须停用一种或两种药物的情况仅占6%。在剂量递增、治疗初治和奥西替尼耐药/化疗初治的群组中,AE的发生率相似。
根据作者的结论,amivantamab 可以安全地与拉泽替尼联合使用,并且该组合对晚期EGFR突变型NSCLC患者有效。通过耐药机制对疗效进行的分析正在开展当中。评估amivantamab+拉泽替尼的新研究已经开始,其中包括III期MARIPOSA试验(NCT04487080),该试验正在比较与奥西替尼组合的一线使用。
图1: 在奥西替尼耐药的化疗初治患者中使用amivantamab+拉泽替尼的目标病灶变化
抗血管生成的组合伴侣:阿帕替尼(apatinib)
血管内皮生长因子受体(VEGFR)途径的阻断被证明可以增强EGFR TKI治疗的疗效[5]。因此,一项多中心、随机化、双盲、安慰剂对照的III期ACTIVE试验评估了EGFR TKI吉非替尼(gefitinib)与口服小分子VEGFR2 TKI阿帕替尼联合作为晚期肺癌的一线治疗[6]。在中国的30个地点,将化疗初治的局部晚期、转移性或复发性非鳞状EGFR阳性NSCLC患者随机分为每天500 mg阿帕替尼+250 mg吉非替尼(n = 157)或安慰剂+吉非替尼(n = 156)。
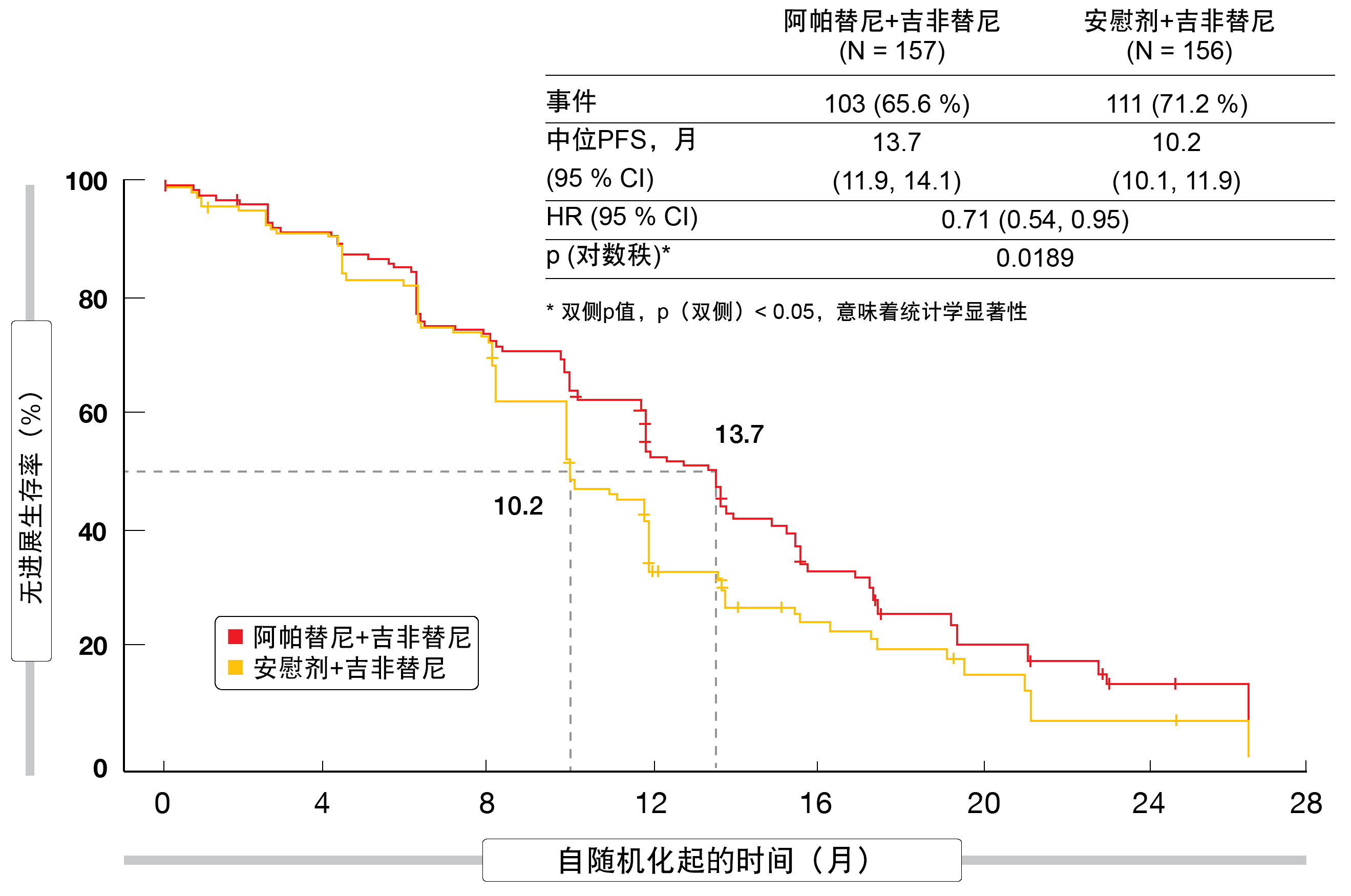
根据独立放射学审查委员会所得的PFS(构成主要终点)明显有利于该联合治疗(13.7与10.2个月;HR:0.71;p = 0.0189;图2)。几乎所有亚组都受益于VEGFR2 TKI的添加。研究组在ORR(77.1%与73.7%)或DCR(84.7%与87.8%)方面没有差异,但阿帕替尼+吉非替尼明显改善了≥30%的缓解深度(89.2%与79.5%;p = 0.0209)和≥50%的缓解深度(64.3%与52.6%;p = 0.0238)。同样,实验组的缓解持续时间更长(12.9与9.3个月;HR:0.64;p = 0.005)。阿帕替尼+吉非替尼总体耐受良好,毒性可控。由于治疗期AE(TEAE)而导致的任何药物剂量中断的发生率分别为59.9%和22.7%,必须降低剂量的比例为48.4%和4.5%。但是,由于TEAE而中断治疗的情况在联合治疗组中只有5.1%(对照组为3.2%)。未发现超出每个药物已建立的安全特性之外的任何意外安全性信号。
在145名患者中进行的生物标志物分析(实验组和对照组分别有73和72名)显示,具有TP53外显子8突变的患者(HR:0.24)比具有TP53非外显子8突变的患者(HR:0.79)更加受益于阿帕替尼+吉非替尼。没有TP53突变的患者没有经历任何PFS延长(HR:0.92)。但是,由于样本量小,需要大型研究来证实这一观察结果。对于EGFR外显子19缺失和外显子21 L858R突变也观察到类似的PFS获益(HR分别为0.67和0.72)。耐药性生物标志物分析显示,两个研究组中的患者均出现了相似的T790M耐药性模式,T790M阳性率分别为37.8%和37.0%。作者在其总结中指出,阿帕替尼+吉非替尼可能成为晚期EGFR突变型NSCLC的新的一线选择。这种双口服方案可为需要长期疗法的患者提供便利的治疗。
图2: 阿帕替尼+吉非替尼相比于安慰剂+吉非替尼的优效无进展生存率(%)
奥西替尼+贝伐单抗(bevacizumab)没有益处
T790突变型NSCLC的标准选择——第三代EGFR TKI奥西替尼与抗VEGF抗体贝伐单抗联合使用所产生的效果较差。随机化II期WJOG8715L研究在获得T790M突变的晚期EGFR-TKI耐药型肺腺癌患者中比较了奥西替尼80 mg/天+贝伐单抗15 mg/kg Q3W(n = 40)与奥西替尼80 mg/天(n = 41)。
根据在ESMO 2020上介绍的该试验的初步分析,组合未能改善被定义为主要终点的PFS(9.4与13.5个月;HR:1.44;p = 0.20)[7]。亚组分析的结果证实了缺乏疗效。在先前接受抗VEGF疗法的患者中,奥西替尼+贝伐单抗组合的PFS甚至比其他方案(没有抗VEGF预治疗的奥西替尼+贝伐单抗,有和没有抗VEGF史的奥西替尼单一疗法)更短。组合组的ORR高于奥西替尼单一疗法组(71.8%与55.0%),而研究组之间的至治疗失败时间或OS没有明显差异。同时,在实验组中,蛋白尿和高血压等AE的发生频率也更高。
抗体药物偶联物patritumab deruxtecan
HER3在约80% EGFR突变型肺癌中表达,并且过表达与较差的临床结果相关[8]。一项I期研究在具有转移性或不可切除EGFR突变型NSCLC的患者中测试了研究性的HER3定向抗体药物缀合物patritumab deruxtecan(U3-1402)。剂量递增部分包括12名患者,这些患者在奥西替尼治疗后进展或在厄洛替尼(erlotinib)、吉非替尼或阿法替尼治疗发生进展后为T790M阴性。在剂量扩展队列(n = 45)中,对经历≥ 1 EGFR TKI和≥ 1铂类化疗的患者进行了治疗。两个队列均以推荐的II期推荐剂量5.6 mg/kg Q3W接受patritumab deruxtecan。
Yu人介绍了合并队列的最新发现[9]。这是一个经过大量预治疗的群体,中位4条先前治疗线。在纳入研究之前,86%接受过奥西替尼治疗。90%曾接受铂类化疗,40%曾接受抗PD-(L)-1药物。由于允许有无症状的稳定脑部病变,47%存在CNS转移史。未针对HER3表达来选择患者,不过在开始研究治疗之前收集了肿瘤组织用于回顾性分析。该分析显示大多数患者具有HER3表达迹象。
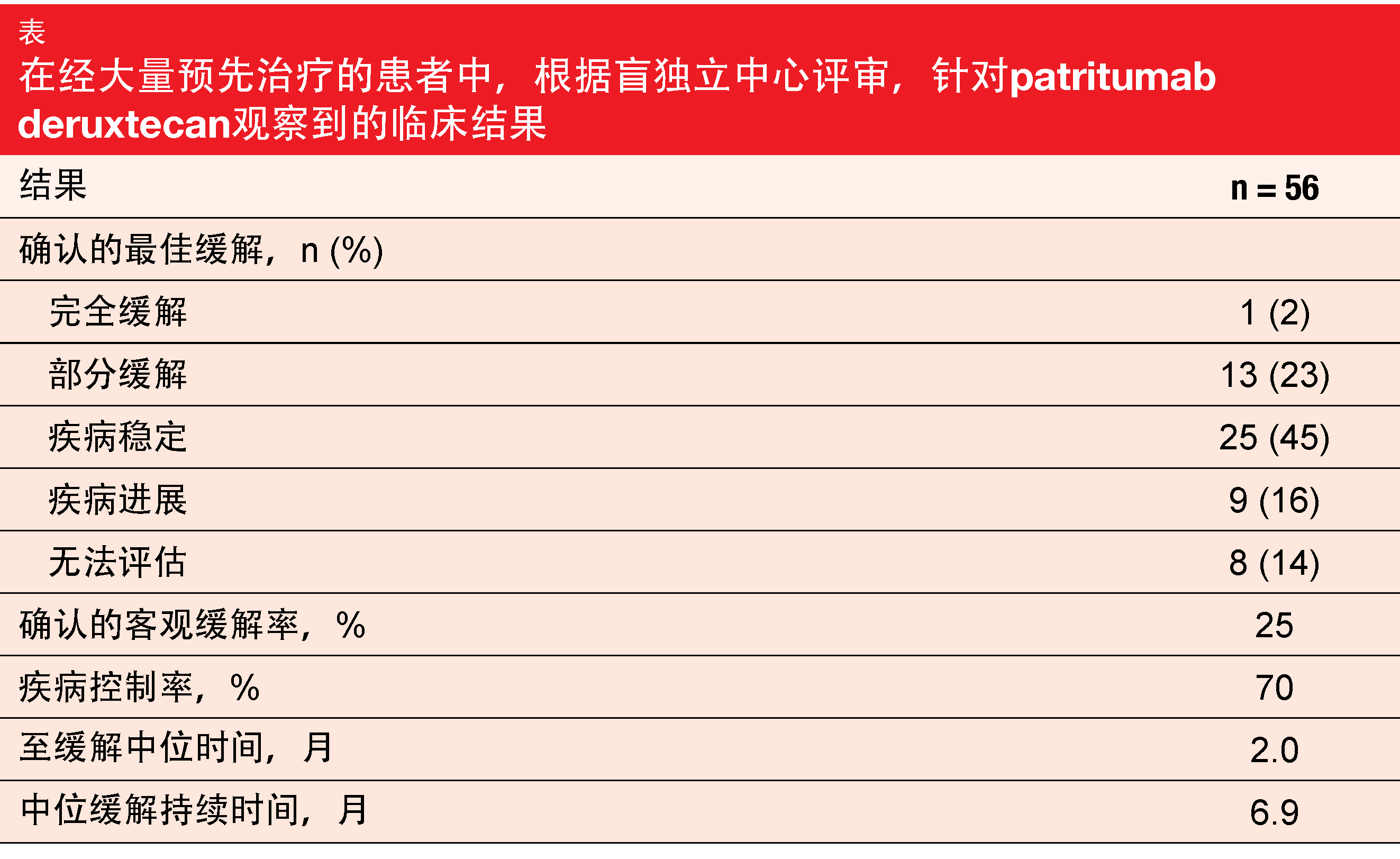
有56名患者的应答可评估。在中位随访5个月后,确认的ORR为25%,其中不包括3名尚待确认的部分缓解(表)。一名患者(2%)完全缓解。疾病控制率为70%。应答在早期出现,大多数患者经历了一定程度的肿瘤缩小。根据对血浆或肿瘤组织的新一代测序,在具有多种耐药机制的患者中出现了具有临床意义的抗肿瘤活性;这包括在具有EGFR C797S突变、MET扩增、HER2扩增、BRAF融合和PIK3CA突变的患者中确认的部分缓解。中位PFS数据尚未成熟。
Patritumab deruxtecan 5.6 mg/kg继续显示出可控的安全特性。最常见的≥ 3级TEAE是血小板减少症和中性粒细胞减少症,不过没有患者因这些毒性而终止治疗。报道了三例间质性肺疾病(5.3%)。大多数TEAE对减少剂量和中断治疗应答良好。总体而言,这些数据支持在没有可用的靶向疗法选择的患者群体中对patritumab deruxtecan进行进一步临床研究。在EGFR TKI和铂类化疗失败后的患者中考察单药patritumab deruxtecan的II期研究计划于2021年初开始。
低剂量阿法替尼的评估
尽管阿法替尼对于EGFR阳性NSCLC患者是一种有效的治疗选择,但其毒性(尤其是指甲和皮肤AE以及腹泻)通常需要调整剂量。基于从治疗开始就降低剂量可能有助于提高疗效和安全性的假设,Noro等人进行了一项多中心、单臂、开放标签的II期临床试验,在患有携带常见EGFR突变的晚期NSCLC的治疗初治患者中评估了每日20 mg 阿法替尼[10]。在8周时显示完全或部分缓解或疾病稳定且无肿瘤生长的患者继续采用20 mg剂量,而在具有肿瘤生长的患者中,剂量递增到每天30 mg或40 mg。当剂量增加后发生与药物相关的≥ 2 AE时,以10 mg为增量进行降低。在治疗开始后第9天和疾病进展时测量阿法替尼血浆浓度。在日本的21家机构中招募了53名患者。
66.0%(n = 35)实现了部分缓解。这些患者中有30名(56.6%)一直保持20 mg的剂量,有五名患者(9.4%)的时间表减少为每隔一天20 mg。在达到稳定疾病的群组中(n = 14,占26.4%),分别对4名(7.5%)和2名(3.8%)患者进行了剂量递增至30 mg和40 mg。8名患者继续采用20 mg剂量。3名(5.7%)发生了疾病进展,且一名患者无法评估。总体而言,阿法替尼20 mg的疾病控制率为92.5%。中位PFS和至治疗失败时间分别为12.6个月和9.7个月。在分析时尚未达到中位OS。
≥ 3级AE发生在12名患者中(22.6%),其中4名出现腹泻(7.5%)。该水平低于在采用阿法替尼40 mg的III期条件下观察到的≥ 3级AE和腹泻的发生率(分别为49%和14.4%)[11]。治疗开始后第9天的阿法替尼血浆浓度与ORR或至治疗失败时间、表现状态、吸烟、临床分期或包括腹泻在内的AE无关。注意到唯一明显的相关性是对于EGFR突变状态,在外显子19缺失组中,与L858R突变队列相比,血浆浓度更高(p = 0.03)。即使在平均浓度为11.4 ng/ml的低血浆浓度下也可以实现临床活性。作者指出,基于这些发现,可以考虑将阿法替尼20 mg作为EGFR突变型NSCLC患者的标准疗法。
EGFR TKI疗法在欧洲的使用
回顾性的多国研究REFLECT在奥地利、保加利亚、希腊、以色列、波兰、罗马尼亚、斯洛文尼亚和瑞士使用第一代和第二代药物作为一线EGFR TKI疗法的背景下评估了治疗和测试模式以及结果和流失率[12]。总体而言,分析纳入了在2015年1月1日至2018年6月30日之间开始使用阿法替尼、吉非替尼或厄洛替尼治疗的896名局部晚期或转移性EGFR突变型NSCLC患者。REFLECT是研究在欧洲患者中进行的第一代或第二代EGFR TKI一线治疗的最大流失率研究之一。
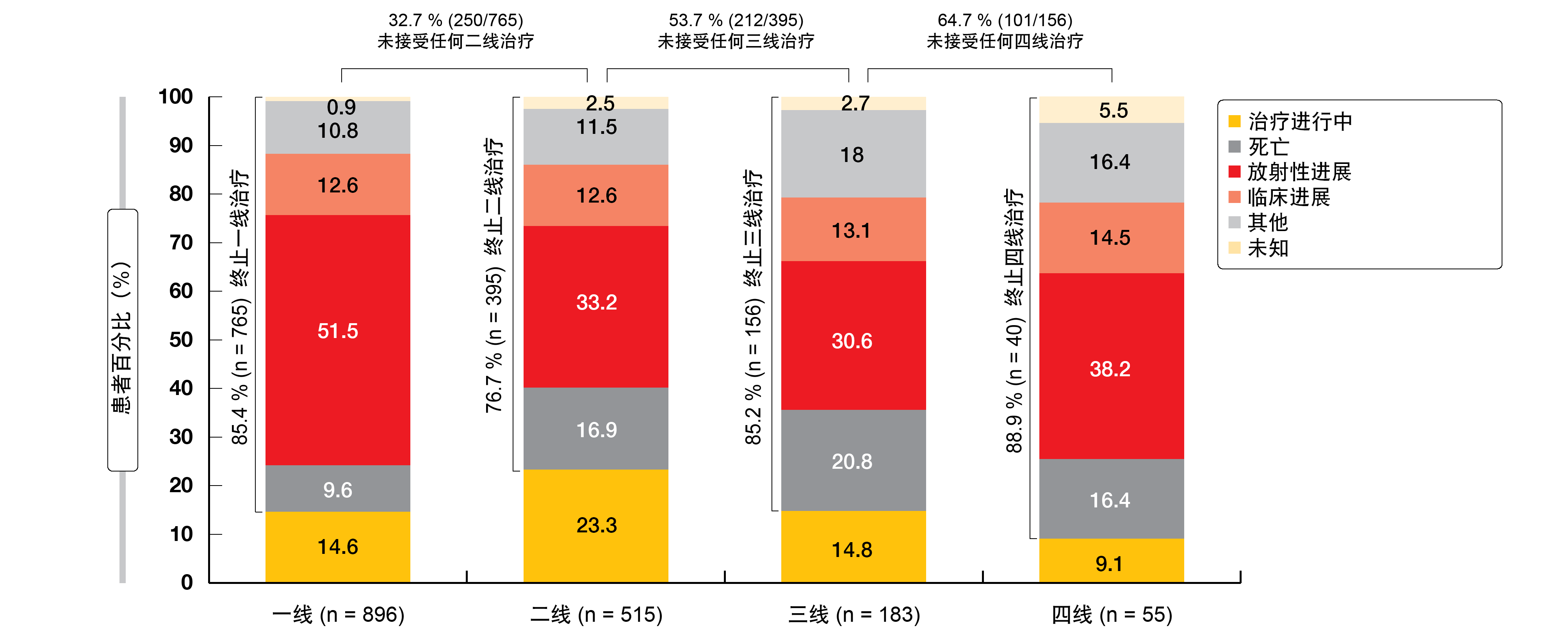
分别在45.4%、27.3%和27.2%的患者中给予阿法替尼、厄洛替尼和吉非替尼。在收集数据时,有85.4%的患者已中止治疗。一线的中位停药时间为12.6个月。放射学进展是所有治疗线中治疗中止的主要原因,其中未接受任何下一线治疗的患者的比例越来越高(图3)。对于一线EGFR TKI进展的患者(n = 723)中,仅检测到513(71.0%)名存在T790M耐药性突变。在这些患者的58.3%中发现突变。在任何后续线(主要是二线)中,向已确认T790M突变的患者中的94.6%处方开具奥西替尼。此外,在任何后续线中,有41名(18.5%)T790M测试结果阴性的患者使用奥西替尼,并且有15名(6.2%)未进行T790M测试的患者使用奥西替尼。
从一线EGFR TKI疗法开始的中位PFS和OS分别为13.0和26.2个月。正如作者在其总结中所指出,这项研究表明,用第一代和第二代EGFR TKI治疗的EGFR突变型NSCLC患者的生存率欠佳。为了改善结果,迫切需要更好地了解EGFR TKI的有效使用。然而,在第三代EGFR TKI奥西替尼获得批准一线使用后,治疗格局有望发生改变,但需等待进一步的现实证据。
图3: REFLECT研究的流失率和四条治疗线中治疗中止的原因
参考文献
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Ahn MJ et al., Lazertinib in patients with EGFR mutation-positive advanced non-small-cell lung cancer: results from the dose escalation and dose expansion parts of a first-in-human, open-label, multicentre, phase 1-2 study. Lancet Oncol 2020; 20(21): 1681-1690
- Kim SW et al., Intracranial anti-tumor activity of lazertinib in patients with advanced NSCLC who progressed after prior EGFR TKI therapy: Data from a phase I/II study. J Clin Oncol 38: 2020 (suppl; abstr 9571)
- Cho BC et al., Amivantamab (JNJ-61186372), an EGFR-MET bispecific antibody, in combination with lazertinib, a third-generation EGFR tyrosine kinase inhibitor, in advanced EGFR-mutant NSCLC. ESMO 2020, 1258O
- Larsen AK et al., Targeting EGFR and VEGF(R) pathway cross-talk in tumor survival and angiogenesis. Pharmacol Ther 2011; 131(1): 80-90
- Zhang L et al., ACTIVE: apatinib plus gefitinib versus placebo plus gefitinib as first-line treatment for advanced epidermal growth factor receptor-mutant non-small-cell lung cancer: a multicenter, randomized, double-blind, placebo-controlled phase III trial (CTONG1706). ESMO 2020, LBA50
- Toi Y et al., A randomized phase II study of osimertinib with or without bevacizumab in advanced lung adenocarcinoma patients with EGFR T790M mutation. ESMO 2020, 1259O
- Tan CS et al., Third generation EGFR TKIs: current data and future directions. Mol Cancer 2018; 17(1): 29
- Yu HA et al., Efficacy and safety of patritumab deruxtecan (U3-1402), a novel HER2 directed antibody drug conjugate, in patients with EGFR-mutated NSCLC. ESMO 2020, LBA62
- Noro R et al., A prospective, phase II trial of low-dose afatinib monotherapy for patients with EGFR mutation-positive non-small cell lung cancer (TORG1632). ESMO 2020, 1365P
- Kato T et al., Afatinib versus cisplatin plus pemetrexed in Japanese patients with advanced non-small cell lung cancer harboring activating EGFR mutations: Subgroup analysis of LUX-Lung 3. Cancer Sci 2015; 106(9): 1202-1211
- Addeo A et al., Real-world treatment patterns, clinical outcomes and EGFR/T790M testing practices in patients with EGFR-mutated advanced NSCLC and 1L EGFR TKI therapy – a retrospective multinational study (REFLECT). ESMO 2020, 1299P
© 2020 Springer-Verlag GmbH, Impressum