免疫检查点抑制:无化疗方案&新PD-1抑制剂即将出现
单药疗法与化疗
KEYNOTE-024的五年进展
在KEYNOTE-024试验中,已显示出在转移性非小细胞肺癌(NSCLC)和PD-L1肿瘤比例评分(TPS) ≥ 50%的患者中,派姆单抗(pembrolizumab)作为单药治疗长达35个周期优于4至6个周期的含铂双药化疗。在11.2个月的中位随访时间时,中位无进展生存时间(PFS)为10.3与6.0个月(HR,0.50;p < 0.001),并且任一组尚未达到中位总体生存期(OS),其中6个月时80.2%与72.4%的患者存活(HR,0.60;p = 0.005)[1]。在2020年ESMO大会上,Brahmer等人报告了随访5年后的进展结果[2]。分别对154名和151名患者施用了派姆单抗和化疗。对接受全部35个派姆单抗周期的39名患者组进行了单独分析,同样也对在进展时使用第二个疗程的派姆单抗进行治疗的12名患者进行了单独分析。
派姆单抗继续在总组中引起有意义的OS改善(26.3与13.4个月;HR,0.62)。尽管有66%的有效交叉率,但5年OS率在实验组中大约翻了一番(31.9%与16.3%)。中位PFS分别为7.7个月和5.5个月,其中22.8%和4.1%的患者在36个月时无进展。客观缓解发生率分别为46.1%和31.1%。7名接受派姆单抗治疗的患者(4.5%)完全缓解(与化疗组的0%)。缓解持续时间为29.1与6.3个月。接受了35个周期的派姆单抗的39名患者组获得了长期OS。数据截止时,尚有46%的患者在没有疾病进展或后续治疗的情况下存活。治疗完成起的三年OS率为81%,客观缓解发生率为82%。四名患者(10%)显示出完全缓解。一名患者发生了继发性恶性肿瘤并接受了相关治疗。
此外,第二疗程派姆单抗证明可行并且与抗肿瘤活性有关。在此,第二疗程期间的客观缓解率(ORR)达到33%,并且有42%的患者在数据截止时存活而没有疾病进展。这些患者当中的25%没有接受后续治疗。长期给药并未引起新的安全性信号。与对照组相比,实验组患者发生与任何等级和3至5级治疗相关的AE的频率均较低。总体而言,这些数据证实了单臂KEYNOTE-001研究[3]中包括的先前未接受治疗的患者中的5年OS结果。KEYNOTE-024是首个显示一线免疫疗法5年疗效的III期试验,表明派姆单抗单药疗法在转移性NSyCLC和PD-L1 TPS ≥ 50%的患者中是积极的一线方案。
西米普利单抗(cemiplimab)治疗肺癌:EMPOWER-Lung 1
抗PD-1抗体西米普利单抗是一线单药疗法的一种新选择,该药已被广泛批准用于治疗皮肤鳞状细胞癌。Sezer等人介绍了随机III期EMPOWER-Lung 1研究的第二次预先指定的中期分析,该研究根据研究者的选择,在未经治疗的晚期NSCLC和PD-L1表达≥ 50%的患者中比较了西米普利单抗单药疗法与含铂双药化疗[4]。在ITT人群中,随机分配356名和354名患者分别接受三周一次(Q3W)西米普利单抗350 mg和4至6个周期的化疗。 PD-L1 ≥ 50% ITT人群包括563名患者,其中分别有283名和280名接受西米普利单抗和化疗。OS和PFS被定义为共同主要终点。
EMPOWER-Lung 1达到了其主要和次要终点。在PD-L1 ≥ 50% ITT人群中,死亡率风险降低了43%(中位OS,未达到与14.2个月;HR,0.57;p = 0.0002),进展和死亡的风险降低了46%(中位PFS,8.2与5.7个月;HR,0.54;p < 0.0001)。在12个月时,72.4%与53.9%的患者存活,40.7%与7.1%的患者无进展。尽管存在74%的高交叉率,但仍实现了显著的OS获益。ORR为39.2%与0.4%,在实验组中缓解持续时间更长(16.7与6.0个月)。在西米普利单抗治疗组中,PD-L1表达水平的提高与更好的结果相关。在目标肿瘤体积(图1)、ORR、OS和PFS的变化方面也是如此。化疗未见此类相关性。
在整体健康状况和与健康相关生活质量方面,西米普利单抗可引起早期改善,并随着时间的推移而增加,而接受化疗治疗的患者从一开始表现就更糟糕,最终恶化。尽管暴露于西米普利单抗的时间明显长于化疗,但对于PD-1抑制剂观察到有利的安全特性,其中血液学和非血液学不良事件(AE)的几率大幅降低。免疫相关AE导致2.5%的治疗终止。正如作者所总结,这些数据为晚期NSCLC和PD-L1表达≥ 50%的患者提供了理由,将西米普利单抗作为一线单药疗法的一种新选择。
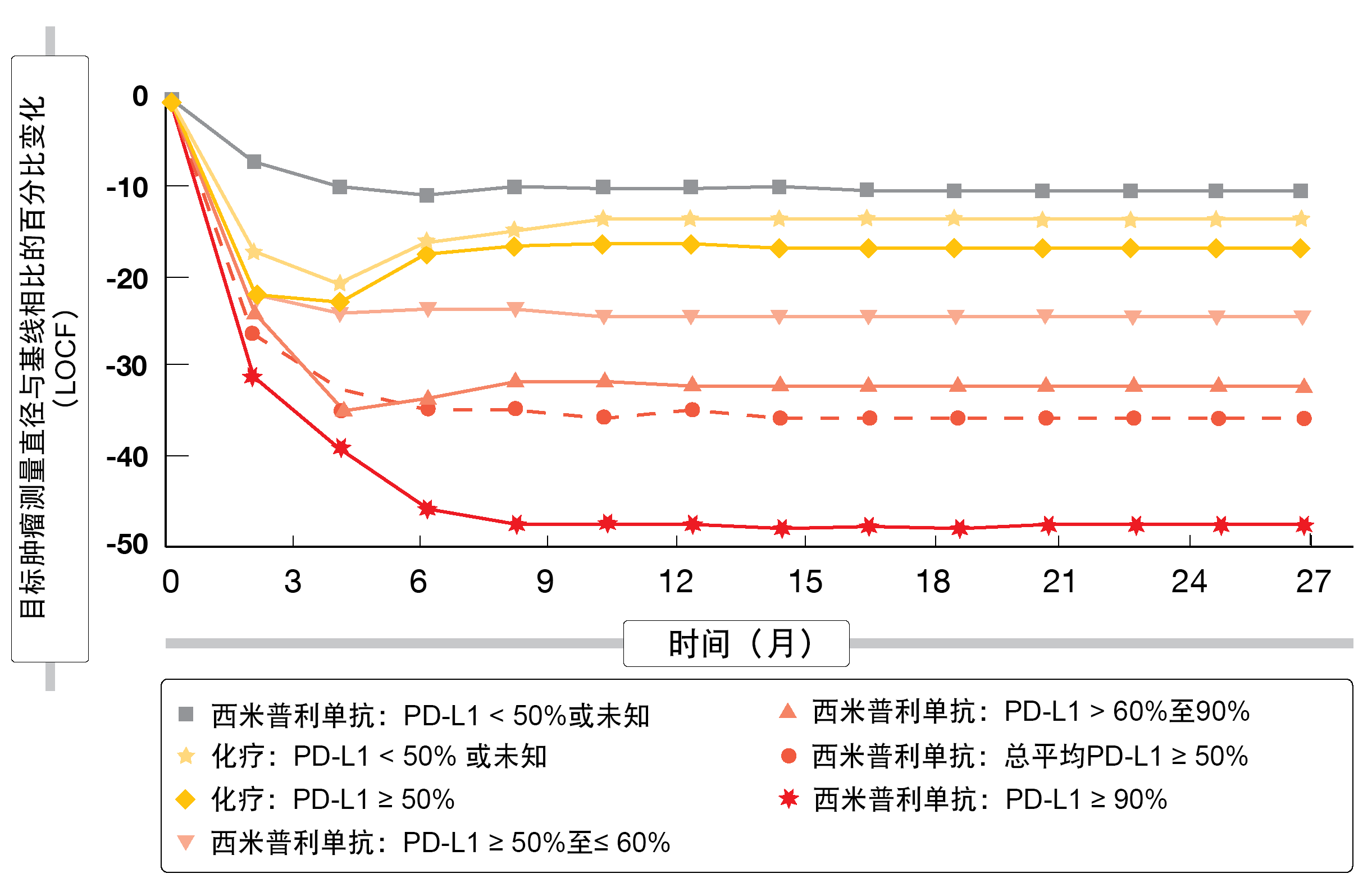
图1: 接受西米普利单抗或化疗的患者中目标肿瘤体积变化与基线PD-L1水平的相关性
免疫疗法加抗血管生成
基于纳武单抗(nivolumab)的方案
检查点抑制剂、细胞毒性化疗和抗血管生成治疗的联合疗法被认为能发挥协同作用。在IMpower150研究中,阿特珠单抗(atezolizumab)已显示出与化疗药物和贝伐珠单抗(bevacizumab)一起作为晚期NSCLC患者的一线疗法的疗效[5]。因此,随机化III期ONO-4538-52/TASUKI-52试验在患有IIIB/IV期非鳞状NSCLC的初治PD-L1全人群中评估了纳武单抗360 mg Q3W加卡铂/紫杉醇(paclitaxel)和贝伐珠单抗。在对照组中,除化疗双药和贝伐珠单抗外还施用安慰剂。每组包含275名患者。
关于被定义为主要终点的PFS,在2020年ESMO上介绍的中期分析表明了基于纳武单抗方案的优越性(12.1与8.1个月;HR,0.56;p < 0.0001)[6]。两组的12个月PFS率分别为50.1%和30.2%。几乎所有亚组都通过添加纳武单抗获得了PFS获益。值得注意的是,PD-L1表达不影响结果。但是,两组间中位OS无差异(25.4与24.7个月;HR,0.85)。在实验组中未检测到新的安全性信号。作者指出,在一线化疗和贝伐珠单抗的基础上加入纳武单抗引起显著和具有临床意义的PFS改善,为这些患者提供了潜在的新护理标准。
阿特珠单抗加贝伐珠单抗
在PD-L1高表达的患者中,阿特珠单抗加贝伐珠单抗的无化疗方案可能足以引起实质性疗效。II期、单臂、开放标签、多机构的WJOG @Be研究在未经治疗的晚期非鳞状NSCLC和PD-L1 TPS ≥ 50%的39名患者人群中对该组合进行了测试[7]。以1200 mg的剂量将阿特珠单抗与贝伐珠单抗15 mg/kg Q3W一起施用长达2年。ORR构成主要结果。
总体而言,有64.1%的患者出现了完全或部分缓解,几乎所有患者均经历肿瘤缩小(图2)。中位PFS为15.9个月。在12个月时,70.6%的患者存活,48.2%的患者显示出缓解,并且54.9%的患者无进展。中位缓解持续时间为10.4个月。在数据截止时,一半的患者人群仍在接受研究治疗。没有发生意外的AE,也没有观察到4/5级事件。两名患者由于毒性而终止治疗。由于需要确证证据,将在3臂III期@Be-F1rst研究中将阿特珠单抗加贝伐珠单抗与IMpower150方案和阿特珠单抗单药疗法进行比较。
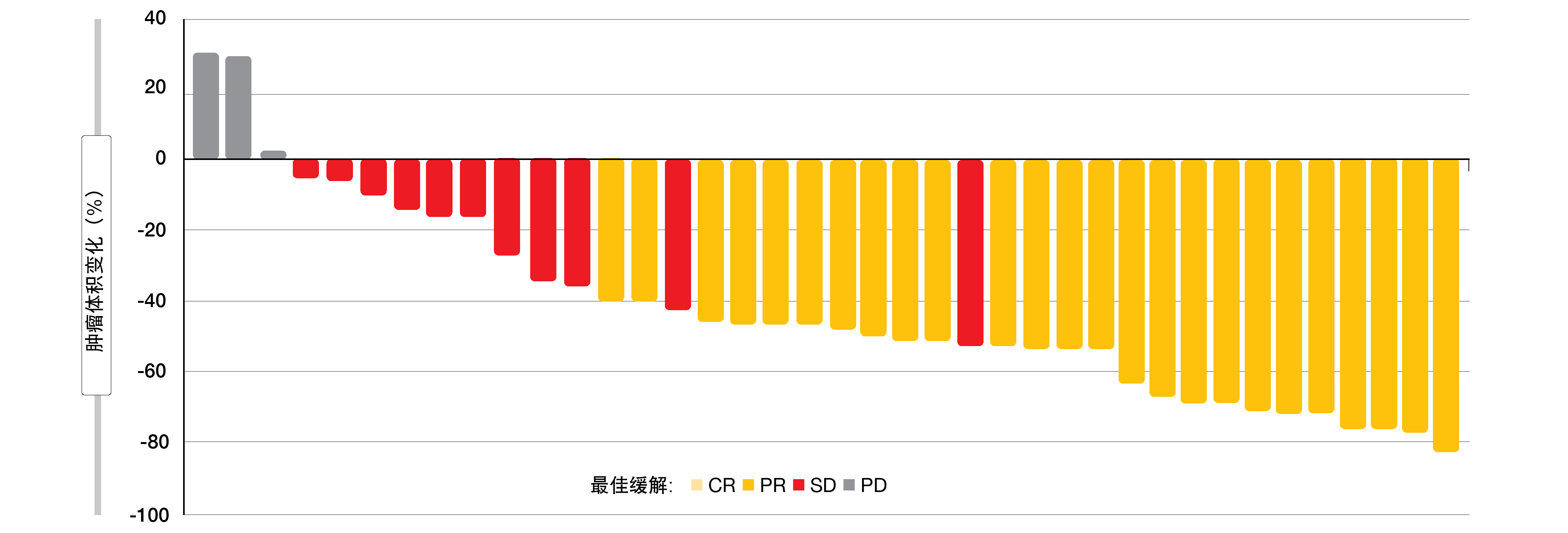
图2: 阿特珠单抗加贝伐珠单抗:几乎所有患者的肿瘤缩小
新出现PD-1抑制剂的III期结果
替雷利珠单抗 (tislelizumab): 关键的III期研究
新的PD-1抑制剂正在开发中,其中替雷利珠单抗被设计用于最大程度地减少与巨噬细胞上FcγR的结合。这种机制消除了作为T细胞清除和对抗-PD-1疗法产生抗性的潜在机制的抗体依赖性吞噬作用[8,9]。三项早期研究(BGB-A317-001、BGB-A317-102、BGB-A317-206)表明,替雷利珠单抗作为单药和与化疗联合使用,在患有包括晚期肺癌在内的实体瘤的亚洲和非亚洲人群中通常耐受性良好并表现出抗肿瘤活性[10-12]。在III期条件中,开放标签、多中心、随机化RATIONALE 304研究调查了替雷利珠单抗200 mg Q3W联合培美曲塞(pemetrexed)加顺铂或卡铂(n = 223)与单独化疗(n = 111)作为IIIB/IV期非鳞状NSCLC患者的一线治疗的情况[13]。在包括4-6个周期的诱导后,维持阶段包括实验组每三周一次替雷利珠单抗 200 mg加培美曲塞500 mg/m2治疗,而对照组为培美曲塞单药疗法。中国有47个站点参与了该试验。
添加替雷利珠单抗带来了PFS的显著改善(9.7与7.6个月; HR,0.645;p = 0.0044;图3),以及更高的ORR(57.4%与36.9%)和更长的缓解持续时间(8.5与6.0个月)。在大多数预先指定的亚组中观察到一致的PFS益处。任一组均尚未达到中位OS。基于替雷利珠单抗的方案一般耐受良好,其中大多数AE为轻度或中度且可控。最常报告的是血细胞减少症,其次是恶心和转氨酶升高。实验组中有25.7%的患者发生了免疫介导的AE,主要包括肺炎(9.0%)、甲状腺功能低下(8.6%)和甲状腺功能亢进(2.7%)。就严重性而言其中大多数为轻度至中度。总体而言,这些发现支持替雷利珠单抗与铂类双药化疗联合使用作为晚期非鳞状NSCLC患者的潜在新标准一线治疗。

图3: 替雷利珠单抗加化疗与化疗相比的无进展生存率
鳞状NSCLC中的活性
在中国进行的关键性、开放标签、三臂、III期RATIONALE 307试验在IIIB/IV期鳞状NSCLC患者中测试了将替雷利珠单抗添加到紫杉醇/卡铂或纳布紫杉醇/卡铂。在ASCO 2020大会上介绍的结果表明,与单独化疗相比,替雷利珠单抗加化疗Q3W带来显著改善的PFS、ORR和缓解持续时间[14]。2020年ESMO大会上报告了该研究的进展分析,包括对血液肿瘤突变负荷(bTMB)临床意义的评估[15]。
替雷利珠单抗加紫杉醇/卡铂(A组)和替雷利珠单抗加纳布紫杉醇/卡铂(B组)的中位PFS均为7.6个月,因此显著优于使用紫杉醇/卡铂(C组; 5.5个月)获得的PFS,其中风险降低约50%(分别为HR,0.524;p = 0.0001和HR,0.478;p < 0.0001)。在两种替雷利珠单抗类方案中观察到的PFS益处在包括PD-L1表达队列在内的所有亚组中均一致。A组和B组的ORR分别为73%和75%,而C组则为50%。替雷利珠单抗加化疗引起的缓解率更高,而与PD-L1表达状态无关。中位OS尚未达到。
对bTMB的探索性分析表明,在bTMB高(即≥ 6个突变/ Mb)和bTMB低(< 6个突变/ Mb)状态的患者中,替雷利珠单抗加疗与化疗相比表现出了ORR和PFS益处。根据互动分析,bTMB作为替雷利珠单抗加化疗组中PFS预测标志物的临床效用似乎有限。包括≥ 3级事件在内的治疗突发AE(TEAE)的发生率在组间是相似的。大多数AE为轻度或中度且可控。作者总结认为,在鳞状癌肺癌患者中获得的这些结果解决了一个高度未满足的需求。数据支持替雷利珠单抗加紫杉醇/卡铂或纳布紫杉醇/卡铂作为晚期鳞状NSCLC一线治疗的潜在标准。
ORIENT试验:信迪利单抗(sintilimab)
信迪利单抗,另一种新的抗PD-1抗体,也在鳞状和非鳞状NSCLC中在III期条件下进行了评估。在具有鳞状组织学的晚期肺癌患者中,随机、双盲、III期ORIENT-12试验证明使用一线信迪利单抗加吉西他滨(gemcitabine)和顺铂或卡铂的有利结果[16]。不适于手术/局部治疗的IIIB/C期疾病或IV期疾病患者参与了研究,而无论其PD-L1表达状态。患者被随机分配为接受信迪利单抗加化疗(n = 179)或安慰剂加化疗(n = 178)4或6个周期。根据独立放射学审查委员会的PFS被定义为主要终点。
与单独化疗相比,该组合显著改善了PFS(5.5与4.9个月; HR,0.536;p < 0.00001)。OS尚不成熟,尽管初步结果表明实验组具有优势(HR,0.567;p = 0.01701)。44.7%与35.4%的患者出现客观缓解,86.0%与80.3%的患者达到疾病控制。两种方案在TEAE、3到5级TEAE和导致治疗中断或放弃的AE方面没有差异。
随机化III期ORIENT-11研究已经确立了,在晚期非鳞状NSCLC患者中,信迪利单抗加化疗(培美曲塞和顺铂或卡铂)相对于安慰剂加化疗的优效性[17]。两种方案的中位PFS分别为8.9个月与5.0个月(HR,0.482)。在2020年ESMO上介绍的分析中,Yang等人确认主要组织相容性复合物(MHC)-II抗原呈递途径对该组合的活性具有预测性[18]。该途径的特征评分与临床疗效显著相关,代表性基因如HLA-B、HLA-DMB、B2M和CIITA亦是如此。
推动对预测性生物标志物的了解
PIONeer项目
一线和二线患者中,分别约有30%和50%在开始免疫检查点抑制后的前6个月内发生进展。鉴于缺乏预测这些事件的生物标志物,PIONeer项目致力于提高对晚期NSCLC患者PD-(L)1靶向治疗的耐受性的理解和预测。该项目由PIONeeR生物标志物研究和PIONeeR雨伞试验组成,PIONeeR雨伞试验测试将各种靶向抑制剂与度伐鲁单抗(durvalumab)的联合。 Barlesi等人介绍了PIONeeR生物标志物研究的前100名患者的结果[19]。
在一线和二线条件下接受PD-(L)1抑制剂单药治疗或联合化疗的晚期NSCLC患者中,在治疗开始前和6周时再次进行活检。生物标志物计划包括400多个生物标志物。这些生物标志物涉及药物反应(药代动力学[PK]/药效动力学[PD]建模)、免疫细胞浸润、对免疫效应物的敏感性(即免疫基因表达特征)、免疫检查点、免疫抑制和肿瘤异质性(例如TMB)。而且,外周标志物包括循环免疫细胞、可溶性标志物、内皮标志物、ctDNA和微生物组。
在被纳入PIONeeR项目生物标志物部分的前100名患者中,绝大多数人接受了二线治疗(87%)。如所预期的,ORR为13%,中位PFS和OS分别为3.0个月和11.0个月。科学家们分析了某些临床特征和生物标志物对这些临床终点的预测能力。临床特征均未显示出与客观缓解概率有显著关联,尽管有几种生物标志物显示出了显著关联(例如,PD-L1阳性肿瘤细胞百分比、肿瘤中细胞毒性T细胞CD3+/CD8+密度、肿瘤中有效T细胞密度、基质中调节性T细胞密度的治疗前水平)。6周时,与无缓解者相比,有缓解患者中浸润基质的中性粒细胞数量也有所增加。
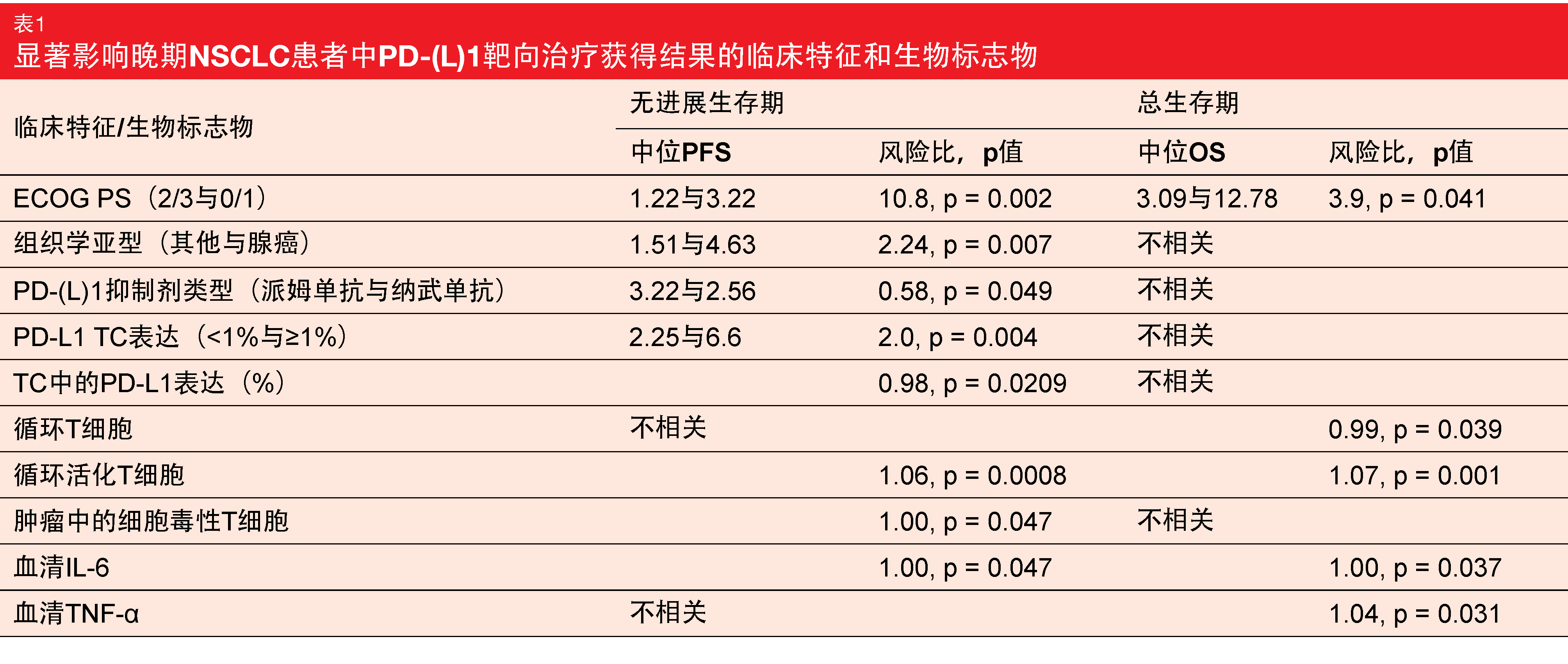
PS仍然是最有力的预测因素
对于PFS,发现与ECOG表现状态、组织学亚型、治疗类型和肿瘤细胞的PD-L1表达有显著相关性(表)。在生物标志物水平上,与肿瘤细胞的PD- L1表达、循环活化T细胞、血清IL-6和肿瘤中的细胞毒性T细胞有关联。在OS方面,唯一相关的临床特征是ECOG PS。在生物标志物中,循环T细胞与生存概率相关,与循环活化细胞、血清IL-6和血清TNF-α也相关。
肿瘤中PD-L1阳性细胞密度在治疗无缓解的患者标本中特别低,尽管PD-L1在肿瘤细胞上的表达量大于15%。此外,当提供的截止值为546个细胞/mm2时,所有细胞类型(即肿瘤和基质细胞)上的PD-L1阳性细胞密度与OS显示出强大的相关性。其他潜在的强有力生物标志物是肿瘤中和肿瘤-基质界面处的细胞毒性T细胞。
关于PK/PD参数,暴露于阿特珠单抗、派姆单抗和纳武单抗后的峰值和低谷水平都存在较大的患者间差异性。个体PK参数的确定和PK/PD模型的建立正在进行中。最后,正在评估治疗6周前后免疫谱的演变。这表明,所有的T细胞参数在治疗过程中都有所增加(即,肿瘤中的PD-L1阳性细胞密度、肿瘤中的细胞毒性T细胞密度、肿瘤中的CD8+-PD-L1+细胞邻近指数、肿瘤实质中的调节性T细胞、基质中的调节性T细胞、肿瘤中的耗竭性T细胞)。总体而言,PIONeeR 生物标志物证明ECOG表现状态仍是OS最强有力的预测指标,并提示PD-L1肿瘤表达(尽管PD-L1阳性细胞密度可能更优)、肿瘤中细胞毒性T细胞密度、免疫抑制细胞(如T调节细胞和骨髓衍生抑制细胞)密度的预测价值。该研究正在继续招募患者。附加分析将为设计“免疫图谱”提供进一步的数据,帮助推动晚期NSCLC患者的免疫疗法管理。
参考文献
- Reck M et al., Pembrolizumab versus chemotherapy for PD-L1–positive non–small-cell lung cancer. N Engl J Med 2016; 375: 1823-1833
- Brahmer J et al., KEYNOTE-024 5-year OS update: first-line pembrolizumab vs. platinum-based chemotherapy in patients with metastatic non-small-cell lung cancer and PD-L1 tumor proportion score ≥ 50 %. ESMO 2020, LBA51
- Garon EB et al., Five-year overall survival for patients with advanced non–small-cell lung cancer treated with pembrolizumab: results from the phase I KEYNOTE-001 Study. J Clin Oncol 2019; 37: 2518-2527
- Sezer A et al., EMPOWER-Lung 1: phase 3 first-line cemiplimab monotherapy vs. platinum-doublet chemotherapy in advanced non-small cell lung cancer with programmed cell death-ligand 1 ≥ 50%. ESMO 2020, LBA52
- Socinski MA et al., Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N Engl J Med 2018; 378(24): 2288-2301
- Lee JS et al., ONO-4538-52/TASUKI-52 – randomized phase III trial of nivolumab in combination with carboplatin, paclitaxel, and bevacizumab as first-line treatment for patients with advanced or recurrent non-squamous NSCLC. ESMO 2020, LBA54
- Seto T et al., WJOG @Be Study: a phase II study of atezolizumab with bevacizumab for non-squamous non-small-cell lung cancer with high PD-L1 expression. ESMO 2020, LBA55
- Zhang T et al., The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions. Cancer Immunol Immunother 2018; 67(7): 1079-1090
- Dahan R et al., FcγRs modulate the anti-tumor activity of antibodies targeting the PD-1/PD-L1 axis. Cancer Cell 2015; 28(3): 285-295
- Desai J et al., Phase IA/IB study of single-agent tislelizumab, an investigational anti-PD-1 antibody, in solid tumors. J Immunother Cancer 2020; 8(1): e000453
- Shen L et al., Tislelizumab in Chinese patients with advanced solid tumors: an open-label, non-comparative, phase 1/2 study. J Immunother Cancer 2020; 8(1): e000437
- Wang Z et al., A phase 2 study of tislelizumab in combination with platinum-based chemotherapy as first-line treatment for advanced lung cancer in Chinese patients. Lung Cancer 2020; 147: 259-268
- Lu S et al., Tislelizumab plus chemotherapy versus chemotherapy alone as first-line treatment for locally advanced/metastatic non-squamous NSCLC. ESMO 2020, 1263P
- Wang J et al., Phase III study of tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non-small cell lung cancer. J Clin Oncol 38: 2020 (suppl; abstr 9554)
- Wang J et al., Updated analysis of tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment of advanced squamous non-small cell lung cancer. ESMO 2020, 1264P
- Zhou C et al., ORIENT-12: sintilimab plus platinum/gemcitabine as first-line treatment for locally advanced or metastatic squamous non-small-cell lung cancer. ESMO 2020, LBA56
- Zhang L et al., ORIENT-11: sintilimab + pemetrexed + platinum as first-line therapy for locally advanced or metastatic non-squamous NSCLC. 2020 World Conference on Lung Cancer. Presidential Symposium, abstract 1
- Yang Y et al., MHC-II antigen presentation pathway as a predictive biomarker for sintilimab plus chemotherapy as first-line treatment of non-squamous NSCLC. ESMO 2020, LBA57
- Barlesi F et al., Precision immuno-oncology for advanced NSCLC patients treated with PD(L)1 immune checkpoint inhibitors: a first analysis of the PIONeeR Study. ESMO 2020, LBA53
© 2020 Springer-Verlag GmbH, Impressum




