针对具有罕见突变患者的创新性既定方法
CROWN: ALK抑制剂劳拉替尼的一线使用
脑渗透性的高效第三代ALK酪氨酸激酶抑制剂劳拉替尼已被广泛批准用于治疗以前接受过ALK TKI的ALK阳性晚期NSCLC患者。在一线条件下,在一项随机化III期CROWN研究中,将劳拉替尼与克唑替尼(crizotinib)进行了比较,该研究包括近300名IIIB/IV期的ALK阳性NSCLC患者。Solomon等人在ESMO 2020上报告了对该试验进行的计划内中期分析的结果[1]。
总体而言,有23个国家的104个中心参加了CROWN研究。在实验组中,有149名患者每天接受100 mg的劳拉替尼,而在对照组中,有147名患者接受每天两次、250 mg克唑替尼的治疗。允许有无症状的经治疗或未经治疗的CNS转移。每组中约25%的患者在基线时患有脑部病变。研究组之间不允许交叉。根据盲法独立中心审查的PFS构成主要终点。
针对劳拉替尼组和克唑替尼组的PFS分别中位随访18.3和14.8个月,得到劳拉替尼使进展和死亡的风险降低了72%(中位PFS:9.3个月与未达到;HR:0.28;p < 0.001)。在12个月时,分别有78%和39%的患者无进展。所有预先指定的亚组均受益于第三代ALK抑制剂。具体而言,脑转移患者的HR为0.20,对应于80%的风险降低。
颅内缓解和CNS保护
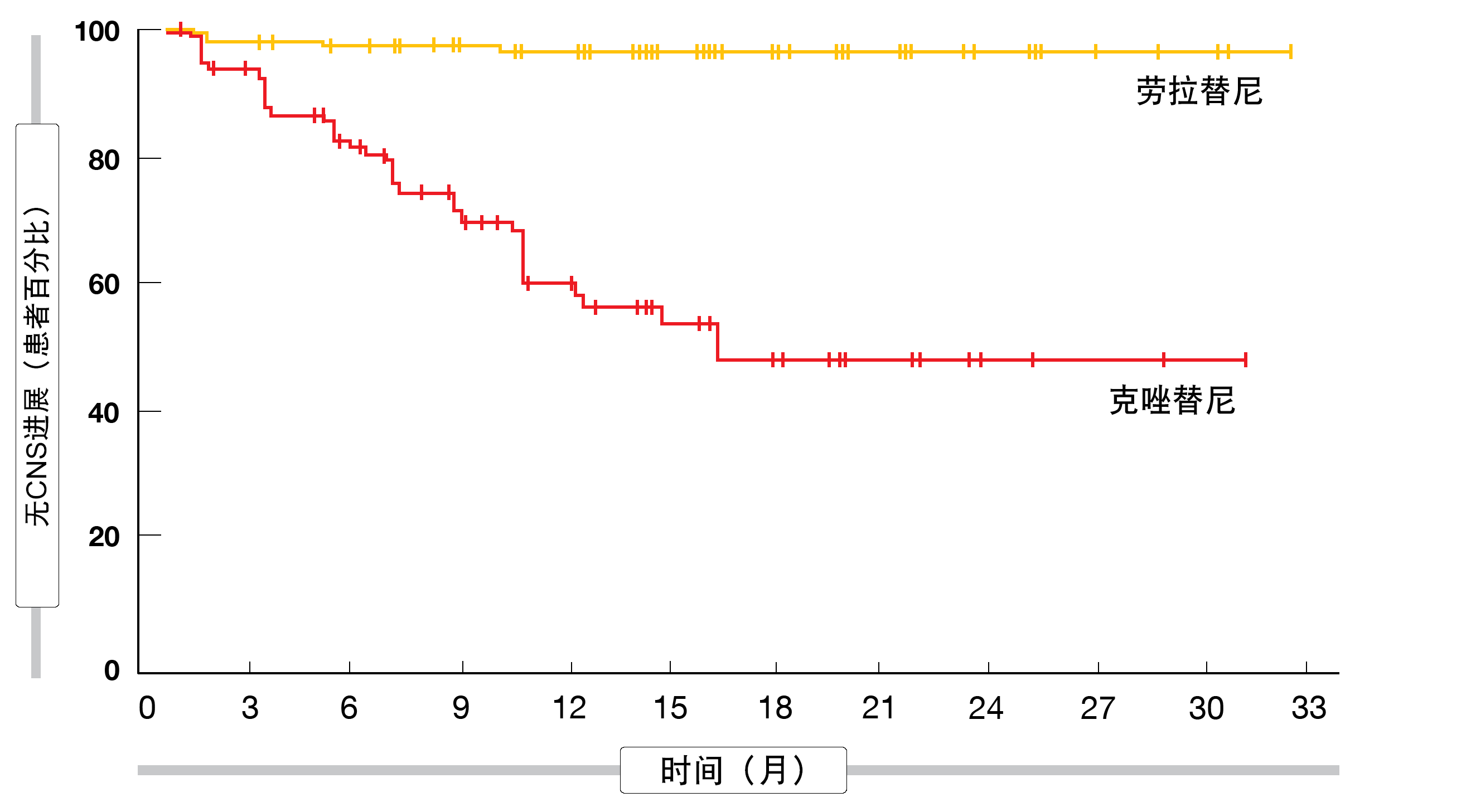
此外,劳拉替尼治疗在ORR(76%与58%,优势比为2.25)和中位缓解持续时间(未达到与11.0个月)方面带来显著获益。在基线时患有可测量或不可测量脑转移的患者中的颅内应答率在实验组中较高(66%与20%;OR:8.41)。在具有可测量脑部病变的患者中,颅内应答率甚至达到82%与23%(OR:16.83),并且颅内完全缓解率也有明显差异(71%与8%)。实验组中至CNS进展时间明显延长(未达到与16.6个月;HR:0.07;p < 0.001;图1),这意味着降低了93%的风险。值得注意的是,由于劳拉替尼组的颅内进展事件很少,这些曲线显示出很宽的间隔。这些发现表明,劳拉替尼不仅具有延缓现有脑部病变进展的能力,而且还可以预防新发脑部病变的发展。
尽管在进行中期分析时OS数据仍不成熟,但0.72的HR值对劳拉替尼是有利的。劳拉替尼的安全特性与先前研究中所报告的相似。劳拉替尼比克唑替尼更频繁发生3/4级AE。然而,其中大多数是无症状且易于处理的实验室异常。在导致永久治疗中止或暂时性剂量中断的AE方面,两组之间没有差异。
根据使用EORTC QLQ-C30问卷评估的患者报告的结果,相对于基线,劳拉替尼治疗明显改善了总体生活质量(p < 0.01)。在早期就观察到该改善,并在18个周期的疗程内得以保持。正如作者在总结中所指出,CROWN试验的结果支持将劳拉替尼用作晚期ALK阳性NSCLC患者的一线疗法。未有介绍关于劳拉替尼治疗失败后的后续疗法,特别是关于其他ALK TKI,的活性的数据。
图1: 在ALK阳性肺癌患者中采用劳拉替尼与克唑替尼作为一线治疗的至CNS进展时间
同类首个KRAS抑制剂sotorasib
尽管在大约40年前就发现了KRAS癌基因,但迄今为止尚未建立批准的靶向疗法。在大约13%的NSCLC患者中发现了KRASG12C突变[2-4]。
Sotorasib(AMG 510)是一种新型、高度选择性的同类首个KRASG12C抑制剂,已在具有KRASG12C突变的实体瘤患者中显示出抗癌活性和可控的安全特性[4, 5]。I期、多中心、开放标签、剂量递增、剂量扩展的CodeBreaK100试验评估了sotorasib在经先前标准疗法治疗后的具有KRASG12C突变的局部晚期或转移性实体瘤患者中的表现。每天口服Sotorasib 960 mg被确定为II期推荐剂量。总体而言,患有13种不同肿瘤类型的129名患者参与了试验,其中包括59名NSCLC患者。
Hong人在ESMO 2020上介绍了从NSCLC队列中获得的数据[6]。在该群组中,有34名患者接受了960 mg剂量。在960 mg剂量队列和总NSCLC组中,分别有82.4%和89.8%的患者先前被施用了抗PD-(L)1疗法。所有患者均接受了铂类化疗,并且75%的患者先前接受了≥ 2种全身抗癌治疗线。
持久疾病控制
根据研究者的评估,960 mg剂量队列和总NSCLC组的ORR分别为35.3%和32.2%。缓解持续10.9个月的中位时间,在数据截止时,19个应答者中有10个仍产生应答。分别有91.2%和88.1%的患者获得了疾病控制。在所有剂量水平上均观察到肿瘤减少。在整个群组中,中位PFS为6.3个月。证明了Sotorasib在一系列KRASG12C突变等位基因频率、PD-L1组织表达水平和血浆肿瘤突变负荷水平下的临床活性。而且在存在组织共突变特性(例如,TP53、SMAD4、PTEN/PIK3CA、KEAP1、EGFR)时,也有临床活性。
研究中报告的大多数AE为轻度或中度,与治疗相关的3/4级AE的发生率为18.6%。仅一名患者因3级AE(转氨酶升高)而中断治疗。没有剂量限制性毒性,也没有发生与治疗相关的致命性AE。观察到的最常见的任意级别AE包括腹泻、转氨酶升高、疲劳和恶心。在他们的结论中,作者强调sotorasib显示出有利的安全特性,并在这一接受大量先前治疗的患者群体中展现出持久的疾病控制。CodeBreaK计划的其他试验正在评估sotorasib作为单一疗法或与其他抗癌药联合使用的情况。
阿法替尼(afatinib)对于罕见EFGR突变
罕见EGFR突变占EGFR突变型NSCLC病例的7%至23%,并影响对EGFR TKI治疗的敏感性[7]。不可逆的ErbB受体家族阻滞剂阿法替尼已显示出针对包括G719X、L861Q和S768I在内的主要罕见突变的临床活性[8]。但是,关于EGFR TKI对其他罕见EGFR突变的疗效的临床数据很少,并且缺乏关于种族差异性在流行率和结果方面的知识。因此,一项对阿法替尼罕见突变数据库的汇总亚组分析评估了阿法替尼在治疗携带罕见突变的亚裔(n = 178)和非亚裔(n = 120)EGFR突变型NSCLC患者中的疗效[9]。定义了五个突变类别:主要罕见突变(G719X、L861Q、S768I)、复合突变、外显子20插入、T790M和其他突变。
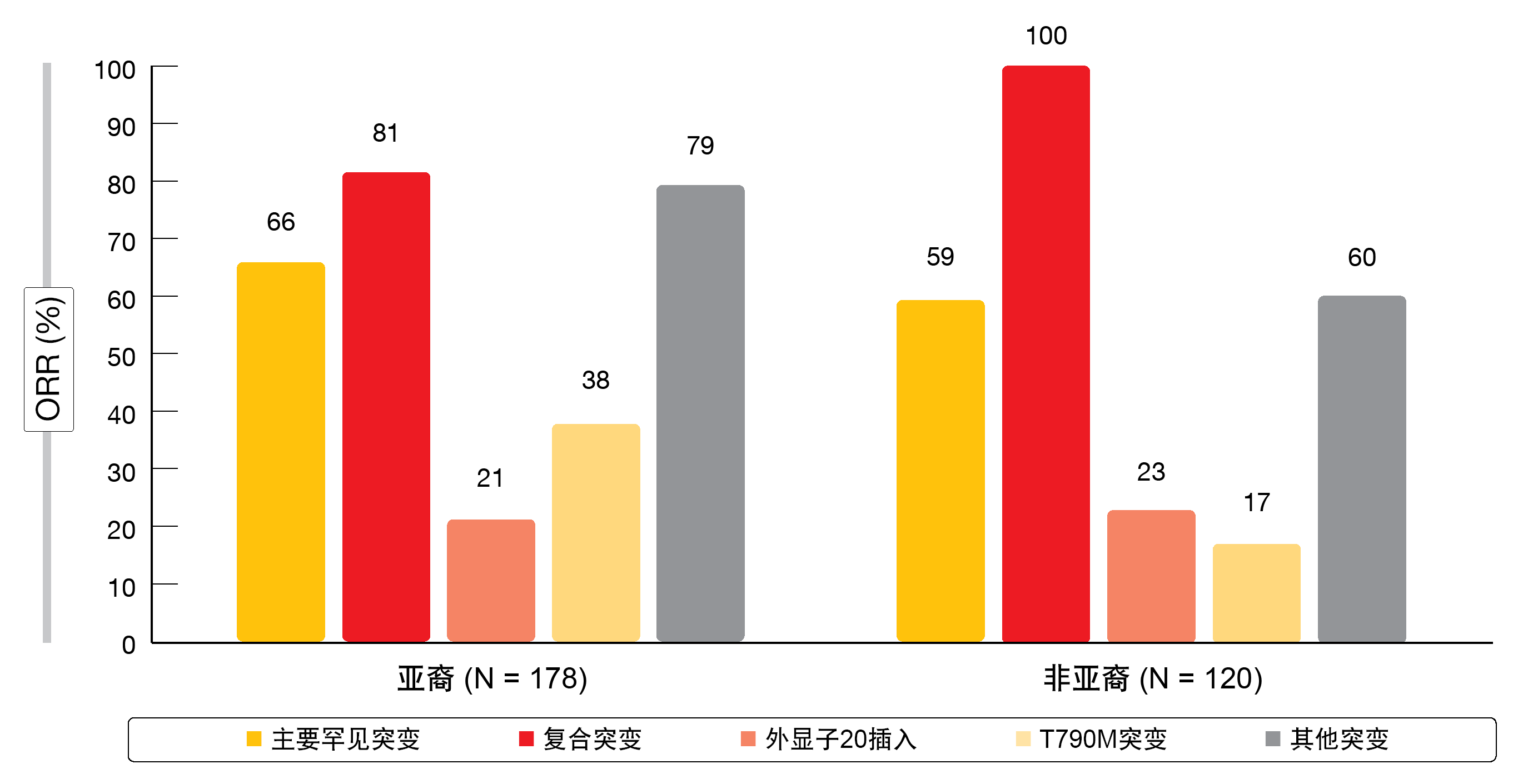
亚裔患者被证明具有较高比例的主要罕见突变(61.8%),阿法替尼已获批准对其使用。在非亚裔群体中,外显子20插入位居第一(39.2%),其次是主要罕见突变(35.0%)。阿法替尼在亚裔和非亚裔患者中均表现出活性,ORR范围为17%至100%(图2)。一定百分比的具有外显子20插入的患者有应答,这反映了该亚组的异质性。
根据对缓解持续时间和至治疗失败时间的评估,临床活性是持久的,特别是对于具有主要罕见突变、复合突变或其他罕见突变的患者。作者得出结论认为,应将阿法替尼视为具有主要罕见和复合EGFR突变的亚裔和非亚裔患者的一线选择。
图2: 在携带罕见EGFR突变的亚裔和非亚裔患者中采用阿法替尼观察到的客观缓解率
具有NRG1融合患者的治疗模式
在所有实体瘤中有0.2%存在NRG1基因融合,但在某些类型如浸润性黏液性肺腺癌中的流行率更高,据估计为31%[10, 11]。目前尚无针对NRG1基因融合阳性肿瘤患者的批准疗法。然而,一些报告表明对阿法替尼治疗具有持久缓解[12-14],因此可能代表NRG1阳性癌症患者的新治疗选择。
一项回顾性的现实世界可行性研究识别携带NRG1基因融合的美国实体瘤患者,他们在任何治疗线中接受阿法替尼,或没有先前阿法替尼的情况下接受其他全身性疗法[15]。该研究的目标包括评估可用于分析的NRG1基因融合阳性实体瘤患者的数量,并深入了解治疗模式以及测试。总计识别出108名患者,其中67名接受了阿法替尼治疗。
数据支持以前的发现,即在多种肿瘤类型中均检测到NRG1基因融合[10]。在阿法替尼治疗组和接受其他全身性疗法的组中,NSCLC构成最常见的肿瘤类型(分别为40%和56%),其次是胃肠道癌和乳腺癌。最常见的NRG1基因融合伴侣是SDC4、CD74和ATP1B1。mRNA测序是最常用的测试方法。阿法替尼主要在二线治疗使用,而其他疗法主要使用在一线条件下。
据作者称,这些发现为进行较大规模、回顾性、基于图表的队列研究以评估治疗结果提供了理论依据。正在进行当中的前瞻性研究,包括药物再发现方案试验DRUP;NCT02925234)和靶向药物与概况分析用途注册研究(TAPUR;NCT02693535),正在调查阿法替尼在NRG1阳性肿瘤中的使用。
参考文献
- Solomon B et al., Lorlatinib vs crizotinib in the first-line treatment of patients with advanced ALK-positive non-small cell lung cancer: results of the phase 3 CROWN study. ESMO 2020, LBA2
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Wiesweg M et al., Impact of RAS mutation subtype on clinical outcome-a cross-entity comparison of patients with advanced non-small cell lung cancer and colorectal cancer. Oncogene 2019; 38(16): 2953-2966
- Canon J et al., The clinical KRAS(G12C) inhibitor AMG 510 drives anti-tumour immunity. Nature 2019; 575(7781): 217-223
- Govindan R et al., Phase I study of AMG 510, a novel molecule targeting KRAS G12C mutant solid tumors. Ann Oncol 2019; 30(suppl_5): v159-v193
- Hong DS et al., Durability of clinical benefit and biomarkers in patients with advanced non-small cell lung cancer treated with AMG 510 (sotorasib): CodeBreaK 100. ESMO 2020, 12570
- Kohsaka S et al., A method of high-throughput functional evaluation of EGFR gene variants of unknown significance in cancer. Sci Transl Med 2017; 9(416): eaan6566
- Yang JCH et al., Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol 2015; 16(7): 830-838
- Yang JCH et al., Afatinib in Asian and non-Asian patients with EGFR mutation-positive NSCLC harboring uncommon mutations. ESMO 2020, 1341P
- Jonna S et al., Detection of NRG1 gene fusions in solid tumors. Clin Cancer Res 2019; 25(16): 4966-4972
- Trombetta D et al., Frequent NRG1 fusions in Caucasian pulmonary mucinous adenocarcinoma predicted by Phospho-ErbB3 expression. Oncotarget 2018; 9(11): 9661-9671
- Gay ND et al., Durable response to afatinib in lung adenocarcinoma harboring NRG1 gene fusions. J Thorac Oncol 2017; 12(8): e107-e110
- Jones MR et al., Successful targeting of the NRG1 pathway indicates novel treatment strategy for metastatic cancer. Ann Oncol 2017; 28(12): 3092-3097
- Cadranel J al., Therapeutic potential of afatinib in NRG1 fusion-driven solid tumors: a case series. Oncologist 2020 Aug 27. DOI: 10.1634/theoncologist.2020-0379
- Gajra A et al., A real-world feasibility study of patients with solid tumours harbouring NRG1 fusions. ESMO 2020, 1956P
© 2020 Springer-Verlag GmbH, Impressum
More posts
不断变化治疗格局中的EGFR靶向选择
不断变化治疗格局中的EGFR靶向选择 Amivantamab+拉泽替尼(lazertinib) 正在晚期NSCLC患者中探索将amivantamab(一种同时
针对具有罕见突变患者的创新性既定方法
针对具有罕见突变患者的创新性既定方法 CROWN: ALK抑制剂劳拉替尼的一线使用 脑渗透性的高效第三代ALK酪氨酸激酶抑制剂劳拉替尼已被广泛批准用于治疗以前
探索放疗与免疫系统之间的相互作用
探索放疗与免疫系统之间的相互作用 Maarten Lambrecht, MD, PhD, 比利时鲁汶大学肿瘤学系 调控在患者对放疗所产生应答中起决定性作用的
小细胞肺癌治疗成功的决定因素
小细胞肺癌治疗成功的决定因素 预测特征在CASPIAN中…… 随机化、对照、开放标签、III期CASPIAN试验评估了在广泛期小细胞肺癌(ES-SCLC)患者
早期肺癌:不同治疗类型而言值得注意的发现
早期肺癌:不同治疗类型而言值得注意的发现 关于术后放射的III期数据 对完全切除的NSCLC患者进行术后放疗(PORT),多年来一直是一个争论的话题。在没有强
免疫检查点抑制:无化疗方案&新PD-1抑制剂即将出现
免疫检查点抑制:无化疗方案&新PD-1抑制剂即将出现 单药疗法与化疗 KEYNOTE-024的五年进展 在KEYNOTE-024试验中,已显示出在转移