免疫疗法:提高疗效并克服耐药性
POSEIDON:度伐鲁单抗±曲美木单抗(tremelimumab)
全球、随机化、开放标签、III期POSEIDON试验评估了在有或没有抗CTLA-4抗体曲美木单抗时PD-L1抑制剂度伐鲁单抗外加化疗作为转移性NSCLC条件下的一线策略。在19个国家的153个地点,1,013名鳞状或非鳞状IV期NSCLC患者被随机分为三组。根据研究者的选择,一个实验组接受1,500 mg度伐鲁单抗加化疗,Q3W持续4个周期,然后接受1,500 mg度伐鲁单抗Q4W加培美曲塞(pemetrexed),直至出现进展(D+CT;n=338)。在另一个实验组中,该方案包括度伐鲁单抗加75 mg曲美木单抗和化疗,Q3W持续4个周期,然后是度伐鲁单抗Q4W、曲美木单抗(仅第16周)和培美曲塞,直至进展(D+T+CT;n=338)。对照组的患者接受了铂类化疗,Q3W持续最多6个周期,然后接受培美曲塞(CT;n=337)。Johnson等人在WCLC 2021上介绍了研究结果[1]。
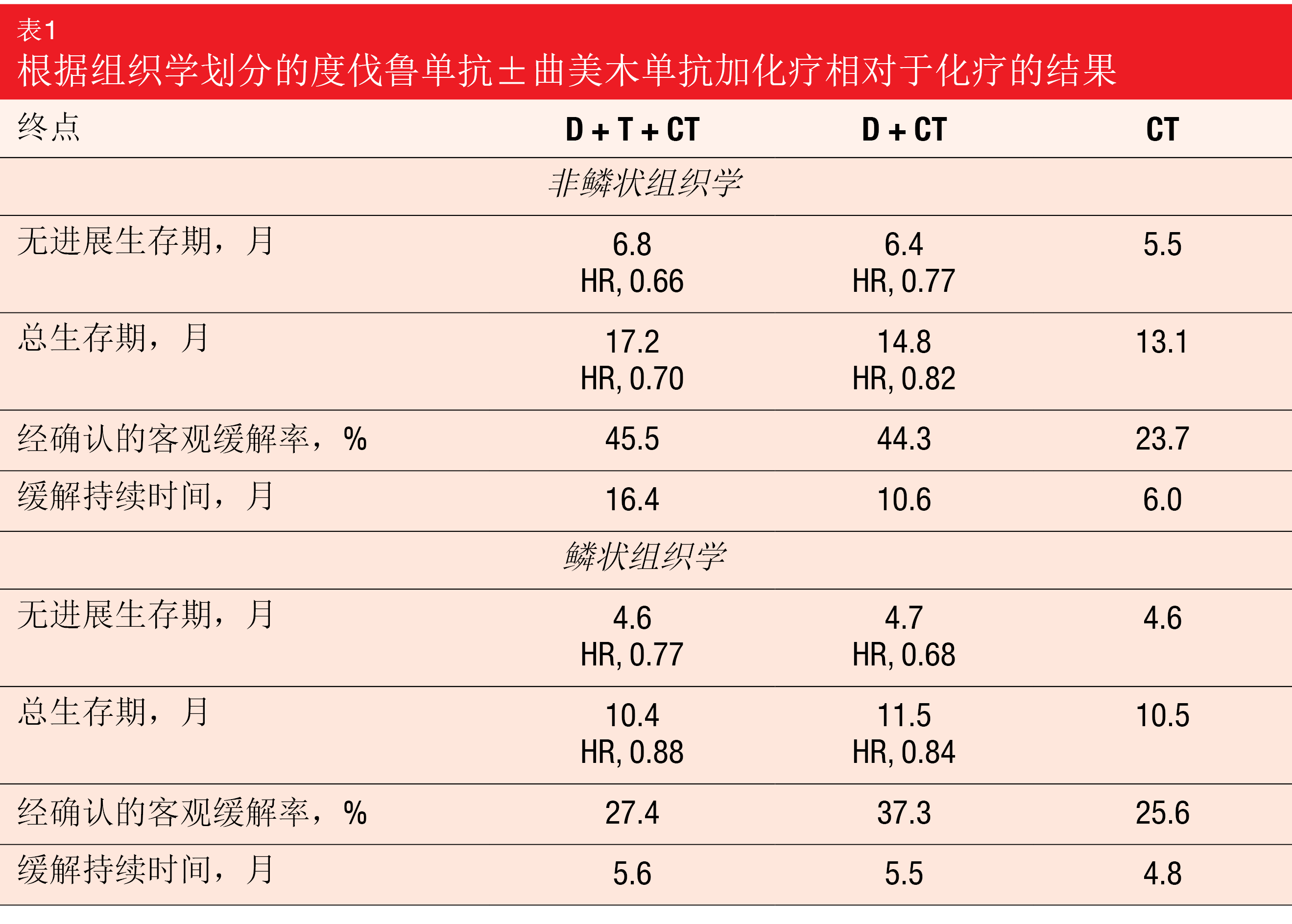
主要终点是D+CT与CT的无进展生存(PFS)和总生存期(OS)。实际上,与CT相比,D+CT显著改善了PFS(5.5个月与4.8个月;HR,0.74;p=0.00093),而对于OS,趋势有利于D+CT(13.3个月与11.7个月;HR,0.86;p=0.07581)。对关键次要终点的分析表明,与CT相比,D+T+CT在PFS(6.2个月与4.8个月;HR,0.72;p=0.00031)和OS(14.0个月与11.7个月;HR,0.77;p=0.00304)方面表现出具有统计学显著性和临床意义的改善。与鳞状肿瘤患者相比,非鳞状组织学的患者从三联疗法中获益更多(表1)。在非鳞状组中,D+T+CT和CT的PFS和OS的风险比分别为0.66和0.70,而在鳞状组中,分别为0.77和0.88。
总体而言,所有三个组的安全特性相似。在度伐鲁单抗+CT中加入曲美木单抗不会明显增加治疗停药率(D+T+CT和D+CT分别为15.5%和14.1%)。根据作者的结论,度伐鲁单抗加曲美木单抗和化疗代表了用于转移性NSCLC患者的潜在的新一线治疗选择。
西米普利单抗(cemiplimab)加化疗:EMPOWER-Lung 3
根据EMPOWER-Lung 1研究,抗PD-1抗体西米普利单抗已被批准作为患有晚期NSCLC且PD-L1≥50%的患者的一线单药疗法[2]。在ESMO 2021上,Gogishvili等人报告了双盲、随机化、III期EMPOWER-Lung 3试验的第二次中期分析,该试验评估了350 mg西米普利单抗加铂双药化疗Q3W持续4个周期的一线治疗[3]。非鳞状或鳞状晚期NSCLC患者被随机分到实验组(n=312)或接受安慰剂加化疗的对照组(n=154)。治疗持续最多108周或两组均出现疾病进展。可允许任何PD-L1表达。
在化疗中加入西米普利单抗使OS(21.9个月与13.0个月;HR,0.71;p=0.014)、PFS(8.2个月与5.0个月;HR,0.56;p<0.0001)和客观缓解率(ORR;43.3%与22.7%;优势比,2.68;p<0.0001)产生具有临床意义和统计学显著性的改善。完全缓解率在实验组中为2.6%,而在对照组中为零。中位缓解持续时间分别为15.6个月和7.3个月。
联合用药显示出可接受的收益-风险特性,其中由治疗相关AE(TRAE)导致的停药率较低(3%与1%)。全级别的免疫相关AE(irAE)的发生率为19%。安全特性与西米普利单抗和铂类化疗的已知特性大体一致。患者报告的结果表明,到达总体健康状况/生活质量(HR,0.78)和疼痛症状(HR,0.39)出现有临床意义的确定性恶化的时间有所延迟。此外,总体健康状况/生活质量和疼痛症状相对于基线的总体变化有所改善。作者在其总结中指出,无论组织学和PD-L1表达水平如何,西米普利单抗联合铂类双药化疗都是没有可靶向突变的晚期NSCLC患者的新一线选择。
脑部病变患者中纳武单抗/伊匹单抗的事后分析
10%的NSCLC患者被诊断出脑转移,且通常预后较差[4, 5]。纳武单抗联合伊匹单抗在包括晚期NSCLC在内的多种肿瘤类型的CNS病变患者中显示出有希望的疗效[6-9]。随机化III期CheckMate 9LA试验评估了在可选培美曲塞维持治疗情况下,360 mg纳武单抗Q3W加1 mg/kg伊匹单抗Q6W外加2个周期化疗,与4个周期化疗作为IV期或复发性NSCLC患者的一线治疗的比较。根据2年期最新结果,与单独化疗相比,联合用药提供了持久的生存益处,OS率为38%与26% [10]。
允许在首次给药前接受充分治疗且无症状≥2周的脑转移患者参与。在实验组和对照组中,该患者组分别占51人和50人,同时分别有310人和308人在基线时没有脑部病变。在WCLC 2021上,Carbone等人报告了至少2年随访后对有和无脑转移的患者的事后分析[11]。
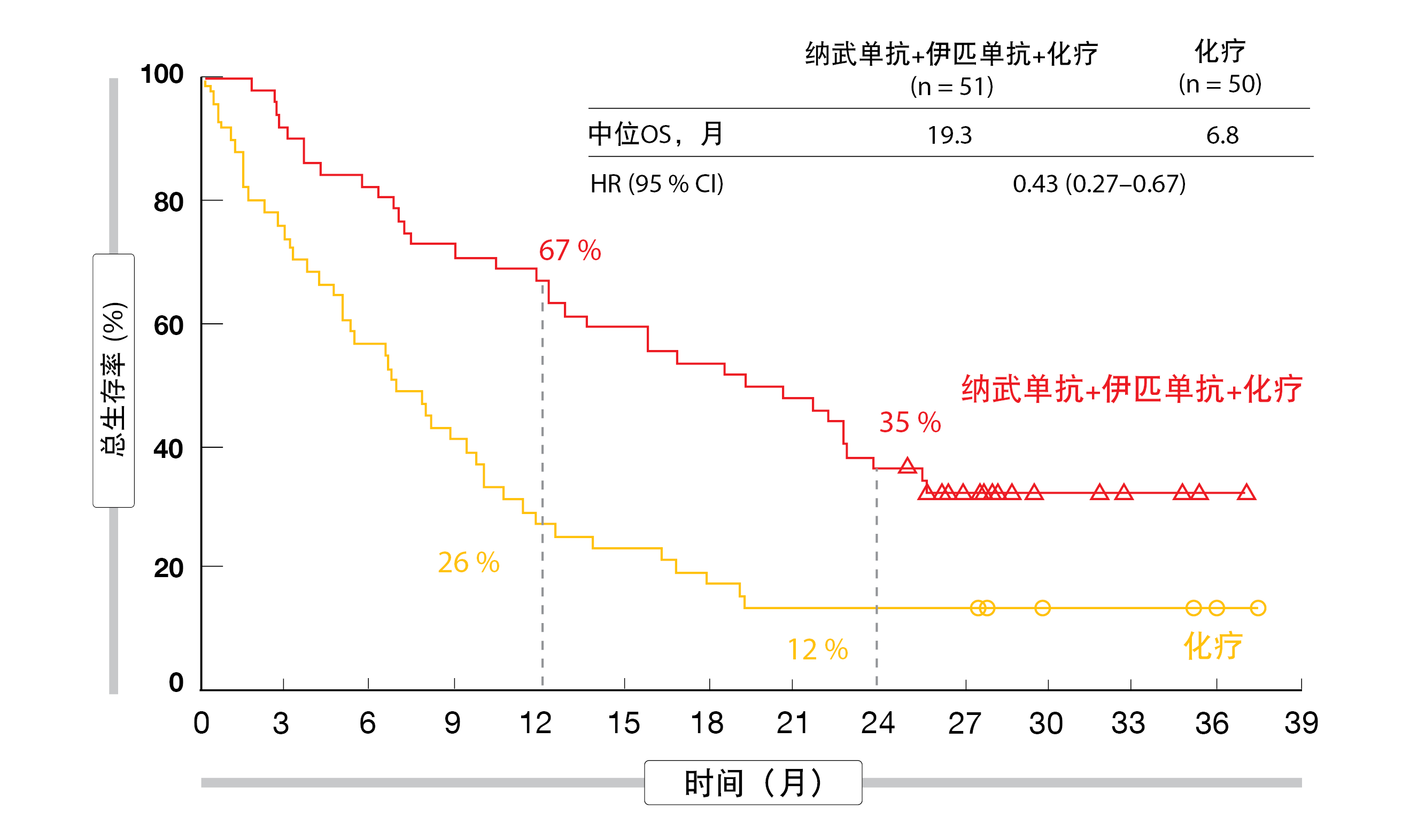
结果表明,与单独化疗相比,纳武单抗加伊匹单抗外加化疗可产生显著的生存益处,该益处与是否存在基线脑转移无关。有CNS病变的患者的死亡率降低(中位OS,19.3个月与6.8个月;HR,0.43;图1)比没有CNS病变的患者更为显著(15.6个月与12.1个月;HR,0.79)。类似地,对于全身缓解,两个队列的HR分别为0.40和0.74。有和无脑部病变的组别中实验组的ORR分别为43%和37%,中位缓解持续时间分别为15.5个月和13.0个月。
在有CNS转移的患者中,纳武单抗加伊匹单抗和化疗在PFS(13.5个月与4.6个月;HR,0.36)、ORR(39%与20%)和缓解持续时间(22.3个月与18.9个月)方面提高了颅内疗效,这与全身疗效一致。完全颅内缓解率为10%与8%。在基线CNS病变组(16%与30%)和无基线CNS病变组(2%与4%)中,使用基于免疫疗法的方法使发生新的脑转移的患者减少。在有基线脑部病变的患者中,到发生新脑转移的中位时间分别为9.0个月和4.6个月。作者在其总结中指出,这些数据进一步支持将纳武单抗加伊匹单抗外加化疗用作晚期NSCLC患者(包括脑转移患者)的有效一线治疗选择。
图1: CheckMate 9LA:具有基线脑转移的患者中纳武单抗加伊匹单抗和化疗相比于单独化疗的总生存率
ATEZO-BRAIN
单组II期贝叶斯ATEZO-BRAIN试验旨在确定阿特珠单抗在患有IV期非鳞状NSCLC和未经治疗的脑转移的患者中的活性和安全性,这是基于观察到该患者组在评估一线条件下化疗加免疫疗法的临床试验中未被充分代表。40名患者接受卡铂(5 AUC)加500 mg/m2培美曲塞和1,200 mg阿特珠单抗,Q3W持续4-6个周期,然后接受培美曲塞加阿特珠单抗,Q3W持续最多2年。允许≤4 mg日剂量的抗惊厥药和地塞米松。安全性和PFS构成共同主要终点。
阿特珠单抗加卡铂和培美曲塞在包括接受皮质类固醇的患者在内的这些患者中表现出良好的安全特性和有效性[12]。由于未达到无效性边界和不可接受的毒性,试验完成,12周PFS率为60%,3-4级毒性率为27.5%。大多数TRAE为1级和2级,没有发生致命的TRAE。三名患者有4级TRAE,包括血小板减少症、中性粒细胞减少症和幻觉。在一般的AE中,最常见的是疲劳(全级别,60%)和贫血(45%)。选定的免疫相关AE主要包括皮疹(20%)和转氨酶升高(13%)。报告了1例3级肺炎(3%)。
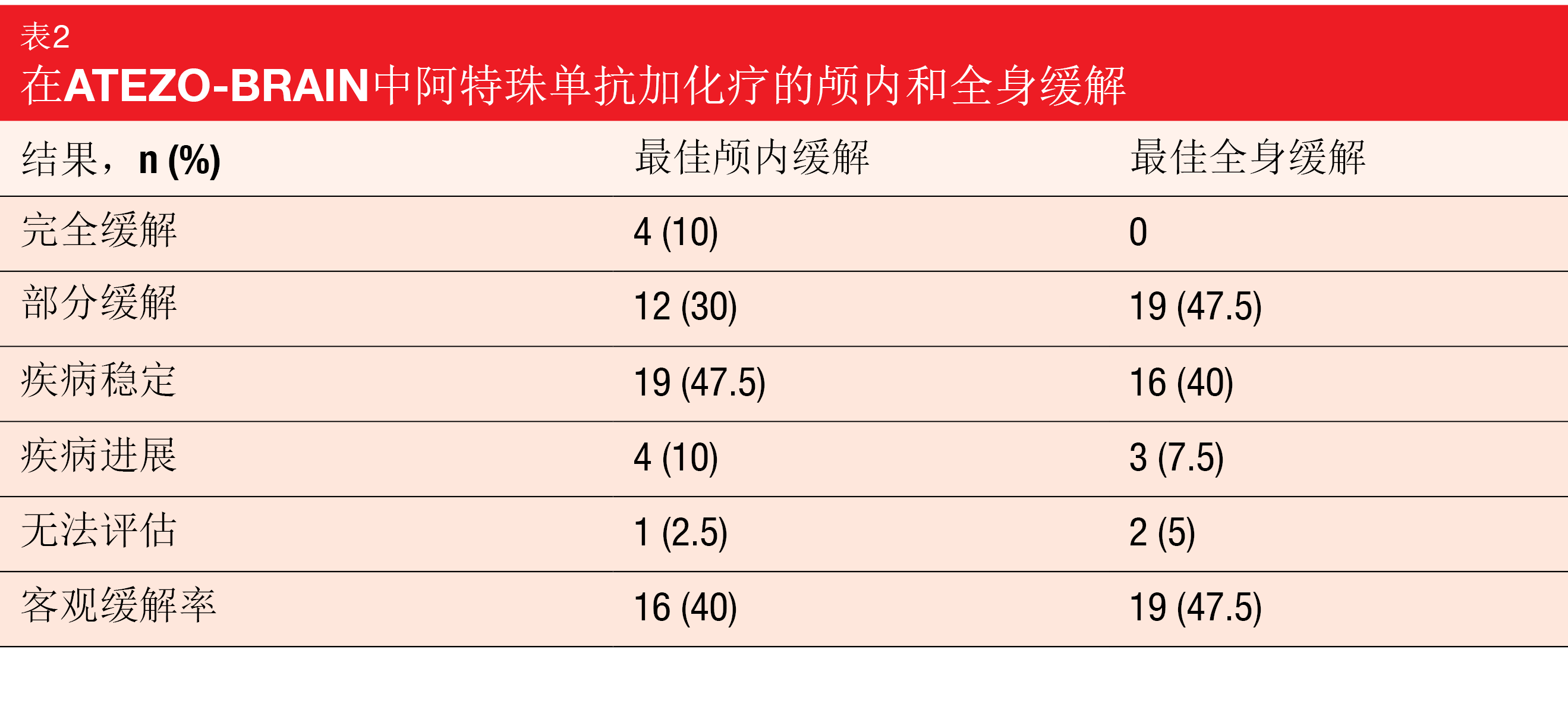
中位全身PFS为8.9个月,24.9%的患者在18个月时无进展。中位颅内PFS为6.9个月,与KEYNOTE-189试验中报告的脑转移患者的PFS相似[13]。躯体和脑的大多数缓解是一致的(表2)。分别有40%和47.5%的患者实现颅内和全身缓解。中位OS为13.6个月,在2年时,32%的患者存活。正在进行基于脑成像和血液样品的相关研究。
MRTX-500:司曲替尼(sitravatinib)加纳武单抗
尽管检查点抑制剂疗法改变了NSCLC的治疗前景,但通过包括发展出免疫抑制性肿瘤微环境在内的各种机制产生的耐药性很常见,并且在抗PD-(L)1疗法难治/耐药的疾病背景下,治疗选择有限。据推测,纳武单抗与酪氨酸激酶抑制剂司曲替尼的组合是增强抗肿瘤免疫反应和延长患者长期获益的合理方法。司曲替尼靶向TAM受体TYRO3、AXL、MERTK以及VEGFR2和KIT,这些受体已被证明可减少骨髓源性抑制细胞并增强抗肿瘤免疫反应等[14]。开放标签、单组、II期MRTX-500试验在已从抗PD-(L)1疗法受益(即完全缓解或部分缓解或疾病稳定≥12周)的非鳞状晚期NSCLC患者中测试了120 mg司曲替尼每日一次加纳武单抗。检查点抑制剂被用作最近的治疗线。
在ESMO 2021上,Leal等人报告了在二线或三线条件下司曲替尼加纳武单抗的最新疗效和安全性[15]。该分析包括68名患者。构成主要终点的ORR为18%,包括3%的完全缓解。78%的患者获得了疾病控制,中位缓解持续时间为12.8个月。中位PFS和OS分别为5.7个月和14.9个月。24个月的OS率为32%。
在TRAE中,最常报告的是腹泻(全级别,62%)、疲劳(52%)和恶心(44%)。最常见的免疫相关TRAE包括甲状腺功能减退、腹泻、转氨酶升高、TSH升高、斑丘疹和胰腺炎。没有发生5级事件。22%的患者因TRAE终止治疗。81%的患者因AE必须中断至少一剂司曲替尼。这些结果支持正在进行的随机化、开放标签III期SAPPHIRE试验,该试验在晚期NSCLC患者中评估在检查点抑制期间或之后发生进展后的二线/三线司曲替尼加纳武单抗对比多西他赛(docetaxel)。
替雷利珠单抗(tislelizumab)作为司曲替尼的组合伴侣
抗PD-1抗体替雷利珠单抗被设计成最大限度地减少与巨噬细胞上FcγR的结合,以便消除抗体依赖性吞噬作用,该作用是一种T细胞清除和抗PD-1耐药性的机制[16, 17]。正在对替雷利珠单抗与司曲替尼联合治疗几种类型的实体瘤进行研究,目的是使抗肿瘤活性增强至超过其中任一种药物单独提供的活性。一项开放标签、多中心、非随机化Ib期试验测试了120 mg司曲替尼每日一次加200 mg替雷利珠单抗Q3W。Zhou等人介绍了队列A、B和F的结果,这些队列包含鳞状或非鳞状转移性NSCLC患者,这些患者之前在有或没有抗PD-(L)1抑制剂的情况下接受过1-3线全身疗法(n=75)[18]。可允许任何PD-L1表达水平。
结果显示了与检查点抑制剂先前治疗无关的联合用药疗效。总体ORR为16.9%,与复发/难治性队列相比,产生反应的抗PD-(L)1初治患者的比例在数值上更高(分别为22.2%和13.6%)。类似地,与经先前治疗的组(PFS,5.2个月;OS,10.1个月)相比,抗PD-(L)1初治患者经历了在数值上更长的PFS(7.0个月)和OS(15.3个月)。在整个队列中,中位PFS和OS分别为5.5个月和11.9个月。疾病控制率为84.5%。替雷利珠单抗加司曲替尼展现了与先前报告一致的可控安全特性。最常报告的≥3级治疗期间出现的AE和TRAE是高血压,但没有高血压案例导致治疗停药。
Gao等人介绍了队列A和F的单独分析,队列A和F包括47名抗PD-(L)1疗法难治或耐药性的鳞状或非鳞状转移性NSCLC患者。该组的疾病控制率为86.4%,中位缓解持续时间为6.9个月。据作者称,该研究中观察到的有希望的抗肿瘤活性支持将司曲替尼加替雷利珠单抗作为一种潜在的治疗选择,用于治疗先前抗PD-(L)1疗法难治或治疗后复发的转移性NSCLC患者。有必要进一步研究。
RATIONALE 304 & 307中根据吸烟状态的结果
在 RATIONALE 304研究中,作为晚期非鳞状NSCLC患者的一线治疗,替雷利珠单抗加化疗与单独化疗相比显著改善了PFS [20]。根据Lu等人在ESMO 2021上介绍的子分析,替雷利珠单抗加化疗在吸烟者(占总人群的63.8%)中的疗效和安全性与在总群体中观察到的结果一致[21]。吸烟者的两个治疗组的中位PFS分别为9.7个月和4.6个月(HR,0.466),而非吸烟者的这些结果没有差异(8.5个月与7.7个月;HR,1.075)。无论吸烟状况如何,替雷利珠单抗外加化疗均产生更高的ORR。
RATIONALE 307研究的一项类似的子分析探索了一线替雷利珠单抗加化疗用于具有鳞状组织学的NSCLC患者,显示出独立于吸烟状态的一致PFS和ORR [22]。RATIONALE 307的主要分析显示出与单独化疗相比具有明显的PFS益处和可控的安全性[23]。在这项研究中,83.7%的患者是吸烟者。该组显示两种化疗方案(即紫杉醇或白蛋白结合型紫杉醇加卡铂)的中位PFS为7.6个月,而单独化疗为5.5个月。非吸烟者在PFS方面同样受益于添加替雷利珠单抗,两种治疗方案的HR分别为0.475和0.119。无论吸烟状况如何,实验组的ORR均较高。在RATIONALE 304和307中,在吸烟者和非吸烟者中记录的安全特性与在总人群中观察到的一致。
STK11/KRAS共突变:预测意义
Basher等人阐明了通过新一代测序鉴定的STK11/KRAS共突变的预测作用以及免疫检查点抑制剂治疗中irAE的发生率[24]。总体而言,对来自佛罗里达州三个中心的703名IIIB/IV期NSCLC患者进行了回顾性分析。
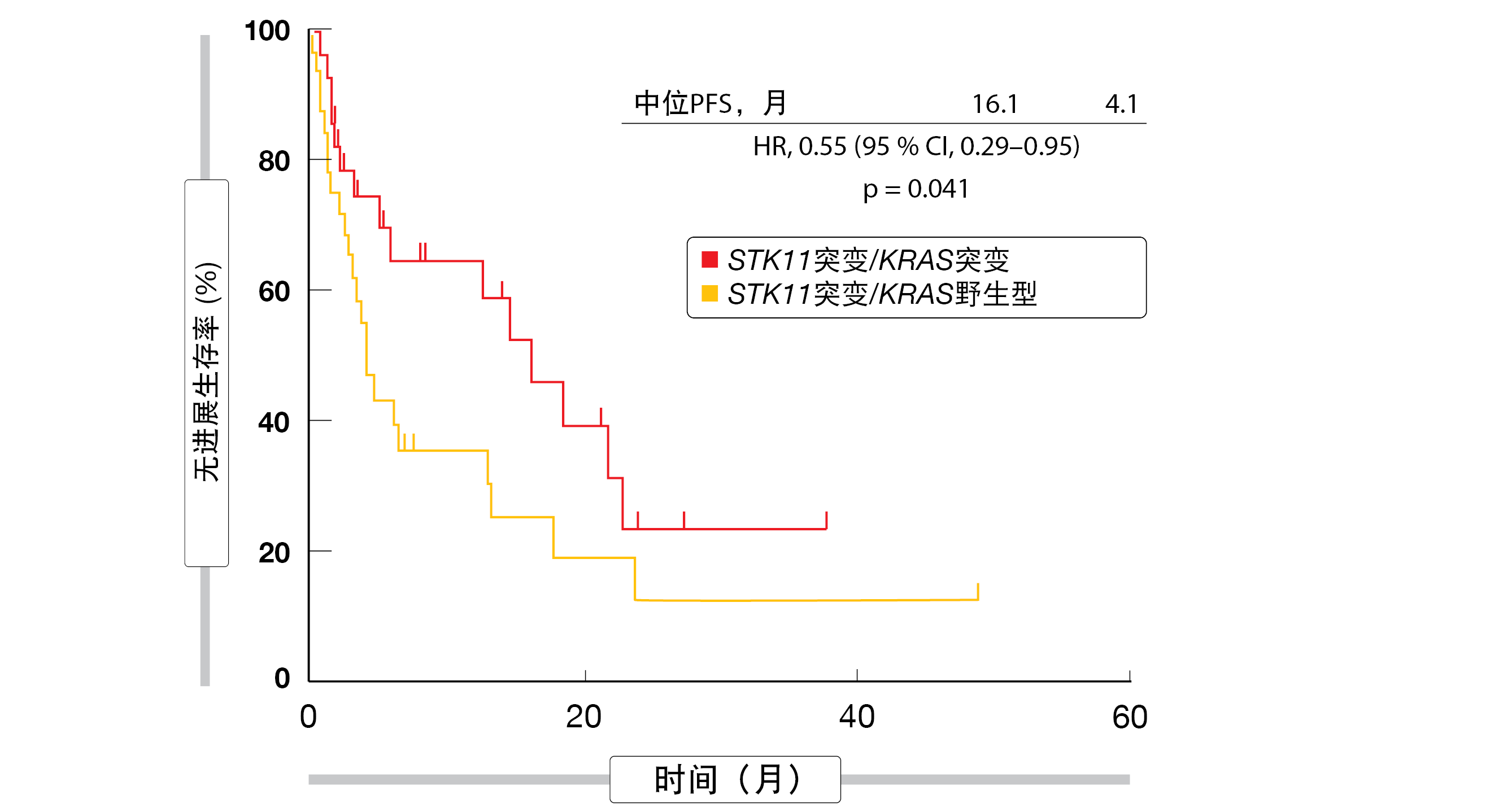
实际上,与STK11突变/KRAS野生型相比, STK11和KRAS同时突变与显著改善的PFS相关(16.11个月与4.1个月;HR,0.55;p=0.041;图2)。对于OS,分析显示有利于共突变的趋势(32.3个月与21.8个月;HR,0.61;p=0.21)。irAE被证明可以预测治疗的OS改善:发生irAE的患者的中位生存时间为46.3个月,而在没有免疫相关副作用的队列中为29.7个月(HR,0.59;p=0.022)。虽然西班牙裔患者比非西班牙裔白人患者更经常经历irAE,但他们并未获得显著的生存获益。进一步的研究可能会确定该人群的独特特点,从而能够解释这些观察结果。
图2: 在存在STK11/KRAS共突变的情况下采用免疫检查点抑制而显著延长的无进展生存率
参考文献
- Johnson ML et al., Durvalumab ± tremelimumab + chemotherapy as first-line treatment for mNSCLC: results from the phase 3 POSEIDON study. WCLC 2021, PL02.01
- Sezer A et al., Cemiplimab monotherapy for first-line treatment of advanced non-small-cell lung cancer with PD-L1 of at least 50%: a multicentre, open-label, global, phase 3, randomised, controlled trial. Lancet 2021; 397(10274): 592-604
- Gogishvili M et al., EMPOWER-Lung 3: cemiplimab in combination with platinum-doublet chemotherapy for first-line treatment of advanced non-small cell lung cancer. ESMO 2021, LBA51
- Waqar NS et al., Non-small-cell lung cancer with brain metastasis at presentation. Clin Lung Cancer 2018; 19(4): e373-e379
- Sperduto PW et al., Estimating survival in patients with lung cancer and brain metastases: an update of the graded prognostic assessment for lung cancer using molecular markers (Lung-molGPA). JAMA Oncol 2017; 3(6): 827-831
- Di Giacomo AM et al., Immunotherapy of brain metastases: breaking a “dogma”. J Exp Clin Cancer Res 2019; 38(1): 419
- Tawbi HA et al., Combined nivolumab and ipilimumab in melanoma metastatic to the brain. N Engl J Med 2018; 379(8): 722-730
- Emamekhoo H et al., Safety and efficacy of nivolumab plus ipilimumab (NIVO+IPI) in patients with advanced renal cell carcinoma (aRCC) with brain metastases: Interim analysis of CheckMate 920. J Clin Oncol 37, 2019 (suppl; abstr 4517)
- Borghaei H et al., Nivolumab + ipilimumab as first-line treatment for patients with advanced non-small cell lung cancer with brain metastases: results from Checkmate 227. Cancer Research 2020; 80(Suppl. 16): Abstract CT221
- Reck M et al., First-line nivolumab plus ipilimumab plus two cycles of chemotherapy versus chemo alone (4 cycles) in patients with advanced non-small cell lung cancer: Two-year update from CheckMate 9LA. J Clin Oncol 39, 2021 (suppl 15; abstr 9000)
- Carbone DP et al., First-line nivolumab + ipilimumab + chemotherapy in patients with advanced NSCLC and brain metastases: results from CheckMate 9LA. WCLC 2021, OA09.01
- Nadal E et al., ATEZO-BRAIN (GECP 17/05): non-randomized phase II clinical trial of atezolizumab combined with carboplatin plus pemetrexed in chemotherapy-naïve patients with advanced non-squamous NSCLC with untreated brain metastases. WCLC 2021, OA09.02
- Garassino MC et al., Outcomes among patients with metastatic nonsquamous NSCLC with liver metastases or brain metastases treated with pembrolizumab plus pemetrexed-platinum: Results from the KEYNOTE-189 study. AACR Annual Meeting 2019, CT043
- Du W et al., Sitravatinib potentiates immune checkpoint blockade in refractory cancer model. JCI Insight 2018; 3: e124184
- Leal TA et al., MRTX-500: phase 2 trial of sitravatinib + nivolumab in patients with nonsquamous non-small-cell lung cancer progressing on or after prior checkpoint inhibitor therapy. ESMO 2021, 1191O
- Qin S et al., RATIONALE 301 study: tislelizumab versus sorafenib as first-line treatment for unresectable hepatocellular carcinoma. Future Oncol 2019; 15: 1811-1822
- Zhang T et al., The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions. Cancer Immunol Immunother 2018; 67(7): 1079-1090
- Zhou Q et al., Sitravatinib + tislelizumab in patients with metastatic non-small cell lung cancer. ESMO 2021, 1280P
- Gao B et al., Sitravatinib + tislelizumab in patients with anti-PD-(L)1 refractory/resistant metastatic non-small cell lung cancer. ESMO 2021, 1284P
- Lu S et al., Tislelizumab plus chemotherapy as first-line treatment for locally advanced or metastatic nonsquamous NSCLC (RATIONALE 304): a randomized phase 3 trial. J Thorac Oncol 2021; 16(9): 1512-1522
- Lu S et al., RATIONALE 304: tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for non-squamous non-small cell lung cancer in patients who are smokers vs non-smokers. ESMO 2021, 1290P
- Yu X et al., RATIONALE 307: tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non-small cell lung cancer in patients who were smokers vs non-smokers. ESMO 2021, 1297P
- Wang J et al., Tislelizumab plus chemotherapy vs chemotherapy alone as first-line treatment for advanced squamous non-small-cell lung cancer: a phase 3 randomized clinical trial. JAMA Oncol 2021; 7(5): 709-717
- Basher F et al., Prognostic value of STK11 & KRAS mutations and irAE incidence in response to immunotherapy in Hispanics: a multicenter analysis. WCLC 2021, MA01.07
© 2022 Springer-Verlag GmbH, Impressum