早期疾病环境中的治疗扩展和见解
治疗I-III期非小细胞肺癌(NSCLC)患者的医疗需求仍远未得到满足,因为尽管进行了治愈性治疗,仍有高达60%的患者出现疾病复发[1]。IMpower010是癌症免疫疗法的首个III期研究,目的是证明在完全切除和铂类化疗后的辅助情况下的无病生存期(DFS)益处。中期DFS分析显示,与最佳支持治疗(BSC)相比,1,200 mg阿特珠单抗(atezolizumab)Q3W持续16个周期在PD-L1阳性(即TC≥1%)的II-IIIA期和全随机化II-IIIA期人群中产生了显著的DFS益处(HR分别为0.66和0.79)[2]。在意向治疗(ITT)人群(即,全随机化IB-IIIA期患者)中,未跨越DFS的显著性边界。
在ESMO 2021上,Felip等人报告了在中期DFS分析时IMpower010中疾病复发和复发后治疗的位点[3]。此外,通过全随机化II-IIIA期人群中的PD-L1表达探索了DFS;这显示,经阿特珠单抗治疗的TC≥50%的患者的风险降低最大(HR,0.43),而TC 1-49%的患者没有显著获益(HR,0.87)。
IMpower010中一致的益处
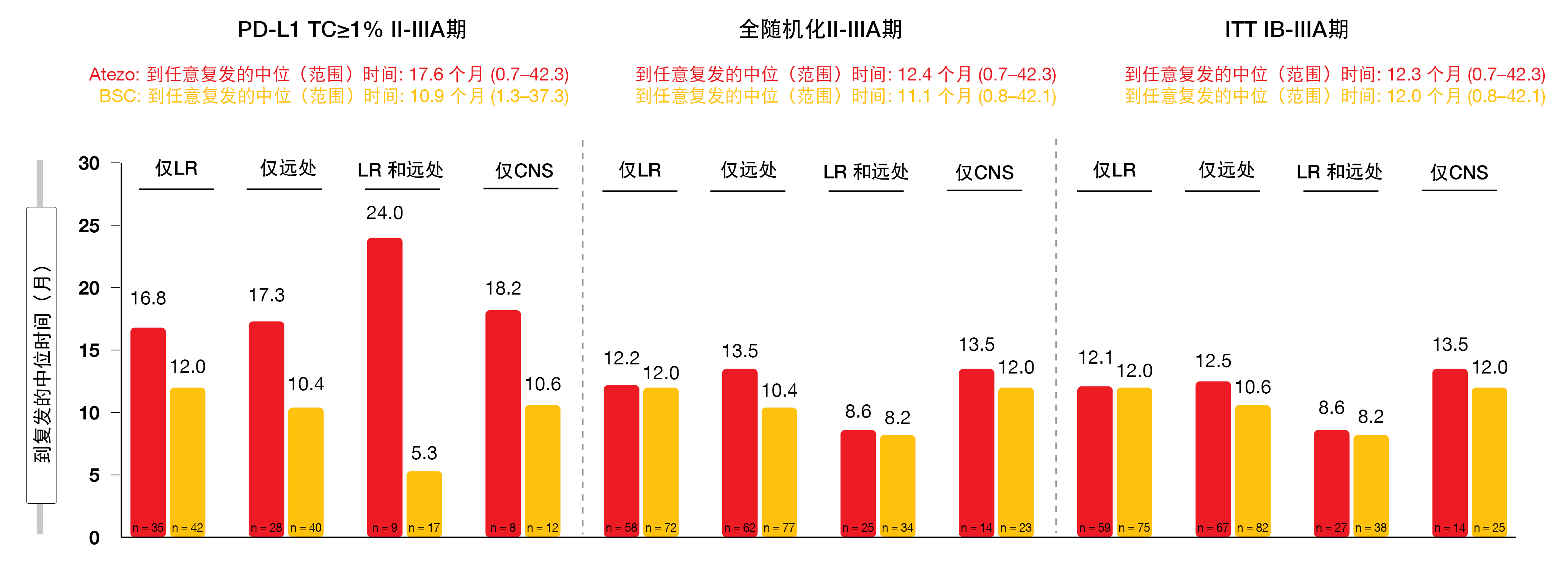
在各研究组中观察到相似的复发模式。在PD-L1阳性II-IIIA期人群中,两组中的仅局部复发(阿特珠单抗和BSC分别为47.9%和41.2%)都比仅远处复发(分别为38.4%和39.2%)更常见。相反,在全随机化II-IIIA期和ITT IB-IIIA期人群中,无论采用何种治疗,远处转移都略微比局部复发更常见。在所有组中,CNS复发率仅为9.0%至12.3%。对于从随机化到复发的时间,针对PD-L1阳性的II-IIIA期人群中的所有复发类型,阿特珠单抗疗法都更为有利,而全随机化II-IIIA期和ITT IB-IIIA期的人群之间的差异不大(图1)。
对于复发后的治疗,分析显示,这三类人群的BSC组中免疫疗法的使用率高于实验组,但没有观察到包括化疗和靶向药在内的其他类型的后续治疗的差异。手术和放疗的复发后使用率同样相近。作者得出结论,更长的随访是必要的并且可能揭示复发模式和治疗选择的差异。
IMpower010研究的另一探索性分析评估了先前疗法,包括手术类型及其对DFS结果的潜在影响[4]。在随机化ITT人群(n = 1,005)中,大多数患者接受了叶切除术(78.1%)和淋巴结切除(80.7%),并且多数接受了4个周期的辅助化疗。从手术到首次给予阿特珠单抗或BSC的中位时间相近(分别为5.2个月和5.1个月)。森林图显示,在累及淋巴结的患者的大多数疾病阶段中以及在大多数手术类型和化疗方案中,与BSC相比,辅助阿特珠单抗改善了PD-L1 TC≥1%的II-IIIA期和全随机化II-IIIA期人群的DFS。
图1: IMpower010中包含的PD-L1 TC≥1% II-IIIA期、全随机化II-IIIA期和ITT IB-IIIA期人群的从随机化到复发的时间。LR,局部;CNS,中枢神经系统
NADIM:纳武单抗的新辅助使用
单组II期NADIM试验在患有IIIA N2或T4N0/N1期的可切除肿瘤的患者中评估了360 mg纳武单抗Q3W外加3个周期的紫杉醇和卡铂新辅助给药。在第3周期的第三周或第四周的第21天进行手术。辅助治疗包括持续1年的纳武单抗。对于主要终点——24个月的无进展生存期(PFS),主要分析得出PFS率为77.1%,因此支持向铂类化疗加入新辅助纳武单抗。
在WCLC 2021上,报告了ITT人群和依方案人群(PP;n = 37)的3年总生存期(OS)分析。依方案人群包含接受辅助疗法的患者组。NADIM显示出有希望的生存结果,ITT人群和PP人群的36个月OS率分别为81.9%和91.0%。这明显超过了过去几十年保持在大约30%的历史3年OS率。在42个月时,分别有78.9%和87.3%的患者存活。42个月的PFS率分别为69.6%和81.1%。
进行了探索性分析以阐明缓解参数的预测潜力。虽然基于CT扫描的临床缓解不能预测生存结果,但病理完全缓解和循环肿瘤DNA清除(即在新辅助治疗结束时没有可检测的ctDNA)明显预示着长期生存。
向新辅助化疗加入纳武单抗并未对安全特性产生不利影响。对于新辅助和辅助治疗期,大多数治疗相关不良事件(TRAE)都为1级或2级,并且没有发生致命的TRAE。
现实世界条件下的PACIFIC
III期PACIFIC试验已将度伐鲁单抗巩固治疗确定为患有不可切除的III期NSCLC且在同步放化疗(CRT)后未出现疾病进展的患者的标准护理。该研究实现了强大且持久的OS和PFS益处,三分之一的患者在5年随访后保持无进展[7]。目前,国际观察性PACIFIC-R研究正在探索PACIFIC方案在现实世界中的有效性。在ESMO 2021上介绍的分析包括总共1,399名患有不可切除的III期NSCLC的患者,这些患者从11个国家的290个活动地点招募到早期获取计划中,未考虑其肿瘤PD-L1表达状态[8]。
在大约11个月的中位治疗持续时间后,度伐鲁单抗的中位现实世界PFS高于PACIFIC试验中报告的PFS(21.7个月与16.9个月)。作者指出,与现实世界数据的收集有关的不准确性限制了这种比较;例如,RECIST标准在各个国家的使用方式各不相同,而COVID-19大流行可能会影响对进展的评估。尽管如此,在分析的亚组中,CRT后度伐鲁单抗的疗效总体上与PACIFIC试验的先前数据一致[9]。对于采用度伐鲁单抗巩固疗法观察到的现实世界PFS,IIIA期疾病长于IIIB/C期疾病(23.7个月与19.2个月)、PD-L1阳性组长于PD-L1阴性组(22.4%与16.3个月)、同步CRT长于序贯CRT(23.7个月与19.4个月)、非鳞状肿瘤患者长于鳞状肿瘤患者(25.3个月与14.7个月)。
肺炎/间质性肺病是导致治疗暂时中断(5.2%)和永久停药(9.5%)的最常见AE。18%的患者发展出肺炎,主要是轻度或中度的。71.3%的事件需要皮质类固醇给药。由于AE和疾病进展导致的治疗停药率(分别为16.7%和26.9%)与来自PACIFIC的数据一致(分别为15.4%和31.3%[7])。总体而言,在CRT后持续大约11个月的度伐鲁单抗巩固疗法在大型现实世界队列中被证明有效。
度伐鲁单抗与新药的联合
正在探索在PACIFIC条件下采用度伐鲁单抗加其他药物的联合免疫调节巩固治疗,目的是进一步改善患者的结果。全球、开放标签、随机化、II期COAST研究正在测试单独的度伐鲁单抗、度伐鲁单抗联合抗CD73抗体奥来鲁单抗(oleclumab)以及度伐鲁单抗联合抗NKG2A抗体莫那利珠单抗(monalizumab)。放疗诱导CD7和 NKG2A配体HLA-E的表达,其抑制抗肿瘤免疫反应[10-12]。在有或没有检查点抑制剂的情况下,放疗和CD37/NKG2A靶向药的联合已在临床前模型中显示出增加的抗肿瘤活性[10, 11]。
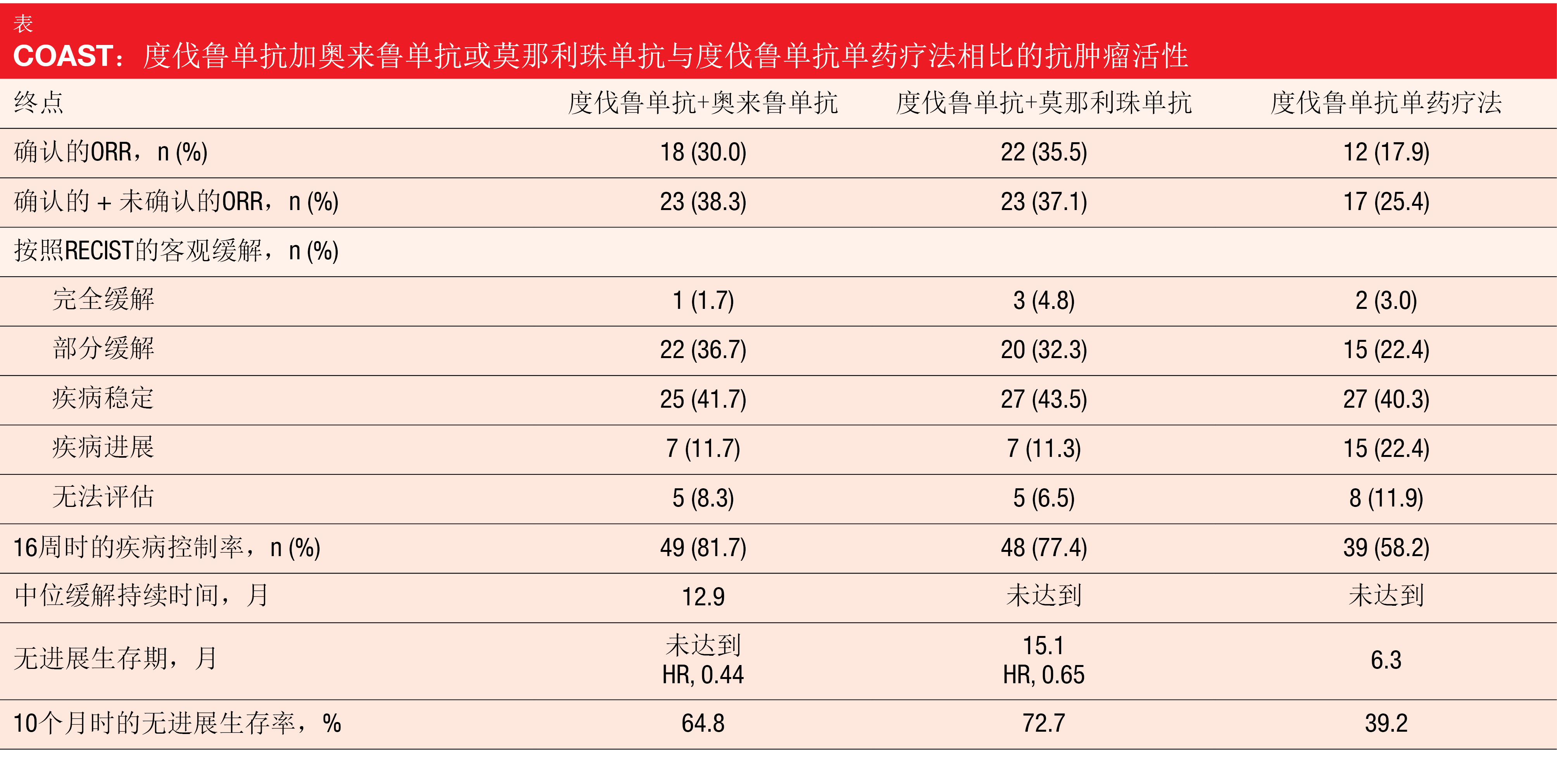
正在9个国家的82个地点进行的三组COAST研究正在比较1,500 mg度伐鲁单抗加3,000 mg奥来鲁单抗Q4W(n=60)、1,500 mg度伐鲁单抗Q4W加750 mg莫那利珠单抗Q2W(n=62)以及1,500 mg度伐鲁单抗Q4W单药疗法(n=67)。客观缓解率(ORR)构成主要终点。根据ESMO 2021上介绍的中期数据,奥来鲁单抗和莫那利珠单抗与度伐鲁单抗联合时都可以提供额外的临床益处[13]。与单独使用度伐鲁单抗相比,两种组合在数值上增加了ORR并产生了显著的PFS改善(表)。在不同的亚组中观察到两种组合的PFS益处。
各组的安全特性一致,包括肺炎在内的特别感兴趣的AE的发生率相似。两个联合组均未出现新的安全信号。总体而言,COAST作为首个随机化II期研究证明了在PACIFIC条件下使用新型免疫疗法组合会改善结果。这些数据支持在注册意向试验中进一步评估联合方案。
GEMSTONE-301: 舒格利单抗(sugemalimab)
另一项在PACIFIC条件下探索巩固治疗的研究是随机化、双盲、安慰剂对照的III期GEMSTONE-301试验。在患有不可切除的III期NSCLC且在同步或序贯CRT后未出现进展的中国患者中,抗PD-L1抗体舒格利单抗(n=255)正在以1,200 mg Q3W的剂量相对于安慰剂(n=126)进行长达24个月的测试。GEMSTONE-301是首个在这种情况下在同时和序贯治疗后评估抗PD-(L)1药物的III期研究,其基础是观察到同步CRT并不是在所有地方都能获得使用并且会带来明显的毒性。患者的合并症和获取困难通常会限制其在现实世界条件下的使用。GEMSTONE-301包含的人群中分别有三分之二和三分之一接受了同步和序贯CRT。
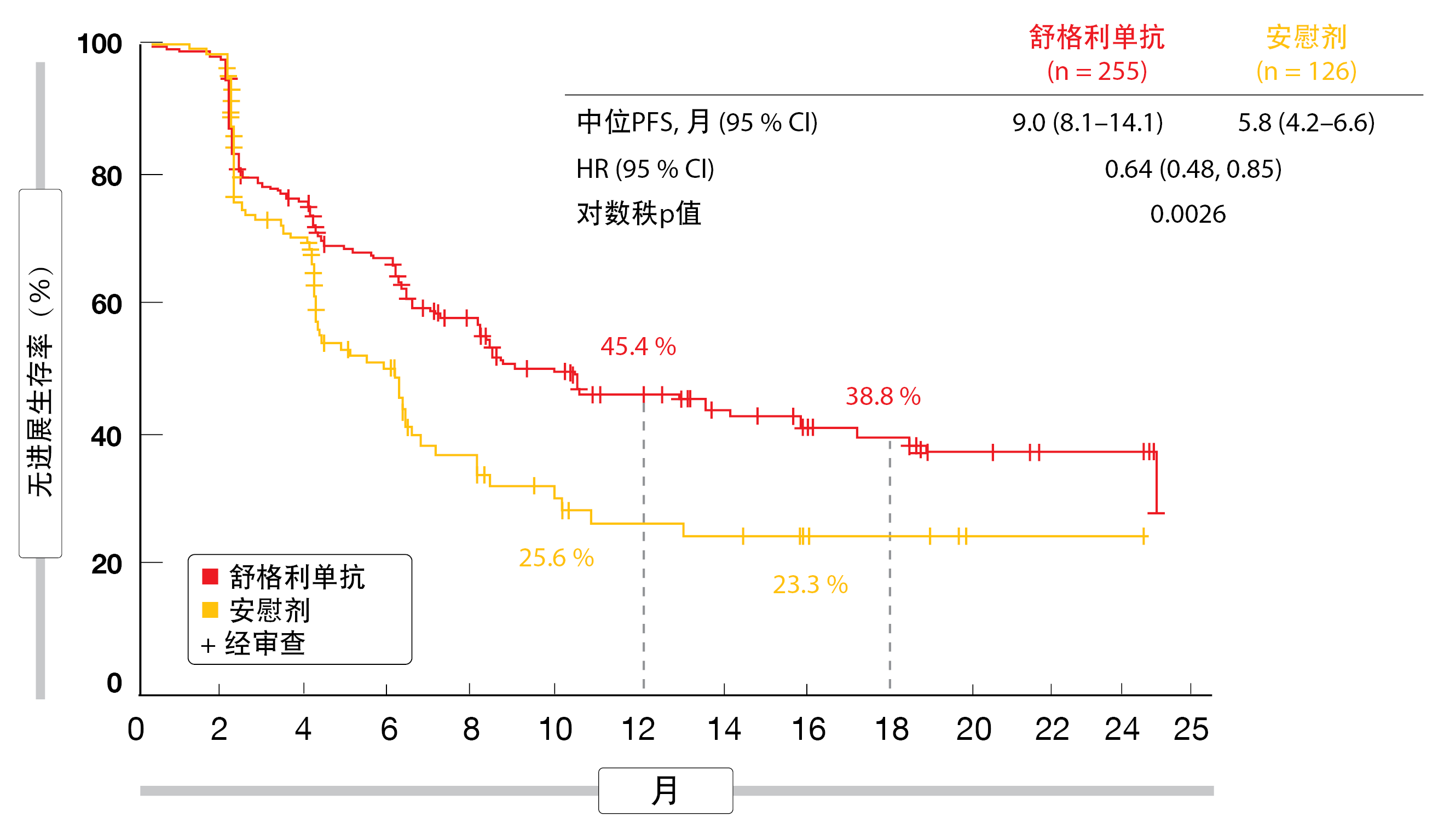
根据盲法独立审查的PFS被定义为主要终点。根据Wu等人在ESMO 2021上报告的预先计划的中期分析,舒格利单抗产生了具有统计学显著性和临床意义的PFS改善(9.0个月与5.8个月;HR,0.64;p=0.0026;图2)[14]。在同步CRT后的组中,中位PFS为10.5个月与6.4个月(HR,0.66),而在序贯CRT后的患者中,中位PFS为8.1个月与4.1个月(HR,0.59)。在分析时,OS数据尚不成熟,但舒格利单抗与安慰剂相比,生存获益的趋势很明显(总体人群中的未达到与24.1个月;HR,0.44)。实验组中治疗的患者在24个月时存活的比例明显更高(78.0%与50.7%)。
舒格利单抗显示出良好的安全特性,这与之前报告的舒格利单抗单药疗法用于NSCLC的概况一致。免疫相关AE在实验组中的发生率为42.7%,其中4.7%被分类为3-5级事件。治疗期间出现的AE导致的治疗周期延迟和永久停药分别占32.2%和11.4%。作者在其总结中指出,在GEMSTONE-301研究中获得的结果表明,舒格利单抗作为巩固疗法在同步或序贯CRT后不可切除的III期NSCLC中是有效的。
图2: 对于无法切除的III期肺癌,在同步或序贯放化疗后舒格利单抗与安慰剂相比的无进展生存优势
LungART数据的辅助评估
随机化III期LungART试验在252名患有完全切除的NSCLC且在术前和/或术后化疗后N2淋巴结受累的患者中评估了经5.5周递送的54 Gy剂量的适形术后放疗(PORT)的效果。DFS构成主要终点。根据2020年介绍的主要分析,与无PORT相比(n=249),PORT仅略微增加了DFS(30.5个月与22.8个月;HR,0.86;p=0.18),3年DFS率为47.1%与43.8% [15]。3年时,66.5%与68.5%的患者存活。虽然PORT降低了纵隔复发的风险,但远处转移事件和脑转移的可能性并未降低。Le Pechoux等人在其最近的分析中关注于研究中观察到的失败模式和PORT疗效的预后因素[16]。
该分析表明纵隔复发主要发生在最初受累的淋巴结内。纵隔复发最常受影响的3个部位是右侧肿瘤的4R、2R和7站,以及左侧肿瘤的7、4L和4R站。就DFS的预后因素而言,女性、鳞状组织学和无淋巴结受累被认为是保护性的。除了年龄和WHO表现状态外,淋巴结疾病的负荷以及切除的质量与DFS相关。PORT组的3年无纵隔复发生存期明显延长,这一点与淋巴结疾病的负荷和是否存在包膜外扩展无关。作者得出结论,PORT的个性化使用应基于复发的预后因素以及对这种治疗方法的毒性和疗效的联合评估。
参考文献
- Vansteenkiste J et al., Current status of immune checkpoint inhibition in early-stage NSCLC. Ann Oncol 2019; 30(8): 1244-1253#
- Wakelee H et al., IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC). J Clin Oncol 2021; 39(suppl 15): 8500
- Felip E et al., IMPower010: sites of relapse and subsequent therapy from a phase 3 study of atezolizumab vs best supportive care after adjuvant chemotherapy in resected stage IB-IIIA NSCLC. ESMO 2021, LBA9
- Altorki N et al., IMpower010: characterization of stage IB-IIIA NSCLC patients by type and extent of therapy prior to adjuvant atezolizumab. WCLC 2021, PL02.05
- Provencio M et al., Neoadjuvant chemotherapy and nivolumab in resectable non-small-cell lung cancer (NADIM): an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol 2020; 21(11): 1413-1422
- Provencio M et al., Long term survival in operable stage IIIA NSCLC patients treated with neoadjuvant nivolumab plus chemotherapy – NADIM study. WCLC 2021, OA20.01
- Spigel DR et al., Five-year survival outcomes with durvalumab after chemoradiotherapy in unresectable stage III NSCLC: An update from the PACIFIC trial. J Clin Oncol 39, 2021 (suppl 15; abstr 8511)
- Girard N et al., PACIFIC-R real-world study: treatment duration and interim analysis of progression-free survival in unresectable stage III NSCLC patients treated with durvalumab after chemoradiotherapy. ESMO 2021, 1171M0
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017; 377(20): 1919-1929
- Wennerberg E et al., CD73 blockade promotes dendritic cell infiltration of irradiated tumors and tumor rejection. Cancer Immunol Res 2020; 8(4): 465-478
- Tsukui H et al., CD73 blockade enhances the local and abscopal effects of radiotherapy in a murine rectal cancer model. BMC Cancer 2020; 20(1): 411
- Nguyen AM et al., Upregulation of CD73 confers acquired radioresistance and is required for maintaining irradiation-selected pancreatic cancer cells in a mesenchymal state. Mol Cell Proteomics 2020; 19(2): 375-389
- Martinez-Marti A et al., COAST: an open-label, phase 2, multidrug platform study of durvalumab alone or in combination with novel agents in patients with locally advanced, unresectable, stage III NSCLC. ESMO 2021, LBA42
- W Y-L et al., GEMSTONE-301: a randomized, double-blind, placebo-controlled, phase 3 study of sugemalimab in patients with unresectable stage III non-small cell lung cancer without progression after concurrent or sequential chemoradiotherapy. ESMO 2021, LBA43
- Le Pechoux C et al., An international randomized trial comparing post-operative radiotherapy (PORT) to no PORT, in patients with completely resected NSCLC and mediastinal N2 involvement. ESMO 2020, LBA3_PR
- Le Pechoux C et al., An international randomized trial comparing post-operative conformal radiotherapy (PORT) to no PORT in patients with completely resected non-small cell lung cancer and mediastinal N2 involvement. ESMO 2021, 11700
© 2022 Springer-Verlag GmbH, Impressum
More posts
早期疾病环境中的治疗扩展和见解
早期疾病环境中的治疗扩展和见解 治疗I-III期非小细胞肺癌(NSCLC)患者的医疗需求仍远未得到满足,因为尽管进行了治愈性治疗,仍有高达60%的患者出现疾病
序言
序言 Alex A. Adjei, MD, PhD 美国罗契斯特市梅约诊所肿瘤学和药理学教授 2021年ESMO终身成就奖获得者 亲爱的同事们, 世界肺癌大