跨越一系列靶标的创新成熟药剂
抗HER2治疗
DESTINY-Lung01:T-DXd的强大效果
在大约3%的非鳞状NSCLC病例中,HER2突变构成了主要的驱动畸变[1, 2]。虽然仍缺乏经批准的针对NSCLC患者的HER2靶向疗法,但抗HER2抗体-药物偶联物德卢替康-曲妥珠单抗(T-DXd)已在多个国家获得许可用于其他HER2阳性肿瘤。国际、2队列、II期DESTINY-Lung01研究在HER2过表达和HER2突变的转移性NSCLC患者中探索了T-DXd,这些患者在标准治疗时复发或是标准治疗难治的。在ESMO 2021上,Li等人介绍了对完全入组的HER2突变组(即队列2)的主要分析,该突变组共包含91名接受6.4 mg/kg T-DXd Q3W治疗的患者[3]。大约95%的患者接受了铂类化疗,65.9%接受了抗PD-(L)1疗法和62.6%接受了这两种治疗。
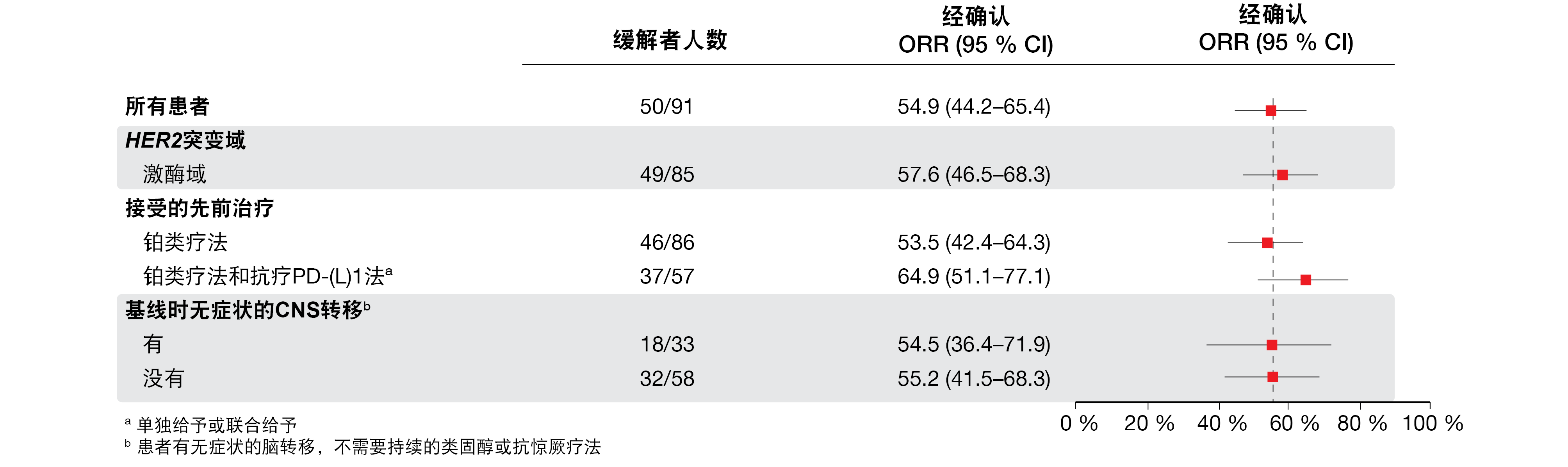
T-DXd在这些患者中显示出强大而持久的抗癌活性。客观缓解率(ORR)为54.9%,92.3%的患者实现临床获益。在包括具有稳定CNS病变的患者在内的亚组中一致观察到缓解(图1),并且持续的中位时间为9.3个月。探索性分析证明了在不同HER2突变亚型以及在未检测到HER2表达和HER2基因扩增的患者中的抗癌活性。中位无进展生存期(PFS)和总生存期(OS)分别为8.2个月和17.8个月。
与停药相关的最常见的治疗期间出现的AE(TEAE)是研究者报告的肺炎(13.2%)和间质性肺病(ILD;5.5%)。75%的经裁定的药物相关ILD/肺炎病例为1或2级。然而,作者指出,这些事件仍然是一个重要的已识别风险,需要有效的早期检测和管理。TEAE相关的剂量减少发生在34.1%的患者中,主要是由于恶心(11.0%)和疲劳(8.8%)。
作者在其结论中指出,DESTINY-Lung01提供了令人信服的证据,证明T-DXd在二线和较后治疗线条件下具有积极的收益-风险平衡。数据支持将T-DXd作为潜在的新治疗标准实施。同时,DESTINY-Lung02试验正在探索5.4 mg/kg剂量,以确定HER2突变型NSCLC患者的最佳给药方案。
图1: 在患有HER2突变型NSCLC的患者中用德卢替康-曲妥珠单抗观察到的亚组间一致的缓解
HER2外显子20插入中的波齐替尼
多队列全球ZENITH20试验正在各种条件下评估泛-HER酪氨酸激酶抑制剂(TKI)波齐替尼,这些条件包括EGFR或HER2外显子20插入突变、非典型EGFR或HER2突变以及奥希替尼(osimertinib)治疗失败后。在该研究的队列4中,正在带有HER2外显子20插入的患者中探索一线波齐替尼;其中48人接受每日一次16 mg,而用每日两次8 mg治疗的23名患者的组仍在招募过程中。Cornelissen等人在ESMO 2021上报告了队列4中每日一次给药组的初步疗效和安全性数据[4]。
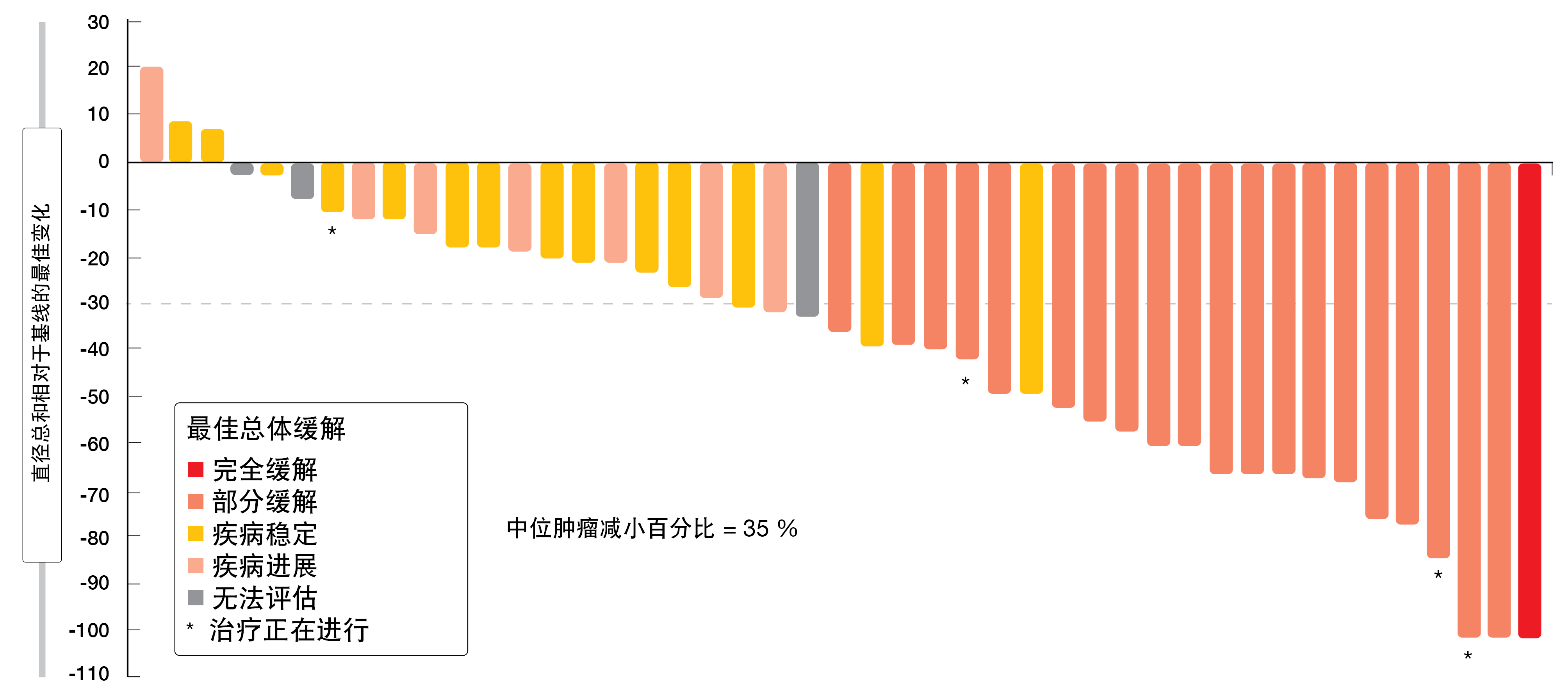
关于已被定义为主要终点的客观缓解,治疗诱导了经集中审查确认的43.8%的比率。疾病控制率为75.0%。88%的患者经历了肿瘤缩小(图2)。中位PFS为5.6个月,其中26%的患者存活且无进展超过12个月。缓解持续的中位时间为5.4个月;此处,上限为>19.1个月。波齐替尼显示出可控的毒性概况,这与之前的波齐替尼研究和其他第二代EGFR TKI一致。观察到最常见的AE为腹泻、皮疹和口腔炎。导致剂量减少和永久停药的AE的发生率分别为77%和13%。总体而言,每日一次的波齐替尼治疗在携带HER2外显子20插入突变的NSCLC初治患者中显示出具有临床意义的疗效。
图2: 在接受波齐替尼的带有HER2外显子20插入的患者中,目标肿瘤大小相对于基线的减小
EGFR/MET抑制:埃万妥单抗
伴随诊断和与拉泽替尼(lazertinib)的组合
基于正在进行的I期CHRYSALIS试验,EGFR/MET双特异性抗体埃万妥单抗已在美国获批用于治疗在铂类化疗期间或之后进展的患有EGFR外显子20插入阳性NSCLC的患者。CHRYSALIS正在各种条件下评估埃万妥单抗作为单药疗法以及与第三代EGFR TKI 拉泽替尼联合使用。进行了一项桥接研究以临床验证两种潜在的基于NGS的伴随诊断,即基于血浆的Guardant360® CDx和基于组织的Oncomine™ Dx目标测试,用于检测EGFR外显子20插入变体。根据WCLC 2021上介绍的结果,这些测试显示出高度的一致性,两种伴随诊断均可用于准确识别患者进行埃万妥单抗治疗[5]。
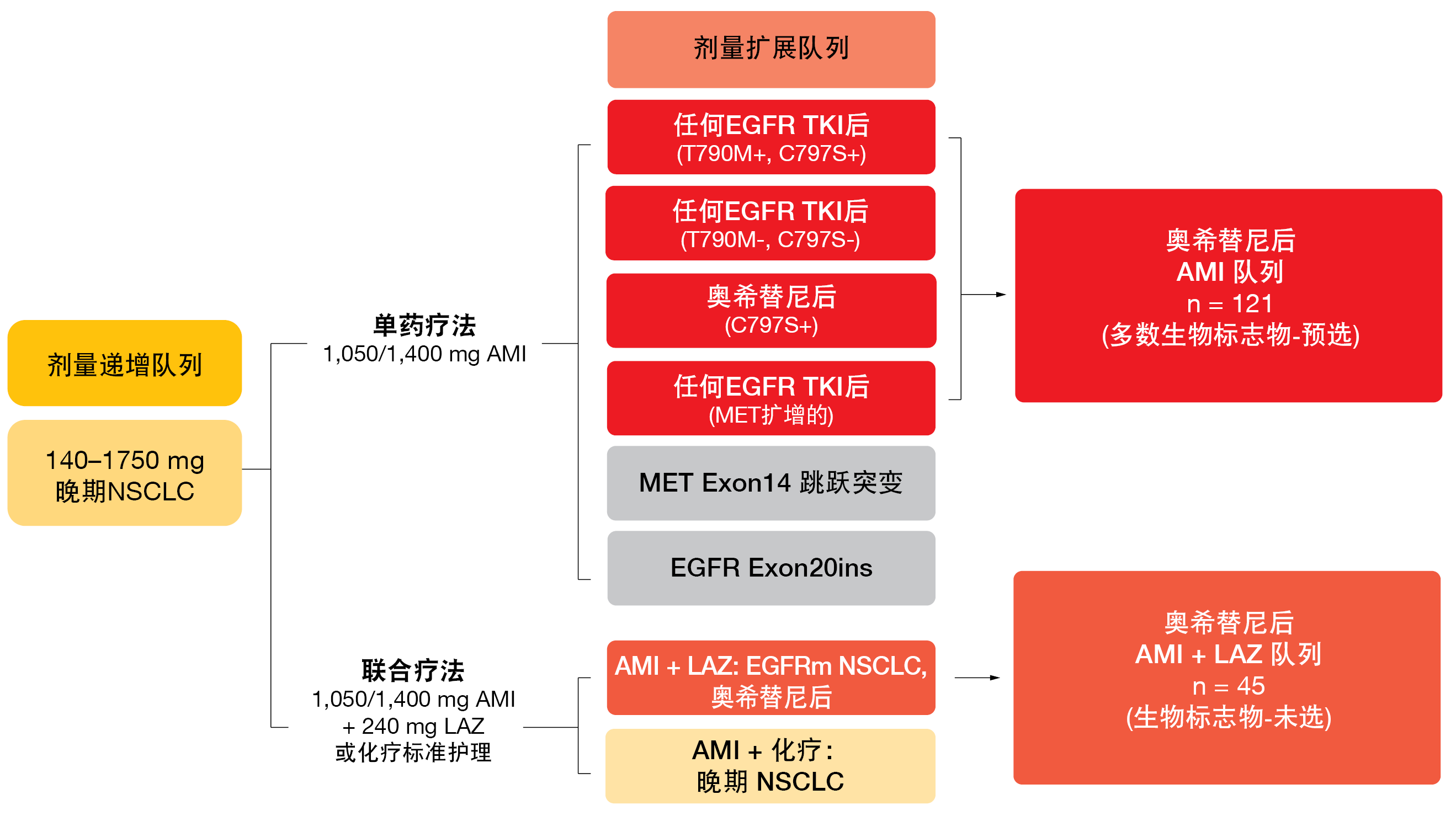
在ESMO 2021上,Leighl等人报告了关于在奥希替尼失败后在埃万妥单抗之外添加拉泽替尼的作用的CHRYSALIS数据[6]。埃万妥单抗加拉泽替尼队列与埃万妥单抗单药疗法队列分别包含45和121名患者(图3)。实际上,联合疗法表现得比单药疗法具有更高的活性。与单独埃万妥单抗相比,加入拉泽替尼导致在数值上更高的ORR(分别为36%和19%)和更长的缓解持续时间(分别为9.6个月和5.9个月)。≥6个月的缓解的发生率分别为69%和39%。考虑到联合队列的CNS进展率7%低于埃万妥单抗单药疗法队列中的17%,联合队列的CNS保护可能提高。
单药疗法和联合疗法的安全特性均与先前报告的经验一致。正在CHRYSALIS-2研究和III期MARIPOSA试验中评估埃万妥单抗加拉泽替尼用于多个EGFR NSCLC人群。
图3: 探索埃万妥单抗(AMI)单独使用和埃万妥单抗与拉泽替尼(LAZ)联合使用的CHRYSALIS 试验的设计
MET外显子14跳跃突变中的发现
Spira等人报告了在入组CHRYSALIS研究的患者队列中获得的埃万妥单抗的首个结果,这些患者的肿瘤携带MET外显子14跳跃(METex14)突变[7]。这些突变发生在大约3%的NSCLC病例中[8]并且适合用MET TKI治疗,但耐药性的出现是这里的一个主要问题。CHRYSALIS中纳入的METex14人群仍在募集中;分析中包含了在标准护理治疗后出现进展或拒绝接受标准护理治疗的19名患有转移性或不可切除NSCLC的患者。
在14名可评估缓解的患者中,9名(64%)在采用埃万妥单抗疗法时产生了部分缓解,其中5名经确认,4名待确认。在初治和先前接受过治疗的患者中均观察到活性;这包括7名之前接受过MET TKI治疗的个体,其中两人显示出潜在的耐药机制。尚未达到中位缓解持续时间,14名可评估缓解的患者中有11名仍在接受治疗。
埃万妥单抗在该患者亚组中的安全特性与先前报告的在EGFR突变型NSCLC患者中观察到的特性一致。据作者称,埃万妥单抗在METex14阳性NSCLC中的首次报告证实了该药物的双特异性靶向作用,其中单药疗法的活性在EGFR驱动和MET驱动的NSCLC中均得到证实。
抗-c-MET ADC维汀-特立妥珠单抗
一项正在进行的单组、2阶段、适应性II期研究正在具有c-Met蛋白过表达的经先前治疗的、局部晚期或转移性NSCLC中评估同类首个抗-c-MET抗体药物偶联物维汀-特立妥珠单抗。该试验包含基于组织学和EGFR突变状态的三个队列:鳞状队列、具有EGFR突变的非鳞状队列和具有EGFR野生型的非鳞状队列。每个非鳞状组进一步分为显示高或中等c-Met表达的两个亚组。在第一阶段之后,根据ORR决定继续进入扩展阶段的患者。维汀-特立妥珠单抗的给药剂量为1.9 mg/kg Q2W。
Camidge等人在ESMO 2021上报告的中期分析涉及37名患者的非鳞状EGFR野生型人群和31名患者的非鳞状EGFR突变人群,以及22名患者的鳞状队列[9]。基于H评分的C-Met表达在EGFR野生型人群(中位数,225)中低于具有EGFR突变的组(265),而在鳞状队列中观察到最低评分(164)。在非鳞状患者中,大多数带有EGFR突变的患者显示出高c-Met表达(71%),而中等c-Met表达在具有EGFR野生型的组中占优势(65%)。
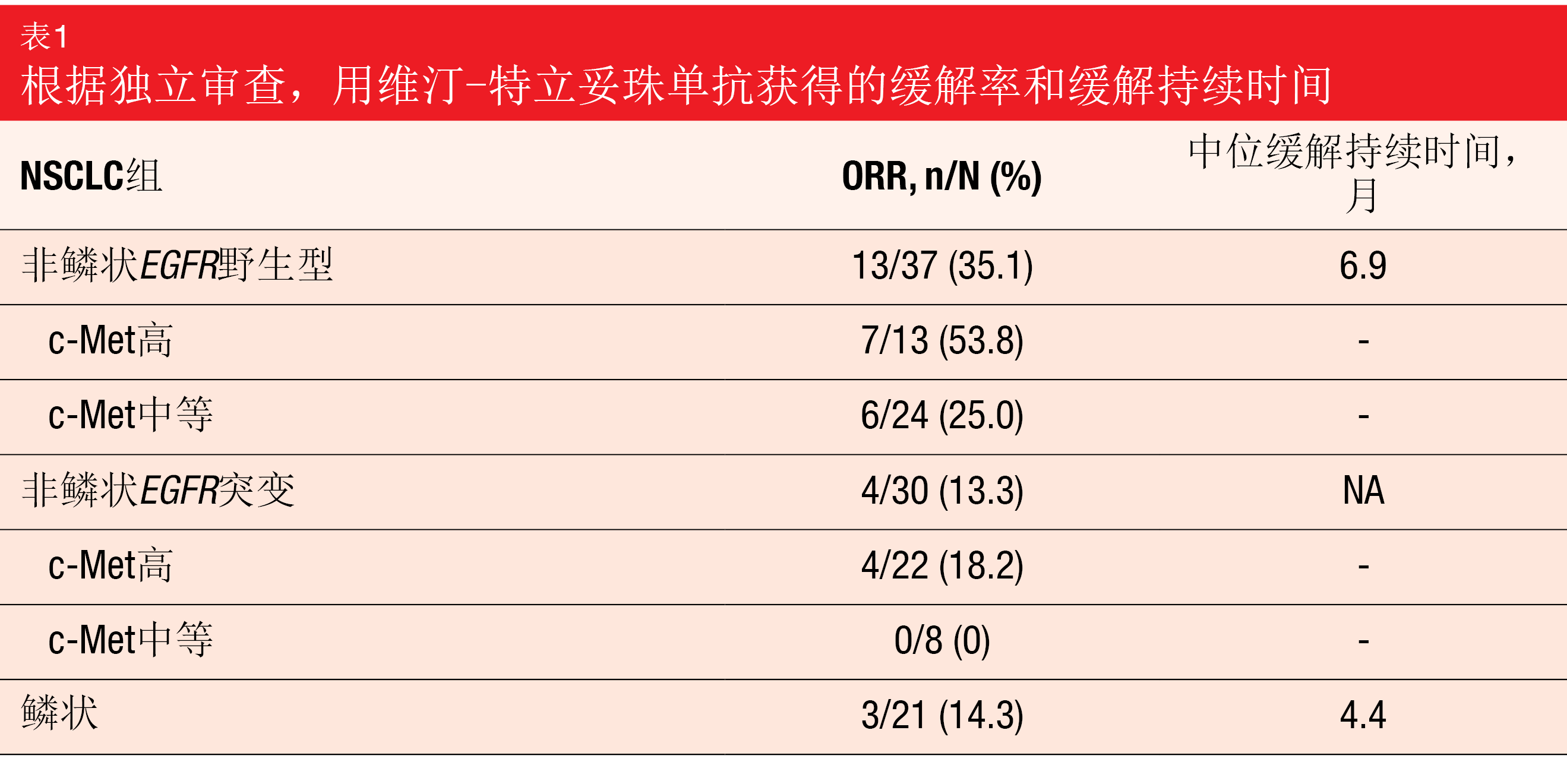
维汀-特立妥珠单抗在非鳞状EGFR野生型队列中表现出35.1%的有希望的ORR(表1)。该队列中具有高c-Met表达的患者中的53.8%实现了缓解,从而获得了所有组中最高的ORR,但具有中等c-Met表达的患者中的ORR也具有临床意义。根据预先指定的标准,该队列已扩展到第2阶段招募。所有其他组都有适度的响应。最常见的严重TEAE是感染性肺炎(pneumonia)(5%)、恶性肿瘤进展(4%)和肺炎肿(pneumonitis)(4%)。44%的患者发生≥3级TEAE。鳞状队列已停止招募,但EGFR突变队列将继续招募,直到下一次中期分析。
EGFR 外显子20插入
成功TKI治疗后的莫博替尼
基于初步的I/II期结果,特异性靶向EGFR外显子20插入的EGFR TKI莫博替尼已被授予突破性疗法,指定用于治疗在接受铂类化疗时(美国)或先前化疗后(中国)发生进展后的具有EGFR外显子20插入突变的NSCLC患者[10]。在ESMO 2021上,Spira等人介绍了在I/II期研究中,在接受任何先前EGFR TKI疗法时出现客观缓解或疾病稳定≥6个月后疾病进展的患者的扩展队列中的疗效和安全性数据[11]。20名患者接受160 mg莫博替尼,每日一次。先前的TKI疗法包括波齐替尼、奥希替尼、阿法替尼和厄洛替尼。在55%的患者中,EGFR TKI已作为最近的先前治疗给药,包括波齐替尼(n=7)、奥希替尼(n=3)和研究性TKI(n=1)。先前TKI疗法的中位时间为7.8个月。
莫博替尼治疗为该患者组提供了具有临床意义的益处。中位随访14.2个月后,确认的ORR和疾病控制率分别为40%和90%。中位缓解持续时间为13.0个月。中位PFS为7.3个月,中位OS尚未达到。在12个月时,78.6%的患者存活。分析进一步表明,安全特性与I/II期试验的其他患者队列相似,并且与多种EGFR TKI一致。在全级别的治疗相关AE中,腹泻最常见(90%),≥3级腹泻仅出现在一名患者中。AE导致4名患者(20%)的剂量减少,2名(10%)因AE停止治疗。作者得出结论,对于EGFR外显子20插入阳性的转移性NSCLC患者,包括那些在先前EGFR TKI疗法时经历客观缓解的患者,莫博替尼代表了一种潜在的有希望的治疗选择。
新型抑制剂DZD9008
选择性、不可逆EGFR/HER2抑制剂DZD9008正在开发用于治疗患有NSCLC且带有EGFR或HER2突变的患者。在两项正在进行的I期研究WU-KONG1和WU-KONG2中,DZD9008在具有不同亚型的EGFR外显子20插入突变的经大量先前治疗的患者中显示出令人鼓舞的抗肿瘤活性[12]。这两项试验都包含若干剂量递增队列和剂量扩展队列;此外,WU-KONG1具有食物影响队列。总体上,在两项研究中,安全性组包含102名接受至少一剂50 mg至400 mg DZD9008(每日一次)治疗的患者。疗效组包含56名带有EGFR外显子20插入的患者,他们每日接受一次50 mg至400 mg DZD9008,随后至少进行一次治疗后RECIST评估。其中分别有18名和38名患者来自剂量递增队列和剂量扩展队列。
这种新型药物显示出良好的药代动力学属性,半衰期约为50小时,高脂肪食物对暴露等没有明显影响。关于抗肿瘤功效,在剂量递增队列和剂量扩展队列中,在所有剂量水平下的确认ORR分别为22.2%和44.7%。在有和没有基线脑转移的患者中,以及不同的EGFR外显子20插入亚型之间,在≥100 mg的剂量下都观察到疗效。最长的治疗持续时间超过17个月。在分析时尚未达到中位PFS。DZD9008的耐受性良好,AE特性可控。在所有剂量水平中,33.3%的患者发生≥3级的药物相关AE。分别在15.7%和5.9%的患者中观察到导致剂量减少或停药的AE。正在进行一项II期研究来评估DZD9008在经先前治疗的携带EGFR外显子20插入的NSCLC患者中的效果。
EGFR TKI与贝伐单抗(bevacizumab)的组合
BEVERLY:厄洛替尼
研究表明,向第一代EGFR TKI加入VEGF抑制剂可以延长EGFR突变型非鳞状NSCLC中的PFS [13-15]。多中心、随机化、III期BEVERLY试验测试了抗VEGF抗体贝伐单抗与厄洛替尼联合用于IIIB或IV期EGFR阳性NSCLC患者的一线治疗。共有160名个体以1:1的方式随机接受150 mg厄洛替尼每日一次加15 mg/kg贝伐单抗Q3W,或单药厄洛替尼。
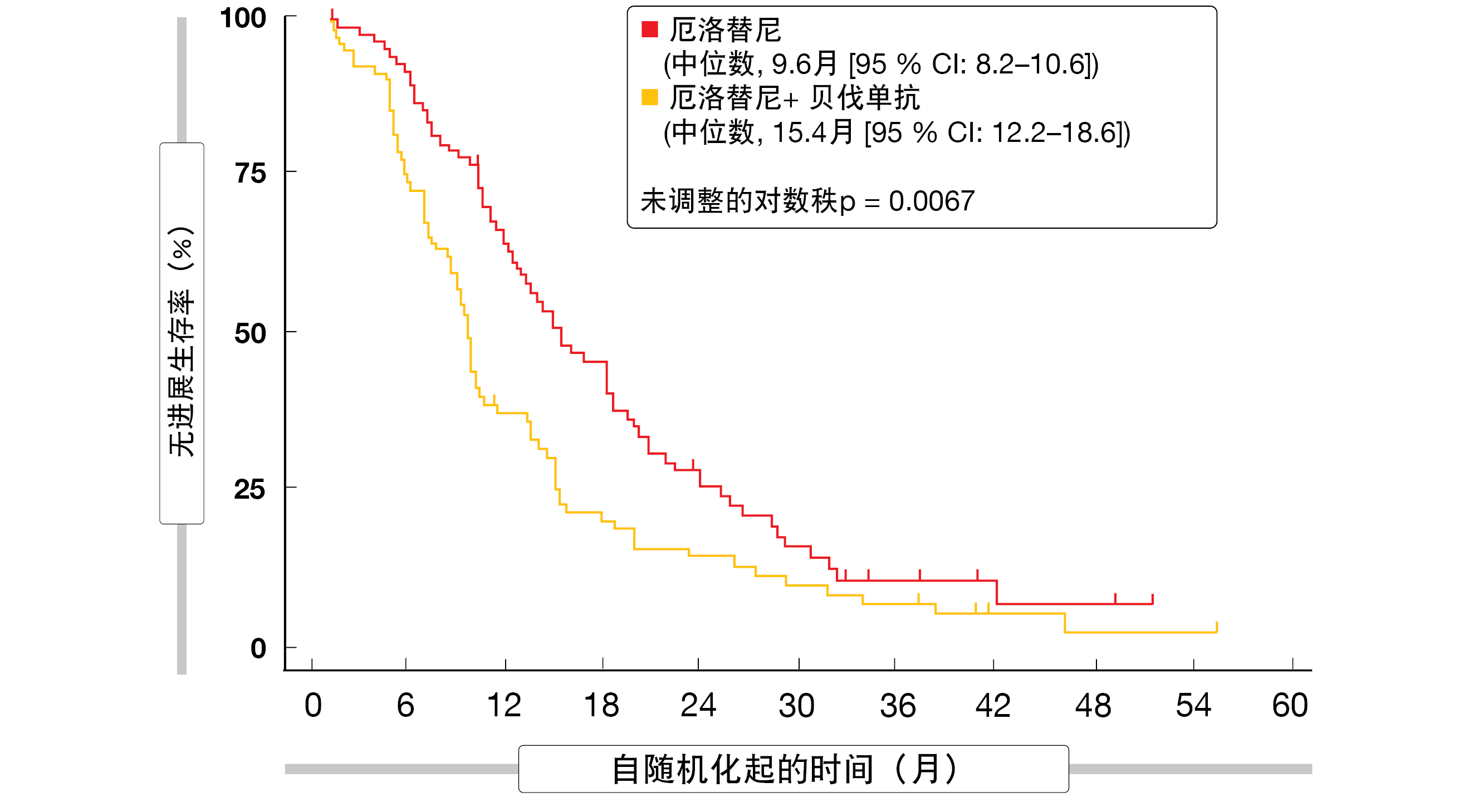
与仅使用厄洛替尼相比,贝伐珠单抗与厄洛替尼的联合给药显著改善了PFS(15.4个月与9.6个月;HR,0.66;p=0.015;图4)和ORR(70%与50%;p=0.01),而OS以不显著的方式延长(33.3个月与22.8个月;HR,0.72;p=0.132)[16]。PFS和OS的探索性亚组分析表明,联合用药的益处可能在既往吸烟者和目前吸烟者中尤为明显。
生活质量分析显示,在EORTC C30-LC13问卷的任何项目中,治疗组之间没有明显差异。关于使总体健康状况/生活质量恶化的时间,实验组中的患者表现出稍好的结果,但这种差异并不显著。没有出现意外的安全信号。联合用药导致的严重高血压和皮疹的发生率更高。正如作者所说,贝伐单抗加厄洛替尼可被视为无法接受奥希替尼的患者的一线选择,并且该方案值得进一步研究。
图4: 在BEVERLY试验中将贝伐单抗加入厄洛替尼中实现的无进展生存率
WJOG9717L:奥希替尼
在WJOG9717L研究中未发现将贝伐单抗加入另一EGFR靶向药中的益处[17]。将80 mg奥希替尼每日一次(n=61)加15 mg/kg贝伐单抗Q3W与奥希替尼单药(n=61)进行了比较。联合用药在PFS(22.1个月与20.2个月;p=0.213)、ORR(82%与86%)和OS(HR,0.970)方面没有表现出优势,但亚组分析表明,既往吸烟者或外显子19缺失的患者可从贝伐单抗的加入中获得PFS益处(HR分别为0.481和0.622)。根据AE分析,联合用药可降低奥希替尼相关的肺炎风险,但在实验组中高血压、鼻衄和蛋白尿的发生率要高得多。
关于阿法替尼使用的现实世界经验
UpSwinG:序贯治疗
在EGFR突变型NSCLC患者中,生存结果在很大程度上取决于在对一线疗法产生耐药性后的后续疗法的可用性和实施情况。由于T790M突变是高达50-70%的病例对阿法替尼产生耐药性的原因[18]并且对奥希替尼高度敏感,因此阿法替尼和奥希替尼的序贯使用可能有助于最大限度地延长靶向治疗的持续时间。在非干预性全球UpSwinG研究中,分析了健康记录以在常规临床实践中评估在获得T790M突变后先用一线阿法替尼后用二线奥希替尼的患者结果。在WCLC 2021上报告的分析包括191名患者,主要是亚洲人和女性[19]。大约14%有脑转移。
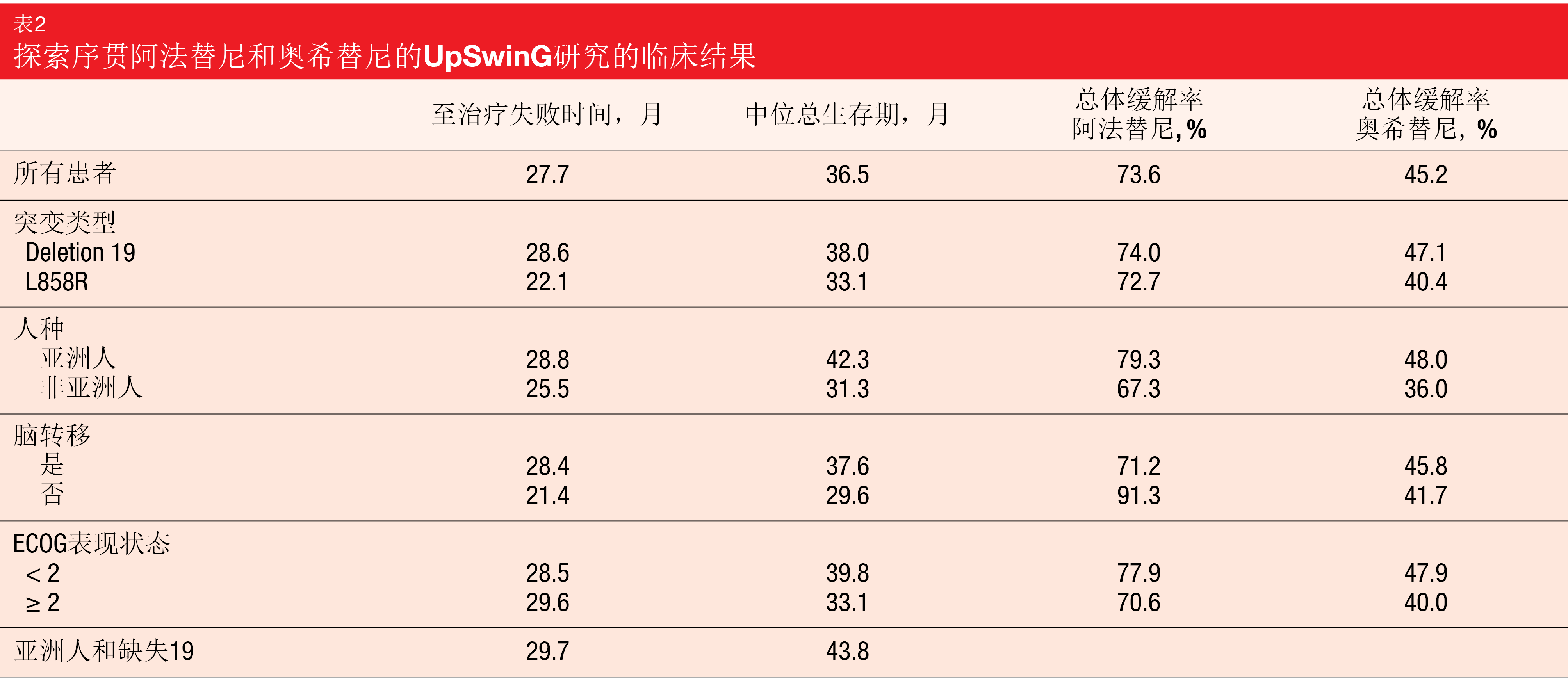
阿法替尼和奥希替尼的中位治疗持续时间分别为15.1个月和9.5个月。近一半的患者在奥希替尼后有至少一个另外的治疗线,该治疗线主要由化疗组成(84.5%)。被定义为主要终点的至治疗失败时间为27.7个月,中位OS为36.5个月(表2)。这些结果在包括ECOG PS≥2和脑转移的亚组在内的各亚组中是一致的。亚洲患者(42.3个月)和具有缺失19突变的亚洲患者(43.8个月)的中位OS最长。作者指出,这些数据特别令人感兴趣,因为与一线EGFR TKI相比,奥希替尼已被证明不会为亚洲人带来明显的OS益处[20]。
总体而言,UpSwinG研究的结果验证了之前的研究,例如GioTag,其在接受序贯阿法替尼和奥希替尼治疗的带有获得性T790M的患者中表现出> 3年的令人鼓舞的OS [21]。然而,UpSwinG中包括的大多数患者都接受了组织活检,并且主要基于PCR技术检测突变。作者指出,更多地实施新一代测序和液体活检可增加能从靶向治疗中受益的患者数量。
老年患者和罕见突变
Brückl等人介绍了对前瞻性、非干预性GIDEON研究中包含的老年患者进行的事后分析的最终结果,该研究探索了德国常规临床实践中的一线阿法替尼治疗[22]。在GIDEON中接受治疗的患者中有43%(n=66)的年龄≥70岁。与70岁以下的人群相比,该组的ECOG表现状态往往更差,合并症数量更多(Charlson合并症指数≥1,36%与9%)。尽管如此,治疗效果似乎并未受到影响。≥70岁和>70岁组的PFS结果相当,12个月PFS率分别为58.9%和43.9%。中位OS分别为30.4个月和27.4个月。此外,老年患者表现出相似的安全特性和≥3级AE的发生率。由于AE而需要剂量减少和停药的比例相近。
缺乏EGFR TKI在带有罕见EGFR突变(即非缺失19/L858R)的NSCLC患者中的活性的临床数据。在ESMO 2021上报告了对随机化对照试验和现实世界实践中接受阿法替尼治疗的带有罕见EGFR突变的NSCLC患者的数据库进行的最新分析[23]。总共确定了1,023名患者;他们中的大多数人在临床研究或同情用药计划中接受了治疗。
在至治疗失败时间和ORR方面,阿法替尼对主要罕见突变、复合突变和其他罕见突变(包括E709X和L747X突变)表现出明显的活性。对于至治疗失败时间,无论人种如何(亚洲和非亚洲TKI初治患者分别为11.5和10.3个月)和存在脑转移(8.2个月)与否,都观察到了令人鼓舞的结果。分析还显示了针对残基A763、M766、N771和V769处的某些外显子20插入的活性,以及针对奥希替尼耐药突变G724S、L718Q、L718V和C797S的活性。在奥希替尼后接受阿法替尼治疗的15名患者中,ORR和疾病控制率分别为36%和100%。
TROP2靶向疗法
TROPION-PanTumor01的最新情况
已开发出抗体-药物偶联物datopotamab deruxtecan(Dato-DXd)来靶向跨膜糖蛋白TROP2,无论基因组突变状态如何,该蛋白在NSCLC中高度表达并且与不良预后相关[24-26]。Dato-DXd在不同肿瘤类型的剂量递增/剂量扩展I期TROPION-PanTumor01研究中进行了测试。在NSCLC队列中,各有50名患者接受4 mg/kg Dato-DXd和6 mg/kg Dato-DXd,80名患者接受8 mg/kg治疗。
先前对TROPION-PanTumor01研究的分析证实了在这个经过大量先前治疗的NSCLC队列中有希望的抗肿瘤活性以及可控制的安全特性[27, 28]。在WCLC 2021上,Garon等人介绍了最新结果,表明Dato-DXd在所有三种剂量下继续表现出非常令人鼓舞的疗效和可控的安全特性[29]。已被选择用于进一步开发的6 mg/kg剂量产生了28%的ORR和10.5个月的中位缓解持续时间。大多数缓解随着时间的推移是持久的。TEAE主要是非血液学的(即恶心、口腔炎、脱发、疲劳),并且大多被归类为轻度或中度。在6 mg/kg队列中,被判定为与药物相关的ILD的发生率为6%。III期TROPION-Lung01试验目前正在评估Dato-DXd用于治疗NSCLC。
Dato-DXd用于携带可操作畸变的患者
在ESMO 2021上介绍的TROPION-PanTumor01亚组分析涉及具有可操作基因组改变(AGA)的患者[30]。众所周知,一旦TKI和铂类化疗失败,则该组能从现有疗法中获得的益处有限[31, 32]。TROPION-PanTumor01的NSCLC队列中包含的AGA亚组包括34名具有EGFR突变(85%)、ALK融合(9%)、ROS1融合(3%)和RET融合(3%)的患者。82%的患者已经接受了≥3个先前的治疗线。
在这个经过大量先前治疗的人群中观察到Dato-DXd具有非常令人鼓舞的抗肿瘤活性。ORR为35%,中位缓解持续时间为9.5个月;这与研究的总体NSCLC人群一致[29]。即使在奥希替尼失败后的EGFR突变条件下也出现了临床活性。AE通常为1级和2级,恶心和口腔炎是最常见的事件。安全特性被证明是可控的并且与在总体NSCLC组中观察到的一致[29]。TROPION-Lung05试验正在NSCL中进一步评估Dato-DXd。
参考文献
- Stephens P et al., Lung cancer: intragenic ERBB2 kinase mutations in tumours. Nature 2004; 431(7008): 525-526
- Mazières J et al., Lung cancer that harbors an HER2 mutation: epidemiologic characteristics and therapeutic perspectives. J Clin Oncol 2013; 31(16): 1997-2003
- Li BT et al., Primary data from DESTINY-Lung01: a phase 2 trial of trastuzumab deruxtecan in patients with HER2-mutated metastatic non-small cell lung cancer. ESMO 2021, LBA45
- Cornelissen R et al., Efficacy and safety of poziotinib in treatment-naïve NSCLC harboring HER2 exon 20 mutations: a multinational phase 2 study (ZENITH20-4). ESMO 2021, LBA46
- Jatkoe T et al., Validation of companion diagnostics for the identification of patients with EGFR exon20ins NSCLC for amivantamab therapy. WCLC 2021, P24.14
- Leighl N et al., Amivantamab monotherapy and in combination with lazertinib in post-osimertinib EGFR-mutant NSCLC: analysis from the CHRYSALIS study. ESMO 2021, 1192M0
- Spira AI et al., Amivantamab in non-small cell lung cancer with MET exon 14 skipping mutation: initial results from CHRYSALIS. WCLC 2021, OA15.03
- Frampton GM et al., Activation of MET via diverse exon 14 splicing alterations occurs in multiple tumor types and confers clinical sensitivity to MET inhibitors. Cancer Discov 2015; 5(8): 850-859
- Camidge DR et al., Telisotuzumab vedotin monotherapy in patients with previously treated c-Met+ advanced non-small cell lung cancer. WCLC, OA 15.04
- Riely GR et al., Activity and safety of mobocertinib (TAK-788) in previously treated non-small cell lung cancer with EGFR exon 20 insertion mutations from a phase I/II trial. Cancer Discov 2021; 11(7): 1688-1699
- Spira AI et al., Mobocertinib in EGFR exon 20 insertion-positive metastatic NSCLC patients with disease control on prior EGFR TKI therapy. ESMO 2021, OA15.01
- Jänne P et al., Phase 1 studies of DZD9008, an oral, selective EGFR/HER2 inhibitor in advanced NSCLC with EGFR exon20 insertion mutation. WCLC 2021, OA15.02
- Seto T et al., Erlotinib alone or with bevacizumab as first-line therapy in patients with advanced non-squamous non-small-cell lung cancer harbouring EGFR mutations (JO25567): an open-label, randomised, multicentre, phase 2 study. Lancet Oncol 2014; 15(11): 1236-1244
- Saito H et al., Erlotinib plus bevacizumab versus erlotinib alone in patients with EGFR-positive advanced non-squamous non-small-cell lung cancer (NEJ026): interim analysis of an open-label, randomised, multicentre, phase 3 trial. Lancet Oncol 2019; 20(5): 625-635
- Nakagawa K et al., Ramucirumab plus erlotinib in patients with untreated, EGFR-mutated, advanced non-small-cell lung cancer (RELAY): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2019; 20(12): 1655-1669
- Piccirillo MC et al., Bevacizumab + erlotinib vs erlotinib alone as first-line treatment of patients with EGFR mutated advanced non squamous NSCLC. Final analysis of the multicenter, randomized, phase III BEVERLY trial. ESMO 2021, 12070
- Kenmotsu H et al., Primary results of a randomized phase II study of osimertinib plus bevacizumab versus osimertinib monotherapy for untreated patients with non-squamous non-small-cell lung cancer harboring EGFR mutations; WJOG9717L study. ESMO 2021, LBA44
- Girard N et al., Optimizing outcomes and treatment sequences in EGFR mutation-positive non-small-cell lung cancer: recent updates. Future Oncol 2019; 15(25): 2983-2997
- Popat S et al., Sequential afatinib and osimertinib in patients with advanced EGFRm+ NSCLC and acquired T790M: the real-world UpSwinG study. WCLC 2021, P51.05
- Kim ES et al., EGFR tyrosine kinase inhibitors for EGFR mutation-positive non-small-cell lung cancer: outcomes in Asian populations. Future Oncol 2021; 17(18): 2395-2408
- Hochmair MJ et al., Sequential afatinib and osimertinib in patients with EGFR mutation-positive non-small-cell lung cancer: final analysis of the GioTag study. Future Oncol 2020; 16(34): 2799-2808
- Brueckl WM et al., Elderly patients treated with afatinib in clinical practice – final results of the GIDEON study in EGFR mutated NSCLC in Germany. ESMO 2021, 1230P
- Yang JCH et al., Afatinib for the treatment of NSCLC with uncommon EGFR mutations: an updated database of 1023 cases. ESMO 2021, 1212P
- Mito R et al., Clinical impact of TROP2 in non-small lung cancers and its correlation with abnormal p53 nuclear accumulation. Pathol Int 2020; 70(5): 287-294
- Inamura K et al., Association of tumor TROP2 expression with prognosis varies among lung cancer subtypes. Oncotarget 2017; 8(17): 28725-28735
- Jiang A et al., Expression and clinical significance of the Trop-2 gene in advanced non-small cell lung carcinoma. Oncol Lett 2013; 6(2): 375-380
- Meric-Bernstam F et al., TROPION-PanTumor 01: dose analysis of the TROP2-directed antibody-drug conjugate datopotamab deruxtecan for the treatment of advanced or metastatic non-small cell lung cancer. J Clin Oncol 39, 2021 (suppl 15; abstr 9058)
- Spira A et al., Datopotamab deruxtecan (Dato-DXd; DS-1062), a TROP2 ADC, in patients with advanced NSCLC: updated results of TROPION-PanTumor01 phase 1 study. WCLC 2020, OA03.03
- Garon EB et al., TROPION-PanTumor01: updated results from the NSCLC cohort of the phase 1 study of datopotamab deruxtecan in solid tumors. WCLC 2021, MA03.02
- Garon EB et al., Efficacy of datopotamab deruxtecan in patients with advanced/metastatic non-small cell lung cancer and actionable genomic alterations: preliminary results from the phase 1 TROPION-PanTumor01 study. ESMO 2021, LBA49
- Scagliotti GV et al., Addressing the unmet need in lung cancer: The potential of immuno-oncology. Cancer Treat Rev 2015; 41(6): 465-475
- Maione P et al., Overcoming resistance to targeted therapies in NSCLC: current approaches and clinical application. Ther Adv Med Oncol 2015; 7(5): 263-273
© 2022 Springer-Verlag GmbH, Impressum