PARP抑制剂的新应用
转移性去势抵抗性前列腺癌
在雄激素受体(AR)靶向治疗(即恩杂鲁胺(enzalutamide)或阿比特龙(abiraterone))和紫杉烷类化疗后发生进展的转移性去势抵抗性前列腺癌(mCRPC)与预后不良相关联[1]。这些患者仅有很少的治疗选择。高达25 %的mCRPC男性在BRCA1、BRCA2、ATM或其他DNA损伤修复(DDR)基因中携带有害的种系和/或体细胞改变,包括在同源重组修复(HRR)中具有直接或间接作用的那些[2-4] 。这些改变与对PARP抑制的敏感性有关[5]。新兴数据表明了PARP抑制剂在具有mCRPC和DDR基因异常的患者中的临床活性[6-8]。PROfound、GALAHAD和TRITON2研究分别在晚期mCRPC中研究了使用奥拉帕尼、尼拉帕尼和芦卡帕尼(rucaparib)进行PARP抑制的临床获益。
奥拉帕尼:PROfound的主要分析
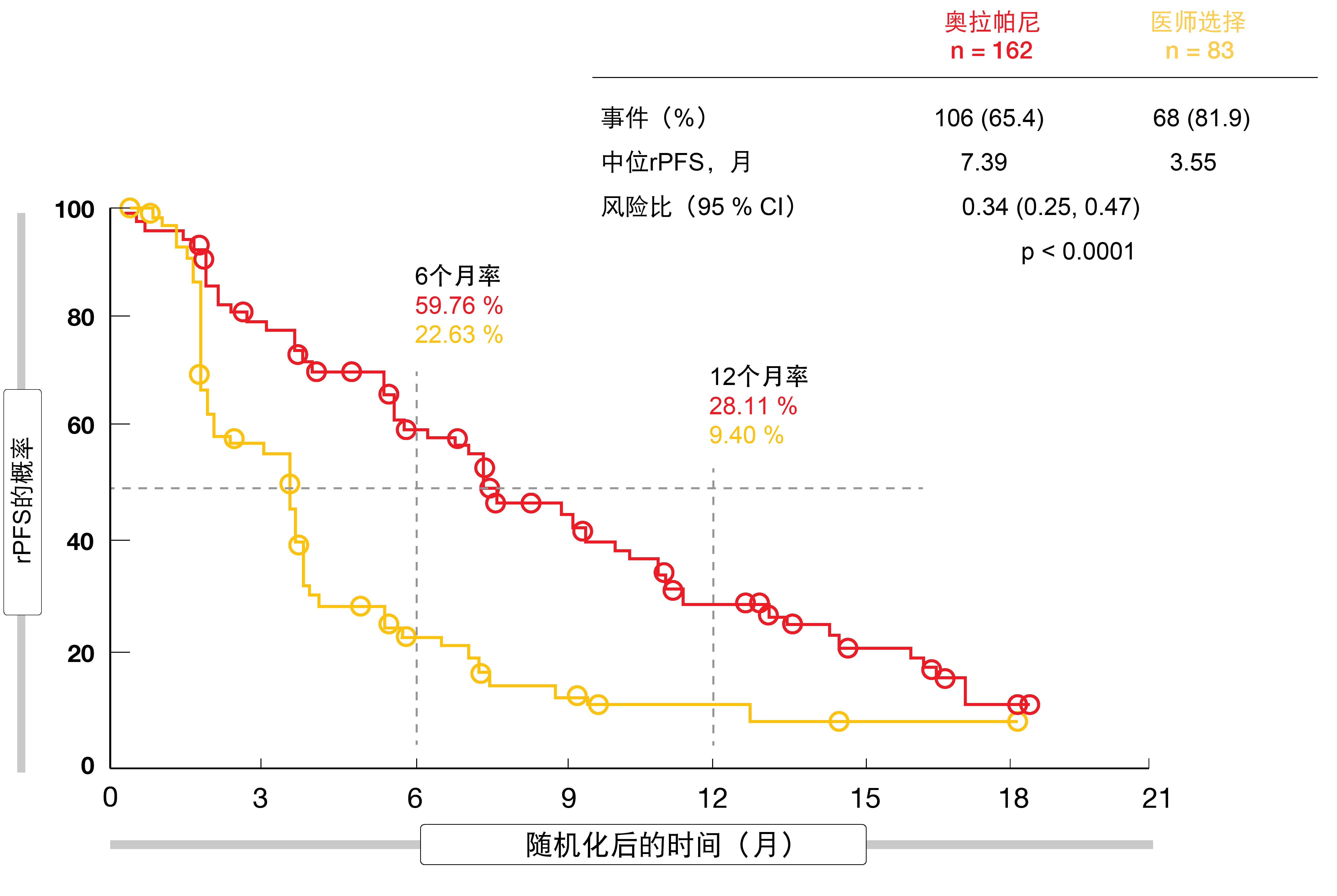
在恩杂鲁胺或阿比特龙后发生进展以及在HRR中起直接或间接作用的15种预定基因中的任一种具有改变的患者被纳入随机化开放标签的III期PROfound试验,该试验评估了奥拉帕尼与AR靶向治疗的比较。队列A包括245名具有BRCA1、BRCA2或ATM改变的患者,而队列B包括142名具有范围从BRIP1到RAD54L的12种其他HRR改变之一的患者。根据医师的选择,两个队列均以2:1的比例随机分配为奥拉帕尼或AR靶向治疗。在医师选择的治疗后发生进展的患者允许交叉到奥拉帕尼。主要终点是盲独立中央审查评估的队列A中的放射照相无进展生存期(rPFS)。
Hussain等人报告,在队列A中,与恩杂鲁胺或阿比特龙相比,奥拉帕尼确实提供了统计上显著的rPFS改善(7.39与3.55个月;HR,0.34;p < 0.0001;图1)[9]。在包括具有任何合格基因改变的两个队列的总人群中也观察到了这一点(5.82与3.52个月;HR,0.49;p < 0.0001)。在队列A中,具有可测量疾病的患者使用奥拉帕尼的客观缓解率(ORR)为33.3 %,而使用恩杂鲁胺或阿比特龙为2.3 %(优势比,20.86;p < 0.0001)。使用奥拉帕尼尚未达到中位至疼痛进展时间,而对于激素药物为9.92个月,代表56 %的降低(HR,0.44;p = 0.0192)。对于具有BRCA1、BRCA2或ATM改变的患者(18.5与15.11个月;HR,0.64;p = 0.0173)和总人群(17.51与14.26个月;HR,0.67;p = 0.0063),奥拉帕尼在总生存期(OS)方面显示出良好的趋势。这在超过80 %的交叉率的情况下仍得以实现。然而,OS数据仍不成熟。
奥拉帕尼耐受性良好。最常见的不良事件(AE)包括贫血(46.1 %与15.4 %)、恶心(41.4 %与19.2 %)、疲劳(41.0 %与32.3 %)和食欲减退(30.1 %与17.7 %)。作者得出结论认为,PROfound是在mCRPC男性患者中评价分子靶向治疗的首项实证性生物标志物选择的III期研究。此外,这些发现突出了在该人群中进行基因组测试的重要性。
图1: 在具有BRCA1、BRCA2或ATM改变的mCRPC患者中,奥拉帕尼相比于恩杂鲁胺或阿比特龙的放射照相无进展生存期
GALAHAD:关于尼拉帕尼的中期数据
正在进行的开放标签单组II期GALAHAD研究正在≥ 1条AR靶向治疗线和≥ 1条紫杉烷类化疗线后发生进展的具有mCRPC和DNA修复缺陷(DRD)的患者中评估尼拉帕尼的安全性和疗效。在2019年ESMO大会上,Smith等人介绍了预先指定的中期分析的结果[10]。总体上,筛查了223名患者的资格,并纳入了165名具有DRD(定义为BRCA1/2 [BRCA],ATM、FANCA、PALB2、CHEK2、BRIP1或HDAC2[非BRCA];单等位基因或双等位基因的致病突变)的患者。
研究发现表明,尼拉帕尼在mCRPC患者中具有较高的临床活性,尤其是在具有双等位基因BRCA DRD的患者中(n = 46)。该组显示ORR为41 %,客观缓解持续5.6个月。综合缓解率总计为63 %,其定义为RECIST 1.1的ORR,或者循环肿瘤细胞从≥ 5/7.5 mL血液向< 5/7.5 mL血液的转化,或者≥ 50 %的PSA下降。具有可测量疾病的患者显示综合缓解率为66 %;对于具有不可测量疾病的患者,这一比例为59 %。中位rPFS和OS分别为8.2和12.6个月。另一方面,具有非BRCA双等位基因DRD的患者(n = 35)仅有9 %发生缓解,综合缓解率为17 %。该组的中位rPFS和OS分别为5.3个月和14.0个月。分别有50 %和3 %的具有BRCA和非BRCA双等位基因DRD的患者发生≥ 50 %的PSA水平下降。
总体而言,尼拉帕尼治疗显示出可控的安全性特征,且未鉴定出新的安全性信号。最常见的3/4级AE包括贫血(29 %)、血小板减少症(15 %)和中性粒细胞减少症(7 %)。包括GALAHAD、MAGNITUDE和QUEST在内的正在进行的试验将继续在mCRPC和DRD患者中评价尼拉帕尼。
TRITON2中芦卡帕尼有前途的活性
TRITON2是在mCRPC条件下测试PARP抑制剂的另一项正在进行的II期试验。其中,在AR靶向治疗和化疗后发生进展的具有mCRPC和DDR改变(包括BRCA1/2、ATM、CDK12和CHEK2)的患者接受芦卡帕尼治疗。根据在2018年ESMO大会上介绍的分析,具有有害BRCA1/2改变的患者分别有44.0 %和51.1 %显示确认的ORR和PSA应答[11]。在2019年ESMO大会上,Abida等人介绍了在对总计190名患者进行13.1个月的中位随访后TRITON2的更新结果[12]。
与先前的报道一致,芦卡帕尼显示出有前途的疗效。在可评价的具有BRCA1/2改变的患者中,43.9 %经历了证实的研究人员评估的放射照相缓解。所有具有BRCA1/2突变的男性中有52 %具有确认的PSA缓解(即降低≥ 50 %)。具有种系和体细胞BRCA1/2改变的患者的缓解程度相似。此外,具有包括ATM、CDK12和CHEK2在内的其他DDR基因改变的组中也发生了确认的放射照相和PSA缓解(表1)。在显示确认的放射照相缓解的具有BRCA1/2改变的患者中,大多数(60.0 %)缓解超过24周。
芦卡帕尼的安全性特征与TRITON2的先前报道以及卵巢癌和其他实体瘤患者中所获得的经验一致[7, 13-15]。贫血是最常见的≥ 3级治疗突发性AE,发生率为17.9%。除了正在进行招募的TRITON2外,随机化III期TRITON3研究也正在一种先前AR靶向治疗后发生进展的具有BRCA1、BRCA2或ATM有害改变的化疗初治mCRPC患者中评价芦卡帕尼与二线AR定向治疗或多西他赛的比较。其中,rPFS已被定义为主要目标。
胰腺癌:POLO试验的分析
POLO是评价转移性胰腺癌中使用PARP抑制剂作为维持治疗的首项III期试验。在这项随机化国际研究中,在一线铂类化疗后≥ 16周期间疾病未发生进展的具有种系BRCA1和/或BRCA2突变的胰腺癌患者接受奥拉帕尼或安慰剂。事实上,与安慰剂相比,奥拉帕尼治疗导致统计上显著和临床上有意义的PFS获益(7.4与3.8个月;HR,0.53;p = 0.004)[16]。在2019年ESMO大会上,介绍了研究预先指定的次要疗效分析结果以及健康相关的生活质量数据。
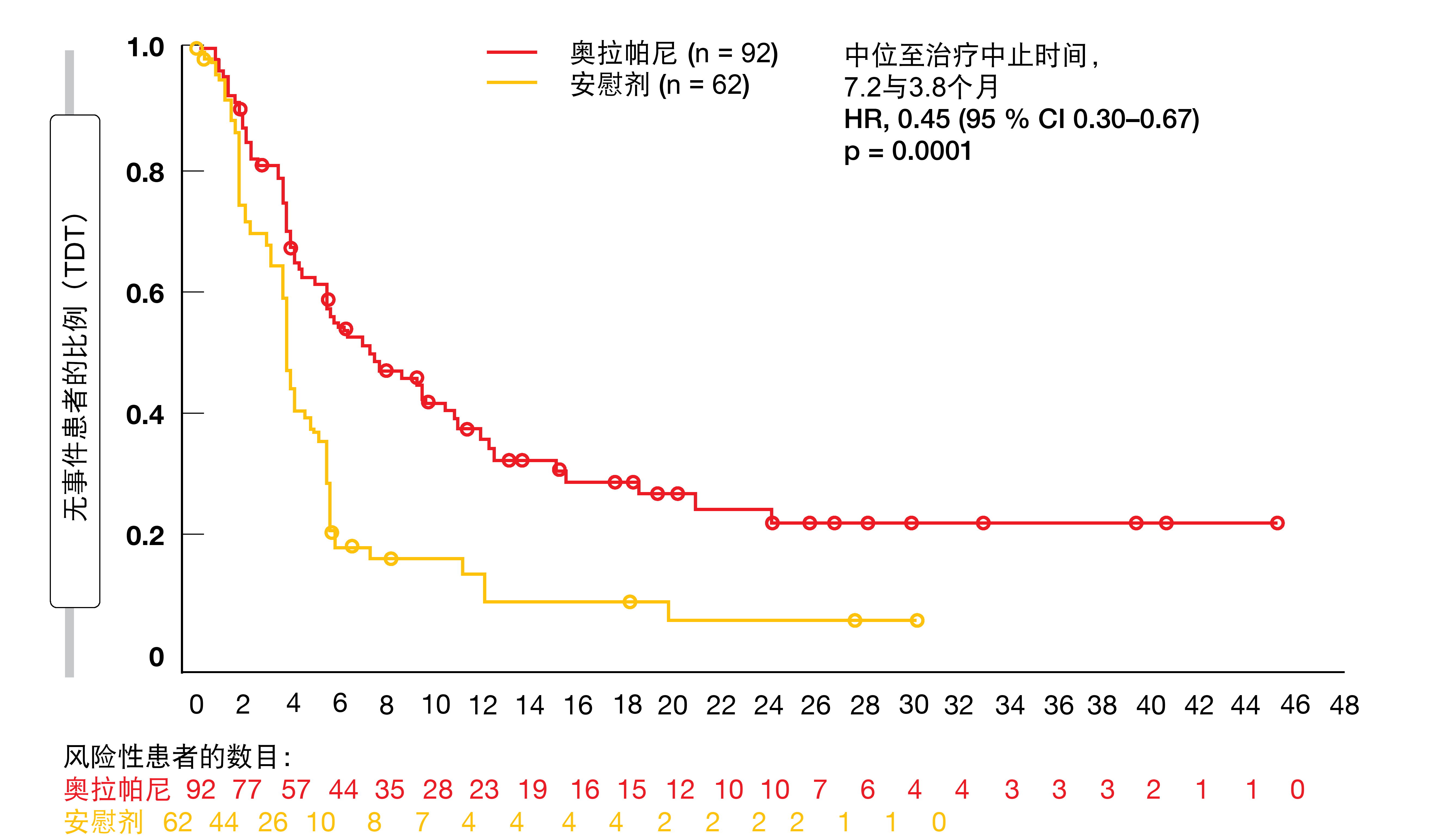
至治疗中止和后续治疗的时间
POLO试验的次要终点包括至治疗中止时间以及至首次和第二次后续治疗的时间。由于使用奥拉帕尼的维持治疗提供了PFS获益,因此与安慰剂组相比,实验组的患者需要后续治疗的可能性较小。Van Cutsem等人证实,与安慰剂相比,奥拉帕尼维持治疗导致至治疗中止时间明显延长,这转化为55 %的风险降低(7.2与3.8个月;HR,0.45;p = 0.0001)(图2)[17]。此外,至开始首次后续治疗(8.6与5.7个月;HR,0.50;p = 0.0013)和第二次后续治疗(13.2与9.2个月;HR,0.68;p = 0.083)的时间明显增加。
在接受了后续治疗的患者中,两组中大部分接受细胞毒性化疗的治疗。因此,奥拉帕尼维持治疗可以有意义地延迟转移性胰腺癌的二线治疗的需要,并且数据表明,这种延迟作用可以维持到三线。作者得出结论认为,在一线铂类治疗后维持奥拉帕尼治疗可能提供机会,延迟后续使用具有相关毒性的标准细胞毒性化疗。
图2: 与安慰剂相比,奥拉帕尼维持治疗更优越的至治疗中止时间
健康相关的生活质量
除了疗效获益之外,保持患者健康相关的生活质量(HRQoL)也是维持治疗条件下的主要治疗目标。POLO研究预先指定的次要目标是维持性奥拉帕尼对HRQoL的作用,特别是使用EORTC QLQ-C30问卷评价调整后的总体健康状态距基线的平均变化[18]。对奥拉帕尼组的92名患者中的89名和安慰剂组的62名患者中的58名进行了分析,这些患者具有可评价的基线形式(总体依从性分别为96.6 %和94.8 %)。
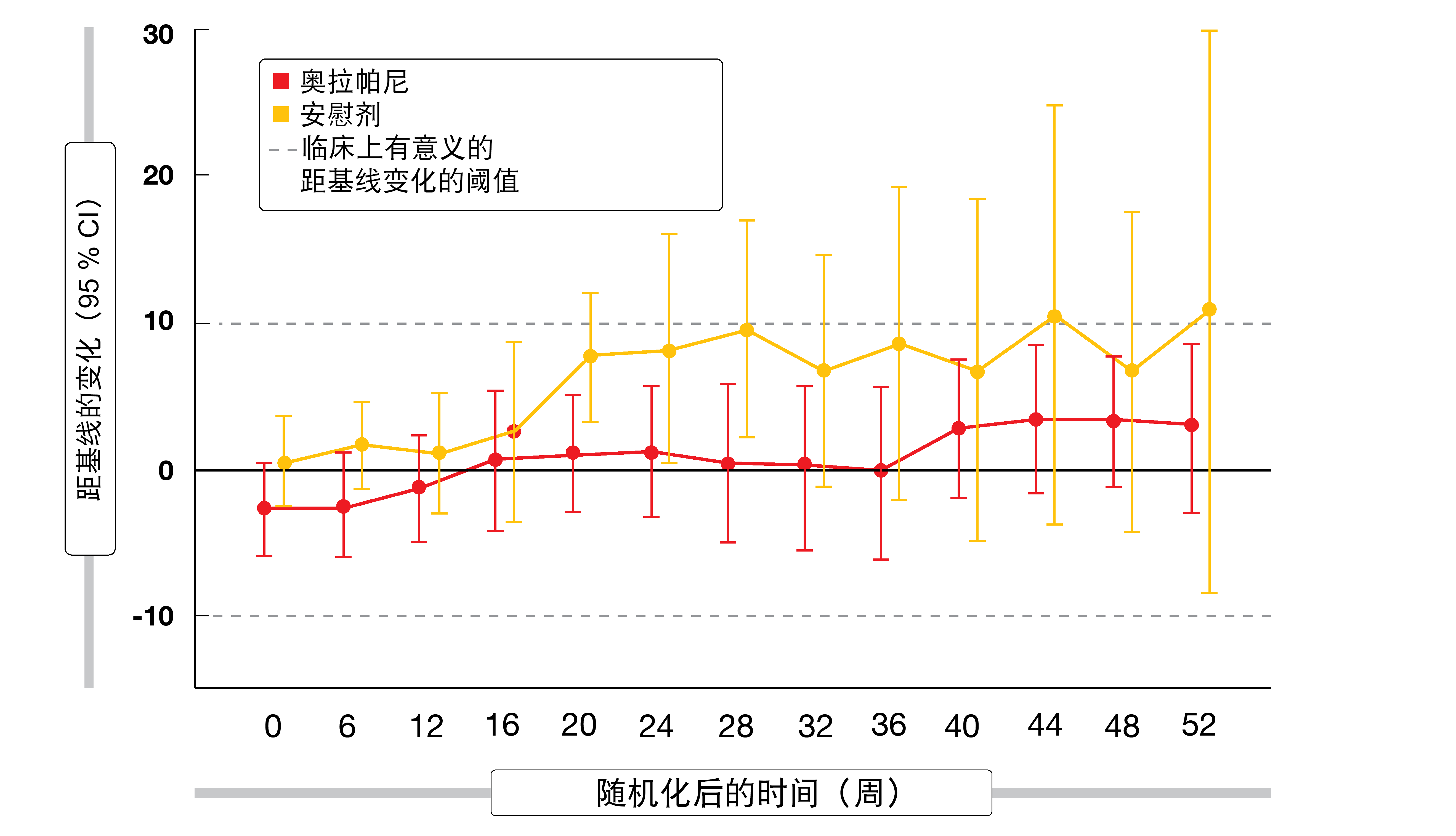
在成功进行一线化疗后,POLO研究中在两组接受治疗的患者均获得较高的基线总体健康状态评分(70.4与74.3)和身体功能评分(83.3与84.9)。随着时间的推移,两个治疗组的总体健康状态均保持相对稳定,总体组间调整后的距基线平均变化没有统计上显著或临床上有意义的差异。对于身体功能,两组的评分均随着时间的推移而增加(图3),尽管两组之间调整后的距基线平均变化未达到认为具有临床意义的阈值。对于整体HRQoL,奥拉帕尼与安慰剂的至持续临床上有意义的恶化的时间没有差异(21.2与6.0个月;HR,0.72;p = 0.25)。总体而言,奥拉帕尼维持治疗显示保持了一线化疗所获得的HRQoL获益。
图3: POLO试验两组中身体功能随时间的改善
新型PARP抑制
晚期实体瘤中的pamiparib单药疗法
Pamiparib是一种有效的选择性口服PARP1/2抑制剂,在Ia期研究中已证明在卵巢癌中有前途的抗肿瘤活性[19]。在剂量递增部分,将推荐的单药II期剂量定义为每天两次60 mg。研究的剂量扩增部分在患有卵巢癌、乳腺癌、前列腺癌、胃癌和小细胞肺癌的患者中进行。Voskoboynik等人报告了来自该研究的更新安全性数据,以及来自卵巢癌和相关联肿瘤队列的更新疗效数据[20]。
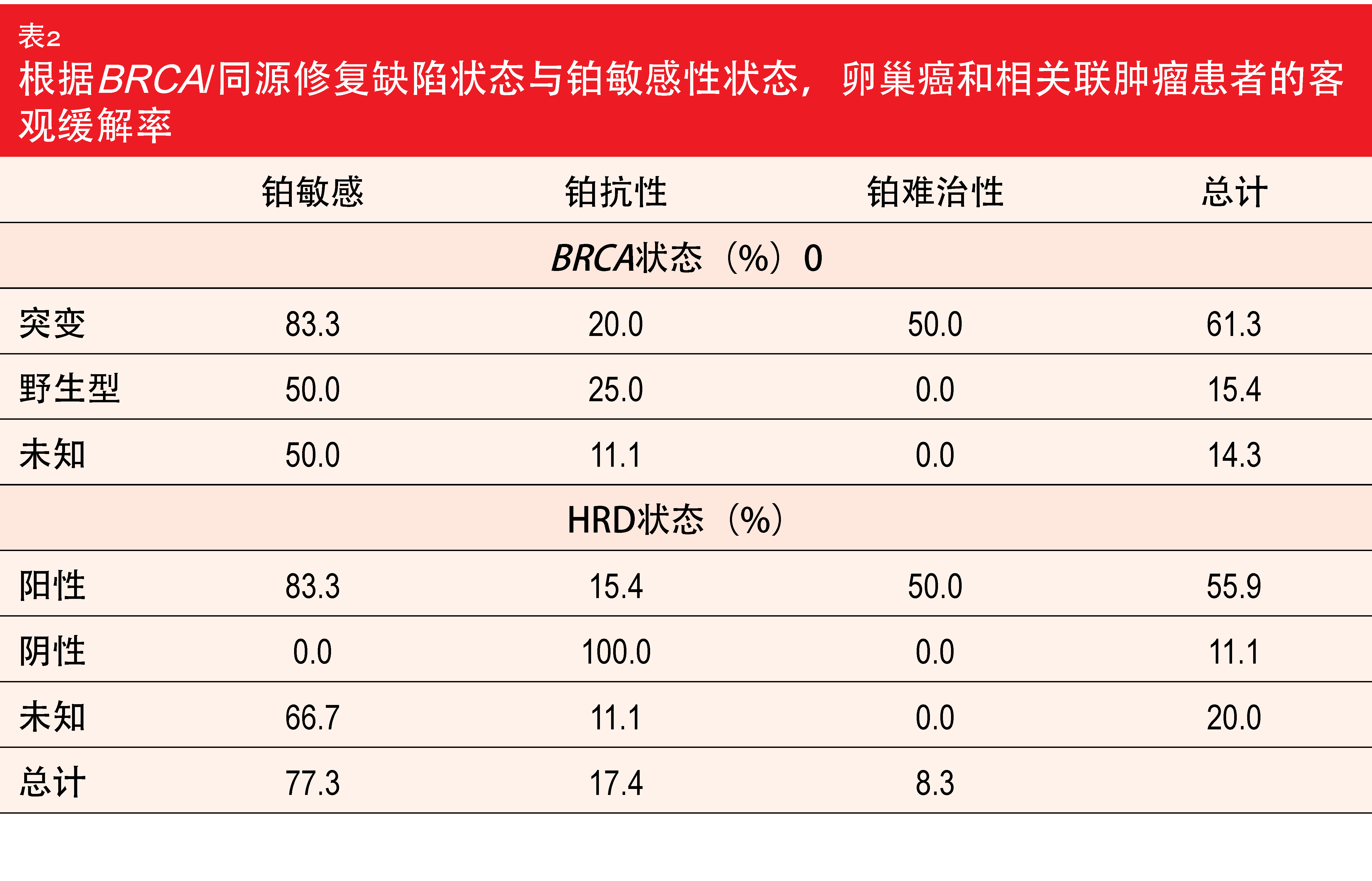
截至2019年6月,共有101名患者参加了剂量递增(n = 64)和剂量扩增(n = 37)队列。其中63名患者患有卵巢癌、输卵管癌或腹膜癌,28名以推荐的II期剂量接受了pamiparib。在58名具有可评价的卵巢癌和相关联癌症的患者中,23名(39.7 %)观察到确认的完全缓解或部分缓解。中位缓解时间为14.9个月。在这58名可评价的患者中,31名具有种系或体细胞BRCA突变,27名具有种系或体细胞BRCA野生型或者未知的BRCA状态。与其他队列相比,pamiparib治疗在突变组中引起更高的ORR(61.3 %与14.8 %)。对于按照铂敏感性状态得到的ORR,铂敏感、铂抗性和铂难治性群体分别为77.3 %、17.4 %和8.3 %。在铂敏感群组中,BRCA突变患者中达到的ORR高于具有BRCA野生型或未知状态的群组(83.3 %与50.0 %;表2)。
在安全性人群(n = 101)中,在10 %或更多的患者中观察到治疗突发性不良事件,包括恶心、疲劳、贫血、腹泻、呕吐和食欲减退。最常见的≥ 3级治疗突发性AE是贫血。Pamiparib血浆暴露随剂量增加呈线性增加,中位终末半衰期约为13小时。因此,pamiparib可以不随食物摄取而单独给予。作者得出结论认为,在卵巢癌和相关联癌症患者中,pamiparib继续具有广泛的良好耐受性,并显示出有前途的抗肿瘤活性。
联合替莫唑胺(temozolomide)
一项剂量递增/扩增研究正在局部晚期和转移性肿瘤患者中评估pamiparib联合口服低剂量替莫唑胺。该组合的基本原理是基于低剂量替莫唑胺引起的DNA损伤与PARP抑制协同作用的假设。这种协同作用可能通过增强的PARP依赖性肿瘤细胞杀伤而导致抗肿瘤活性增加。PARP抑制致使高度细胞毒性的加合物积累,从而导致细胞死亡。
在剂量递增期间,患者在每个28天周期接受每天两次60 mg pamiparib,加上在第1-7天每天递增剂量的替莫唑胺(组A;脉冲)或连续的替莫唑胺(组B;连续平坦)。根据初步分析,每天两次60 mg pamiparib联合脉冲或连续平坦剂量的替莫唑胺显示出抗肿瘤活性,并且通常耐受性良好,具有预期的骨髓抑制毒性[21]。
Stradella等人介绍了该Ib期研究的更新结果,包括有关推荐的II期剂量和组合方案的数据,确定为在第1-28天每天两次60 mg pamiparib,并在第1-7天每天60 mg脉冲替莫唑胺[22]。共招募了113名实体瘤患者,其中剂量递增和剂量扩增队列分别包括66名和47名患者。
高达80 %SCLC患者中的疾病控制
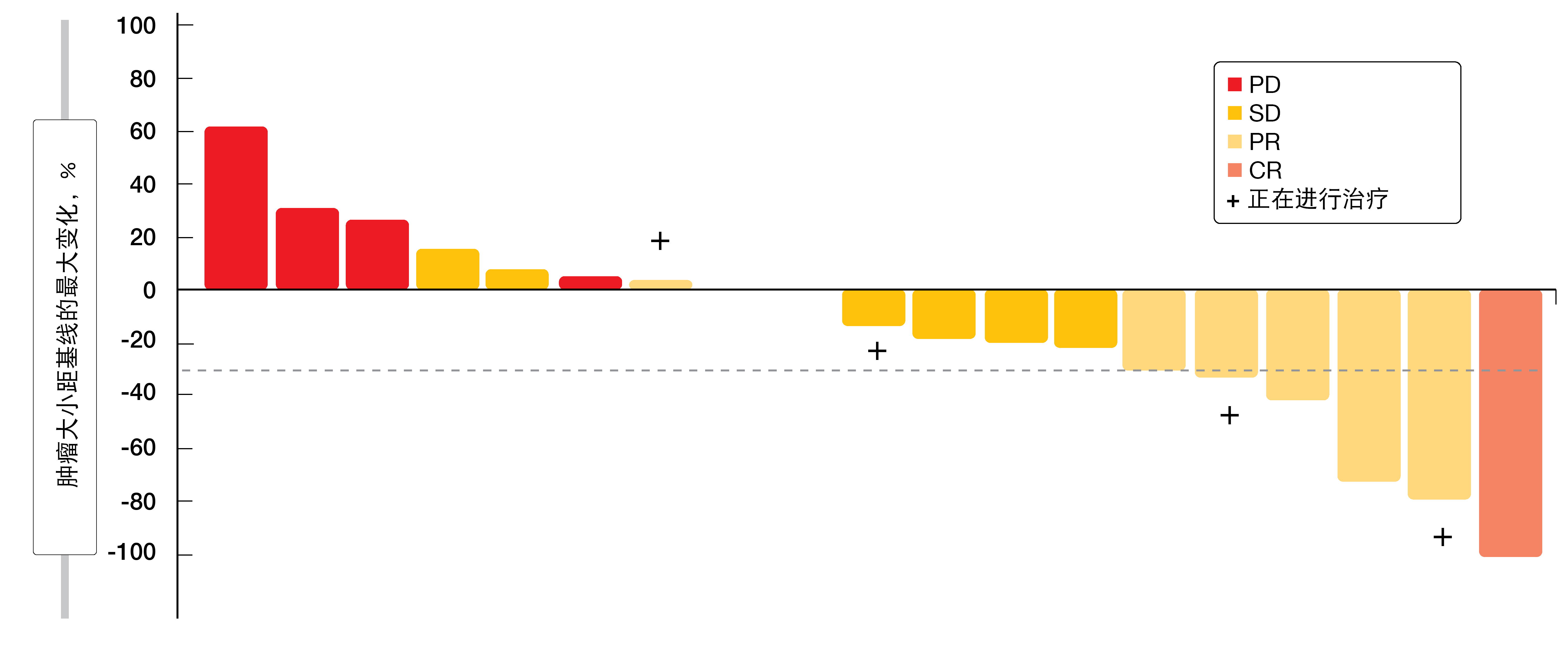
在扩增阶段招募的广泛期小细胞肺癌患者(n = 22)中发现有前途的初步疗效。在该群组中,在19名可评价缓解的患者中,31.6 %显示出对治疗的缓解,疾病控制率为78.9 %(图4)。20名胃癌/胃食管交界处癌症患者也在扩增阶段被纳入,其中15名可评估缓解。该队列中有33.3 %的患者实现了疾病控制。
剂量递增阶段招募所有参与者,66名患者中有57名可评估缓解(其中52名具有可测量的疾病)。该组的ORR和疾病控制率分别为19.3 %和64.9 %。缓解持续的中位时间为6.4个月。
剂量递增阶段纳入了8名具有同源重组缺陷(HRD)肿瘤的患者。他们显示62.5 %的缓解率,与BRCA突变状态无关。根据作者的结论,对于对pamiparib加低剂量替莫唑胺治疗的敏感性,HRD状态可能是有前途的生物标志物,而与肿瘤类型无关。组合显示可控的安全性特征,其中血细胞减少症代表最常见的≥ 3级事件。
图4: 在可评价的广泛期小细胞肺癌患者中,使用pamiparib加替莫唑胺获得的最大肿瘤减小
晚期实体瘤患者中的氟唑帕利(fluzoparib)
氟唑帕利(SHR3162)是一种选择性口服PARP1抑制剂,在细胞系和异种移植模型中均显示出抗肿瘤活性[23]。Li等人介绍了在晚期实体瘤患者中研究氟唑帕利的首个人体I期临床试验[24]。在中国的五个中心,分别向剂量递增和剂量扩增组招募48名和31名患者。卵巢癌代表最大比例的肿瘤类型(59.5 %),其次是乳腺癌(20.3 %)、结直肠癌(10.1 %)和其他类型的癌症(10.1 %)。在剂量递增阶段,氟唑帕利以10 mg/天至400 mg/天的11种剂量水平每天给予一次或两次。剂量扩增阶段在卵巢癌患者中评价每天两次80 mg、100 mg或150 mg的氟唑帕利。在两名接受400 mg/天的患者中报告了剂量限制性毒性。最大耐受剂量为每天两次150 mg,该剂量确定为推荐的II期剂量。
在该研究期间,所有患者均经历了AE。所有等级的血液学AE包括贫血(53.2 %)、血小板减少症(17.7 %)和中性粒细胞计数下降(24.1 %)。主要的非血液学AE包括疲劳(48.1 %)、呕吐(17.7 %)、恶心(34.2 %)和食欲减退(29.1 %)。约42 %的患者经历3/4级AE,最常见的是贫血(8.9 %)和中性粒细胞计数下降(5.1 %)。3名患者因AE而中止治疗。未发生治疗相关的死亡。t
使用氟唑帕利观察到的ORR对于卵巢癌为8.1 %,而对于乳腺癌为7.7 %。在结直肠癌和胃癌或其他肿瘤类型中未发生缓解。对于11名具有BRCA突变的卵巢癌患者,中位PFS为8.5个月。在接受≥ 120 mg/天氟唑帕利治疗的患者中,铂敏感队列的中位PFS为10.2个月。作者在结论中指出,在晚期实体恶性肿瘤中,每天两次150 mg剂量的氟唑帕利耐受性良好。这种选择性PARP1抑制剂在乳腺癌和卵巢癌中,特别是在BRCA突变和铂敏感性卵巢癌中表现出单药抗肿瘤活性。
参考文献
- Rathkopf DE et al., Safety and antitumor activity of apalutamide (ARN-509) in metastatic castration-resistant prostate cancer with and without prior abiraterone acetate and prednisone. Clin Cancer Res 2017; 23(14): 3544-3551
- Robinson D et al., Integrative clinical genomics of advanced prostate cancer. Cell 2015; 161(5): 1215-1228
- Pritchard CC et al., Inherited DNA-repair gene mutations in men with metastatic prostate cancer. N Engl J Med 2016; 375: 443-453
- Abida W et al. Prospective genomic profiling of prostate cancer across disease states reveals germline and somatic alterations that may affect clinical decision making. JCO Precis Oncol 2017. doi: 10.1200/PO.17.00029
- Mateo J et al., DNA-repair defects and olaparib in metastatic prostate cancer. N Engl J Med 2015; 373(18): 1697-1708
- Smith MR et al., Phase II study of niraparib in patients with metastatic castration-resistant prostate cancer (mCRPC) and biallelic DNA-repair gene defects (DRD): Preliminary results of GALAHAD. J Clin Oncol 37, 2019 (suppl 7S; abstr 202)
- Abida W et al., Preliminary results from TRITON2: a phase 2 study of rucaparib in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) associated with homologous recombination repair (HRR) gene alterations. ESMO 2018, abstract 793PD
- Mateo J et al., TOPARP-B: A phase II randomized trial of the poly(ADP)-ribose polymerase (PARP) inhibitor olaparib for metastatic castration resistant prostate cancers (mCRPC) with DNA damage repair (DDR) alterations. J Clin Oncol 37, 2019 (suppl; abstr 5005)
- Hussain M et al., PROfound: Phase III study of olaparib versus enzalutamide or abiraterone for metastatic castration-resistant prostate cancer (mCRPC) with homologous recombination repair (HRR) gene alterations. ESMO 2019, abstract LBA12_PR
- Smith MR et al., Pre-specified interim analysis of GALAHAD: A phase 2 study of niraparib in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) and biallelic DNA-repair gene defects (DRD). ESMO 2019, abstract LBA50
- Abida et al., Preliminary results from TRITON2: a phase 2 study of rucaparib in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) associated with homologous recombination repair (HRR) gene alterations. ESMO 2018, abstract 793PD
- Abida W et al., Preliminary results of the TRITON2 study of rucaparib in patients with DNA damage repair (DDR)-deficient metastatic castration resistant prostate cancer (mCRPC): updates analyses. ESMO 2019, abstract 846PD
- Kristeleit R et al., A Phase I-II study of the oral PARP inhibitor rucaparib in patients with germline BRCA1/2-mutated ovarian carcinoma or other solid tumors. Clin Cancer Res 2017; 23(15): 4095-4106
- Swisher EM et al., Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 Part 1): an international, multicentre, open-label, phase 2 trial. Lancet Oncol 2017; 18(1): 75-87
- Coleman RL et al., Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017; 390(10106): 1949-1961
- Golan T et al., Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. N Engl J Med 2019; 381: 317-327
- Van Cutsem et al., POLO: Time to treatment discontinuation and subsequent therapies following maintenance olaparib for patients with a germline BRCA mutation and metastatic pancreatic cancer. ESMO 2019, abstract 693P
- Hammel P et al., Health-related quality of life in patients with a germline BRCA mutation and metastatic pancreatic cancer receiving maintenance olaparib. Ann Oncol 2019 Sep 28. pii: mdz406. doi: 10.1093/annonc/mdz406. [Epub ahead of print]
- Lickliter J et al., Dose escalation/expansion study to investigate the safety, pharmacokinetics, food effect, and antitumor activity of BGB-290 in patients with advanced solid tumors. ESMO 2017, abstract 368PD
- Voskoboynik M et al., Safety, antitumor activity, and pharmacokinetics of pamiparib (BGB-290), a PARP1/2 inhibitor, in patients with advanced solid tumors: Updated phase 1 dose-escalation/expansion results. ESMO 2019, abstract 452PD
- Johnson M et al., Preliminary results of pamiparib (BGB-290), a PARP1/2 inhibitor, in combination with temozolomide in patients with locally advanced or metastatic solid tumors. ESMO 2018, abstract 421P
- Stradella A et al., Updated results of the PARP1/2 inhibitor pamiparib in combination with low-dose temozolomide in patients with locally advanced or metastatic solid tumors. ESMO 2019, abstract 451PD
- Wang L et al., Pharmacologic characterization of fluzoparib, a novel poly(ADP-ribose) polymerase inhibitor undergoing clinical trials. Cancer Sci 2019; 110(3): 1064-1075
- Li H et al., Phase I dose-escalation and expansion study of the PARP inhibitor, fluzoparib (SHR3162), in patients with advanced solid tumors. ESMO 2019, abstract 345P
More posts
PARP抑制剂的新应用
PARP抑制剂的新应用 转移性去势抵抗性前列腺癌 在雄激素受体(AR)靶向治疗(即恩杂鲁胺(enzalutamide)或阿比特龙(abiraterone))和紫杉烷类化疗后
妇科癌症中的PARP抑制:最新见解
妇科癌症中的PARP抑制:最新见解 聚(ADP-核糖)聚合酶(PARP)抑制剂已被确定为治疗晚期卵巢癌(OC)的重要药物类别,而晚期卵巢癌是女性癌症死亡的主要原因。奥拉帕尼
微生物组在癌变和对检查点抑制的应答中的潜在作用
微生物组在癌变和对检查点抑制的应答中的潜在作用 细菌对于人体的健康和功能具有至关重要的作用,人体含有的细菌比人体细胞更多,比例为1.3:1 [1, 2]。人体内已鉴定出超过
胃癌和食管癌、肝细胞癌以及尿路上皮癌中的PD-1抑制
胃癌和食管癌、肝细胞癌以及尿路上皮癌中的PD-1抑制 胃癌和食管癌 胃和胃食管交界处(GEJ)发生的腺癌在全球最常见的恶性肿瘤中排名第五[1, 2],在男性和女性中均为癌症
序言
序言 亲爱的读者们, 借助“memo inOncology”,施普林格创建了一个能够全球访问的医学教育平台,向肿瘤学领域的医疗保健专业人士提供有价值的内容(www.memo


![GALAHAD:关于尼拉帕尼的中期数据 正在进行的开放标签单组II期GALAHAD研究正在≥ 1条AR靶向治疗线和≥ 1条紫杉烷类化疗线后发生进展的具有mCRPC和DNA修复缺陷(DRD)的患者中评估尼拉帕尼的安全性和疗效。在2019年ESMO大会上,Smith等人介绍了预先指定的中期分析的结果[10]。总体上,筛查了223名患者的资格,并纳入了165名具有DRD(定义为BRCA1/2 [BRCA],ATM、FANCA、PALB2、CHEK2、BRIP1或HDAC2[非BRCA];单等位基因或双等位基因的致病突变)的患者。 研究发现表明,尼拉帕尼在mCRPC患者中具有较高的临床活性,尤其是在具有双等位基因BRCA DRD的患者中(n = 46)。该组显示ORR为41 %,客观缓解持续5.6个月。综合缓解率总计为63 %,其定义为RECIST 1.1的ORR,或者循环肿瘤细胞从≥ 5/7.5 mL血液向< 5/7.5 mL血液的转化,或者≥ 50 %的PSA下降。具有可测量疾病的患者显示综合缓解率为66 %;对于具有不可测量疾病的患者,这一比例为59 %。中位rPFS和OS分别为8.2和12.6个月。另一方面,具有非BRCA双等位基因DRD的患者(n = 35)仅有9 %发生缓解,综合缓解率为17 %。该组的中位rPFS和OS分别为5.3个月和14.0个月。分别有50 %和3 %的具有BRCA和非BRCA双等位基因DRD的患者发生≥ 50 %的PSA水平下降。 总体而言,尼拉帕尼治疗显示出可控的安全性特征,且未鉴定出新的安全性信号。最常见的3/4级AE包括贫血(29 %)、血小板减少症(15 %)和中性粒细胞减少症(7 %)。包括GALAHAD、MAGNITUDE和QUEST在内的正在进行的试验将继续在mCRPC和DRD患者中评价尼拉帕尼。 TRITON2中芦卡帕尼有前途的活性 TRITON2是在mCRPC条件下测试PARP抑制剂的另一项正在进行的II期试验。其中,在AR靶向治疗和化疗后发生进展的具有mCRPC和DDR改变(包括BRCA1/2、ATM、CDK12和CHEK2)的患者接受芦卡帕尼治疗。根据在2018年ESMO大会上介绍的分析,具有有害BRCA1/2改变的患者分别有44.0 %和51.1 %显示确认的ORR和PSA应答[11]。在2019年ESMO大会上,Abida等人介绍了在对总计190名患者进行13.1个月的中位随访后TRITON2的更新结果[12]。 与先前的报道一致,芦卡帕尼显示出有前途的疗效。在可评价的具有BRCA1/2改变的患者中,43.9 %经历了证实的研究人员评估的放射照相缓解。所有具有BRCA1/2突变的男性中有52 %具有确认的PSA缓解(即降低≥ 50 %)。具有种系和体细胞BRCA1/2改变的患者的缓解程度相似。此外,具有包括ATM、CDK12和CHEK2在内的其他DDR基因改变的组中也发生了确认的放射照相和PSA缓解(表1)。在显示确认的放射照相缓解的具有BRCA1/2改变的患者中,大多数(60.0 %)缓解超过24周。 芦卡帕尼的安全性特征与TRITON2的先前报道以及卵巢癌和其他实体瘤患者中所获得的经验一致[7, 13-15]。贫血是最常见的≥ 3级治疗突发性AE,发生率为17.9%。除了正在进行招募的TRITON2外,随机化III期TRITON3研究也正在一种先前AR靶向治疗后发生进展的具有BRCA1、BRCA2或ATM有害改变的化疗初治mCRPC患者中评价芦卡帕尼与二线AR定向治疗或多西他赛的比较。其中,rPFS已被定义为主要目标。](https://memoinoncology.com/wp-content/uploads/2020/03/Graph-16-esmo-solid-tumours-ch.png)