免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン
OAKサブグループ解析
抗PD-1抗体と比較した抗PD-L1抗体の利点は、PD-1/PD-L2経路をそのまま残しながら、PD-1/PD-L1相互作用を阻害でき、その結果として末梢免疫恒常性を維持できることである。OAK試験は、進行したNSCLCにおける抗PDL1剤を評価する、最初のランダム化第III相試験であった。局所進行性または転移性のNSCLC患者に、アテゾリズマブ1200 mgを3週間ごとに、またはドセタキセルを投与した。試験に先立ち、患者は少なくとも1つのプラチナ系レジメンを含む1または2レジメンの治療を受けていた。患者は、PD-L1の状態に関係なく登録され、PD-L1発現の有無によって層別化された。OAK試験の主要評価項目は2つである。ITT集団でのOS、および腫瘍細胞または腫瘍浸潤免疫細胞で1%以上のPD-L1を発現した患者のOSであった。OSデータの解釈に関連するクロスオーバーは許されなかった。
1次解析の結果は2016年欧州癌治療学会議 (ESMO) で発表された。この時点で、OAK試験での主要評価項目は達成された[1]。ITT集団では、アテゾリズマブ治療によりドセタキセルと比較して、死亡率が相対的に27%低下した(OS中央値13.8カ月対9.6カ月、HR 0.73、p = 0.0003)。また、アテゾリズマブはPD-L1発現のすべてのレベルで生存率を改善し、PD-L1発現率が最も高い患者に最大の効果をもたらした。しかし、アテゾリズマブはPD-L1を発現していない腫瘍を有する患者の生存率も改善した。
アテゾリズマブ治療で幅広い有効性を示した臨床的に意義のあるいくつかのサブグループを対象に、アテゾリズマブの有効性を評価するため、サブグループ解析がOAK試験で実施された[2]。免疫組織化学 (IHC) または遺伝子発現によって評価したときにPD-L1発現レベルに関係なく、すべてのPD-L1発現レベルの組織型(扁平上皮癌と非扁平上皮癌)、 すべての年齢グループにおいて、OS改善が認められた。OSの改善は、非喫煙者およびベースライン時に脳転移を伴っていた患者でも認められた。他方、ドセタキセルはEGFR変異を有する患者のサブグループにおいて、アテゾリズマブより有効であり、野生型の患者はアテゾリズマブの方が良好であった。EGFR変異集団において、ドセタキセルに比しアテゾリズマブの有効性が改善されなかったが、これに関してはすでに他の経路内薬剤が着目されている[3]。
BIRCH:アテゾリズマブの有望な1次治療の有効性
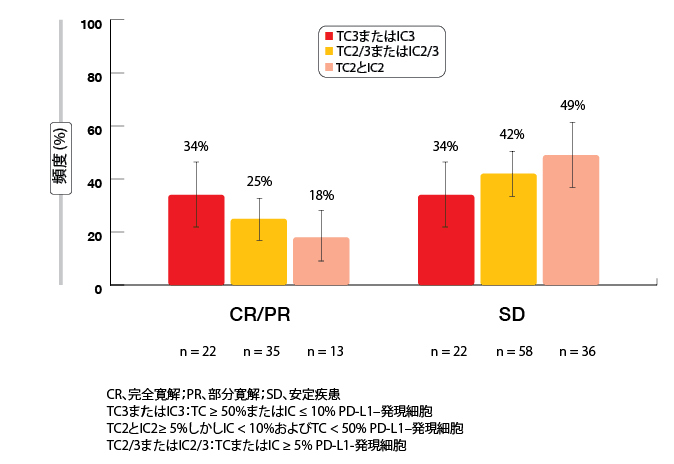
単一群第II相BIRCH試験において、 PD-L1陽性の局所進行または転移を有するNSCLC患者を対象に、アテゾリズマブ単独療法が評価された。試験は3群から成り、1次治療コホート、2次治療コホート、および3次治療/それ以降コホートとしてアテゾリズマブ3週間ごとに1200 mgを検討した。腫瘍細胞(TC2またはTC3)上および腫瘍浸潤免疫細胞(IC2またはIC3)上のPD-L1発現をICHIIより検討した。主要有効性評価項目である既存対照に対する相対ORRは既に達成されている。Garassinoらは、試験の1次治療部分の評価である探索的解析のデータを発表した[4]。コホートは患者138名からなっていた。この群の47%が最も高いPD-L1腫瘍の発現を示した(TC3またはIC3)。患者の53%がTC2およびIC2を有していた。
第1次治療でのアテゾリズマブは有望な単独療法の有効性を示した。集団全体では、客観的奏効率25%、安定奏功 (SD) 42%であった(図1参照)。TC3またはIC3コホートでは、ORR率およびSD率とも34%であった。TC2およびIC2コホートでは、ORR率およびSD率はそれぞれ18%および49%であった。奏功期間は集団全体で16.5カ月であり、TC2およびIC2コホートの奏功期間の中央値は12.3カ月であった。TC3またはIC3コホートではまだ確定していない。ORRへのアテゾリズマブの効果は、患者数が少ないが、EGFRおよびKRASの変異型および野生型の双方の患者にも認められた。これらの結果は、アテゾリズマブ単独療法が第1選択において、長期にわたる有効性を有することを示している。
集団全体のPFS中央値は7.3カ月であり、PD-L1発現のレベルが異なっても同様な結果であった。中央値22.5カ月の経過観察後、OS中央値は23.5カ月であった。OS中央値の評価はまだ不十分であったが、OSの傾向はPD-L1発現サブグループ間で同等であった。集団全体で1年時点で生存している患者の割合は66.4%であった。EGFRおよびKRAS変異状態はこれらの結果には影響しなかった。安全性プロフィルは他のアテゾリズマブNSCLC試験と同様であり、アテゾリズマブは忍容性が良好であった。IMpower110などの進行中の第III相試験では、アテゾリズマブはPD-L1陽性患者を対象とした第1選択薬として、化学療法と比較評価されている。
図1:尿および血漿検査の併用によるT790M検出における増加(170 T790M陽性の場合)
ATLANTIC試験におけるデュルバルマブの活性
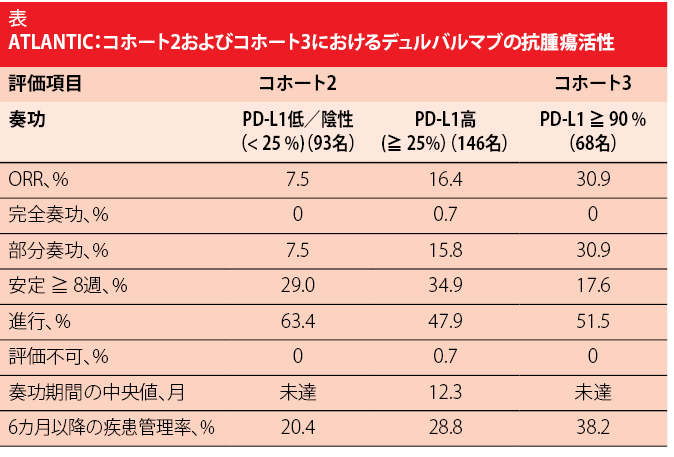
アテゾリズマブと同様に、デュルバルマブは抗PD-L1抗体に分類される。デュルバルマブは、非盲検、単一群、第II相ATLANTIC試験で、2週間に1回10 mg/kgの用量で、最大12カ月間試験された[5]。試験に参加した患者には、1つのプラチナ系化学療法を含む2つ以上の全身治療レジメン歴があった。当初、このプロトコルはすべての患者用に設計されたが、修正後は患者選択を高度にPD-L1を発現している腫瘍を有する患者に限定された。集団は3つのコホートから構成されている。コホート1(111名)は、EGFR変異/ALK異常および高いPD-L1発現(腫瘍細胞の25%以上)を有する患者であった。コホート2およびコホート3は、EGFR/ALK野生型を有する患者であった。コホート2(265名)では、PD-L1発現レベルが腫瘍細胞の25%以上であり、低/陰性PD-L1発現(25%未満)が支配的である。コホート3(68名)は、PD-L1発現レベルが90%以上の患者である。コホートは独立しており、コホート2およびコホート3は順次登録された。
この強力な全治療歴を有する転移性NSCLC集団では、デュルバルマブ治療は活性を示し、奏功期間を延長した。PD-L1の発現レベルが高いほど、奏効率が高いようであった。コホート2では、低/陰性および高PD-L1発現の患者のORRは、それぞれ7.5%と16.4%であった(表を参照)。コホート3では、ORRは30.9%に向上した。6カ月後以降の疾患管理率は、それぞれ20.4%、28.8%、 38.2%であった。奏功期間の中央値は、低/陰性PD-L1発現のコホート2患者およびコホート3患者についてはまだ50%に到達しておらず、高いPD-L1発現のコホート2患者では12.3カ月であった。ORRにおける優位はサブグループ全体で見られ、注目すべきことに、治療ラインおよびCNS転移の存在とは無関係であった。
コホート2において、低い/陰性PD-L1発現および高いPD-L1発現のグループのOS中央値は、それぞれ9.3カ月と10.9カ月であった。これらの結果は、それぞれ1年後のOS率34.5%と47.7%に対応する。コホート3については、OSはまだ50%に達しておらず、1年後に50.8%の患者が生存していた。多くのAEは低グレードに分類され、免疫介在性のAEは管理可能であることが証明された。著者らは、これらの結果が転移性NSCLCにおける他の抗PD-1/PD-L1療法で得られた結果と一致すると結論付けた。進行中の第III相試験では、デュルバルマブ単独またはCTLA-4抗体トレメリムマブとの併用の役割が明らかにされる。
4つのアプローチ:化学療法プラス免疫療法併合
デュルバルマブのCTLA-4抗体トレメリムマブとの併用が、4剤併用療法にフォーカスしたIND.226用量漸増試験で検討された。つまり、2つの免疫腫瘍学的薬剤との併用化学療法が評価された。この試験では、PD-L1阻害剤だけでなくCTLA-4阻害剤を追加することによって、化学療法+免疫療法の効果を増大させようとしている。IND.226試験には、固形腫瘍を有する患者が含まれ、複数の化学療法勢力が使用される。全コホートの27名の患者が非扁平上皮NSCLCと診断されている。それらの患者はPD-L1陰性である。ペメトレキセドおよびシスプラチンと供に、デュルバルマブ15 mg/kg 3週間、およびトレメリムマブ1 mg/kg(複数回投与、6週間)または3 mg/kg(3回投与、6週間)が投与された。
この試験の主要評価項目である安全性については、化学療法ならびにCTLA-4およびPD-L1抗体を用いたチェックポイント阻害剤から予想される以上の顕著な追加の毒性は認められなかった[6]。これは第I相の安全性試験であるので、すべての患者が測定可能な疾患を有する必要はなかった。現在までに、26例中16例 (61.5%) が部分奏功を示している。安定した疾患が7例で認められた。これらの患者の多くは治療中である。
全体的に見て、デュルバルマブとトレメリムマブは、ペメトレキセド/シスプラチン化学療法の全用量と安全に組み合わせることができる。今後、PD-L1サブセット解析が実施される予定である。第II相ランダム化経過観察試験では、プラチナ系ベースをベースとした2剤併用化学療法+デュルバルマブ/トレメリムマブがデュルバルマブ/トレメリムマブ単独療法を第1選択として比較評価される。
JAVELIN:広範囲の固形腫瘍におけるアベルマブ
アベルマブはもう1つの抗PD-L1抗体であり、国際共同、第I相、マルチコホート、用量漸増および用量拡張JAVELIN固形腫瘍試験で試験される。試験では、胸部癌、ならびに皮膚、頭部、頸部、泌尿生殖路、および胃腸管の腫瘍を含むさまざまな悪性腫瘍を有する患者が登録された。1700名超の全コホートに対し、用量拡張期中にアベルマブ10 mg/kgを2週間ごと投与された。ステージIVコホートと再発性NSCLCコホートの2つが含まれており、患者はアベルマブを第1選択として(156名)または第2選択として(184名)投与された。
WCLCでは第1選択コホートにおけるアベルマブの安全性および臨床効果の結果が報告された[7]。第1選択コホートの患者は、PD-L1発現の有無によっては選択されず、活性化EGFR変異またはALK転座は有さなかった。PD-L1発現は、56.4%が陽性で、14.7%が陰性であった。アベルマブは良好な忍容性を示した。患者の10%が免疫関連の可能性のあるAEを呈したが、1名の患者のみがグレード3のAEを発現した。グレード3または4の肺炎は認められず、グレード1または2の肺炎が4名にのみみられた (2.6%)。
この初期の分析により、アベルマブ単独療法の長期にわたる抗腫瘍活性が明らかになった。完全奏功および部分奏功は22.5%であった。患者の43%が安定疾患を呈し、疾患管理率は65.4%まで増加した。大部分の患者に腫瘍縮小が認められた(図2参照)。データ打ち切り時には、奏功の68.6%が継続中であった。PFS中央値は17.6週で、24週のPFS率は37.2%であった。
追加の経過観察により、アベルマブ療法の臨床的効果がさらに特徴づけられるであろう。アベルマブの予測バイオマーカとしてPD-L1発現の解析が進行中である。現在、第III相試験において、未治療のPD-L1陽性NSCLC患者を対象に、アベルマブ単独療法とプラチナ剤ベースの併用化学療法の比較が行われている。
図2:アベルマブによる腫瘍縮小を描くJAVELIN試験のウォーターフォールプロット
CheckMate 012試験での長期アウトカム
CheckMate 012試験では、抗PD-1抗体ニボルマブ単独とニボルマブおよびCTLA-4免疫チェックポイント阻害剤イピリムマブ併用の2スケジュールとが比較された。これらの治療は、任意の組織型のステージIIIB/IVのNSCLC患者を対象に、第1選択治療として検討された。ニボルマブ単独群(52名)は、ニボルマブ3 mg/kgを2週ごとに投与された。2つの併用群では、ニボルマブとイピリムマブがそれぞれ3 mg/kgを2週間ごと、および1 mg/kgが投与された。一方の併用群にはイピリムマブを12週ごと(38名)、他方の併用群にはイピリムマブを6週ごと(39名)投与した。PD-L1の発現状態を評価した。各群の患者の約70%は、PD-L1発現が1%以上であった。CheckMate 012試験の主要評価項目は安全性と忍容性であった。Gettingerらは、WCLCにおいてCheckMate 012での長期アウトカムの結果を報告した[8]。
併用コホートでの6ヶ月の経過観察後、治療に関連するAEの率および安全プロファイルは以前に報告されている結果と同様であった。治療に関連する死亡はなかった。ニボルバブ単独療法および併用療法の双方が効果を示し、高いORR、PFS乃延長、極めて高い1年後OS率が示された。2年後のORRは、ニボルバブ単独では23%、ニボルバブとイピリムマブの併用では43%であった。PD-L1発現が高い場合、単独療法および併用療法の双方で高い有効性が示された。PD-L1発現が50%医用の患者では、ORRはニボルマブ単独で50%、併用レジメンで92%であった。また、PD-L1発現がない (< 1%)患者でも治療の効果が得られたが、PFSおよびOSはPD-L1発現が50%以上のグループで最良であった。PD-L1発現が1%以上の患者のPFS中央値は、ニボルマブ単独療法で3.5カ月、ニボルバブとイピリムマブとの併用では、12週コホートで10.4カ月、6週コホートで13.2カ月であった。患者の1年後生存率は、それぞれ69%、91%、83%であった。
ニボルマブ3 mg/kg 2週ごと+イピリムマブ1 mg/kg 6週ごと併用投与は、さらなる試験で評価されている。それらの試験には第III相CheckMate 227試験が含まれている。CheckMate 227試験ではニボルマブ単独療法、化学療法、およびニボルマブと化学療法の併用レジメンを比較している。PD-L1発現レベルにより2つのグループ(1%以上と1%未満)が定義されたので、比較の種類はPD-L1発現レベルに依存する。
ペンブロリズマブと化学療法の併用:KEYNOTE-021 G
ステージIIIB/IV非扁平上皮NSCLCの第1選択治療として、抗PD1抗体ペンブロリズマブと化学療法の併用が、非盲検、ランダム化、第II相KEYNOTE-021 G試験で評価された。実験群には、カルボプラチンおよびペメトレキセドと供に、ペンブロリズマブ200 mgが3週ごとに2年間投与された。対照群の患者には、カルボプラチンおよびペメトレキセドが単独で4サイクルにわたり投与された。ペメトレキセドは維持療法として許可された。主要評価項目はORRであった。約60名が各群に割り当てられたが、進行が始まったときは対照群の20名はペンブロリズマブ群に交叉され、12名は交叉外で抗PD-1/PD-L1治療を受けた。
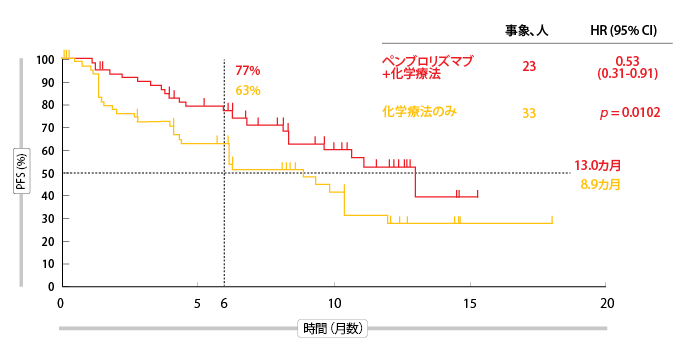
ORRはペンブロリズマブを追加することでほぼ2倍になることが確認された(55%対29%、p = 0.0016)[9]。PFS解析によると、併用療法により進行または死亡のリスクはほぼ半減し、PFS中央値は1年を超えた(13.0カ月対8.9カ月、HR 0.53、p = 0.0102、図3参照)。OSは両群で同等であった(両治療法とも6カ月で92%、1年では75%と72%)。ペンブロリズマブと化学療法の併用は、高い忍容性と管理可能な安全性プロファイルを示した。治験責任医師らが指摘したように、ペンブロリズマブとカルボプラチンおよびペメトレキセドの併用は、化学療法を受けていない進行性非扁平上皮NSCLC患者にとって有効な治療選択肢になりうる。
図3:化学療法へのペンブロリズマブの追加によるPFS効果
フランスでのPD-L1 IHC試験に関するハーモニゼーション試験
IHCにより評価されるPD-L1発現は、現在利用可能な抗PD-1/PD-L1抗体効果の予測バイオマーカである。Dako (22C3, 28-8) およびVentana (SP142、 SP263) プラットフォームで用いられるアッセイは臨床試験で診断検査として使用されている。フランスでは、アッセイのハーモナイゼーションおよび検査室で開発された検査の発展が、いくつかの理由により緊急に必要とされている。これまでのところフランスでは、DakoとVentanaのプラットフォームはすべての病理検査室で利用可能なわけではなく、評価は依然として高価であり、PD-L1検査の医療費償還は不十分である。同時に、PD-L1検査は、第1選択治療の患者に迅速に利用されなければならず、異なる評価法を用いた複数の試験は、小さなNSCLC検体では実現不可能である。IHCにより評価されるPD-L1発現は、現在利用可能な抗PD-1/PD-L1抗体効果の予測バイオマーカである。Dako (22C3, 28-8) およびVentana (SP142、 SP263) プラットフォームで用いられるアッセイは臨床試験で診断検査として使用されている。フランスでは、アッセイのハーモナイゼーションおよび検査室で開発された検査の発展が、いくつかの理由により緊急に必要とされている。これまでのところフランスでは、DakoとVentanaのプラットフォームはすべての病理検査室で利用可能なわけではなく、評価は依然として高価であり、PD-L1検査の医療費償還は不十分である。同時に、PD-L1検査は、第1選択治療の患者に迅速に利用されなければならず、異なる評価法を用いた複数の試験は、小さなNSCLC検体では実現不可能である。したがって、フランスでの多施設共同試験では、検査室で開発された試験が、一連のNSCLC症例において、PD-L1アッセイの分析性能に近い性能を達成できるかを検討する目的で、Dako 28-8および22C3、ならびにVentana SP263のPD-L1アッセイをさまざまな施設で評価した[10]。28-8、22C3、およびSP263アッセイはいくつかの施設でよく一致することが確認された。Dako、Ventana、およびLeicaプラットフォーム上で7つの施設で開発された27の検査室開発の検査のうち、14 (51.8%) の検査は腫瘍細胞染色の参照アッセイと一致した。1%、5%、および10%の閾値を用いて4つのカテゴリースケールを用いたとき、免疫細胞染色の一致度が低かった。クローンSP263は、すべてのプラットフォームで最高の一致度を示した。この試験では、検査室開発の試験の検証およびさらなる使用には注意が必要であることを強調している。選択された検査室開発の試験は、フランスでより大きなコホートで検証され、外部の品質評価プログラムで評価される。これらの結果は、NSCLCにおけるPD-L1検査について、国レベルの推奨の基礎となる。
参考文献
- Barlesi F et al., Primary analysis from OAK, a randomized phase III study comparing atezolizumab with docetaxel in 2L/3L NSCLC.ESMO 2016, abstract LBA44_PR
- Gadgeel SM et al., OAK, a randomized ph III study of atezolizumab vs docetaxel in patients with advanced NSCLC: results from subgroup analyses.WCLC 2016, PL04a.02
- Borghaei H & Brahmer J, Nivolumab in nonsquamous non-small-cell lung cancer.N Engl J Med 2016; 374(5): 493-494
- Garassino MC et al., Atezolizumab as 1L therapy for advanced NSCLC in PD-L1–selected patients: updated ORR, PFS and OS data from the BIRCH study.WCLC 2016, OA03.02
- Garassino MC et al., Durvalumab in ≥3rd-line locally advanced or metastatic, EGFR/ALK wild-type NSCLC: results from the phase 2 ATLANTIC study.WCLC 2016, PL04a.03
- Juergens RA et al., Pemetrexed/cisplatin + durvalumab ± tremelimumab in patients with advanced non-squamous NSCLC: A CCTG phase Ib study – IND.226 Cohort 1.WCLC 2016, MA09.03
- Verschraegen C et al., JAVELIN Solid Tumor: safety and clinical activity of avelumab (anti-PD-L1) as first-line treatment in patients with advanced NSCLC.WCLC 2016, OA03.03
- Gettinger SN et al., First-line nivolumab monotherapy and nivolumab plus ipilimumab in patients with advanced NSCLC: long-term outcomes from CheckMate 012.WCLC 2016, OA03.01
- Langer CJ et al., Pembrolizumab + carboplatin and pemetrexed as 1st-line therapy for advanced non-small cell lung cancer: KEYNOTE-021 Cohort G. WCLC 2016, MA09.02
- Adam J et al., Multicentric French harmonization study of PD-L1 IHC testing in non-small cell lung cancer.WCLC 2016, PL04a.04
More posts
診療を変える肺癌ステージ分類の変更
診療を変える肺癌ステージ分類の変更 TNM分類が最近第8版に改定された。2009年に発刊された第7版[1]と比較して、予後と研究の改善を目的として、肺癌のステージ分類にいく
ニンテダニブによる抗血管新生:中皮腫における活性、バイオマーカの候補
ニンテダニブによる抗血管新生:中皮腫における活性、バイオマーカの候補 LUME-Meso 悪性胸膜中皮腫は、一般に進行期に診断されることが多いため、患者の予後が不良である。
インタビュー:「免疫療法の対象者は誰か?」
免疫療法の対象者は誰か Johan Vansteenkiste, MD, PhD, Respiratory Oncology Unit/Pulmonology, Unive
免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン
免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン OAKサブグループ解析 抗PD-1抗体と比較した抗PD-L1抗体の利点は、PD-1/PD-L2経路をそのまま残し
EGFRおよび他の変異における液体生検
EGFRおよび他の変異における液体生検 組織生検および再生検と比較して、液体生検では最少の侵襲性、腫瘍奏功をモニタリングするための経時的に連続測定が可能、X線検査に先立って
ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題
ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題 ALK融合遺伝子陽性NSCLC患者における標準的な第1選択肢として、ALKチロシンキナーゼ阻害薬 (TK