抗 EGFR 治疗领域显著进展
不可逆 ErbB 家族阻断剂阿法替尼 (afatinib)以及可逆 EGFR TKI 吉非替尼( gefitinib )和埃洛替 尼 (erlotinib)已获批准作为一线疗法, 用于治疗具有 EGFR 敏化突变的非小细胞肺癌 (NSCLC)患者。然而,耐药性频发表明需要新的药物。EGFR T790M 突变已被确定为最常见的耐药突变。
第三代口服不可逆 EGFR TKI 奥斯替尼( o s im e r t in ib )在敏化及EGFR T790M 耐药突变中均具有活性 。该治疗在 AURA3 中进行了评估。AURA3 是首个在一线 EGFR TKI 疗法发生进展的 T 7 9 0 M 阳性晚期NSCLC 患者中比较 T790M 选择性EGFR TKI 与铂基双药化疗的随机化 III 期试验[1]。在实验组中,每日一次 (OD)每次 80 mg 施用奥斯替尼(n = 279),而对照组中的患者则接受培美曲塞( p em et r ex ed )加卡铂 (carboplatin)或顺铂(cisplatin), 然后可选使用培美曲塞进行维持(n = 140)。 允许存在稳定无症状中枢神 经系统(CNS)转移。
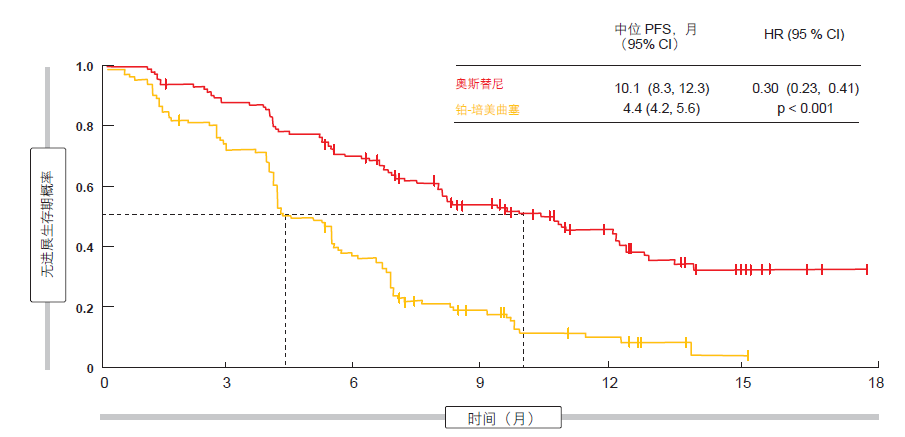
AURA3:奥斯替尼带来 70 % 的风险降低
与铂-培美曲塞治疗相比,奥斯替尼显示出有统计优势和临床意义的活性。奥斯替尼在研究者评估 PFS 这一主要终点方面显著占优(10.1 个月与 4.4 个月;HR,0.30;p < 0.001;图 1)。无进展生存期(PFS)获益出现在所有亚组。相比于没有脑部病灶的患者(10.8 个月与 5.6 个月;HR,0.40),在基线时有 CNS 转移的患者体验到相似的进展或死亡风险降低(PFS,8.5 个月与 4.2 个月;HR,0.32)。使用奥斯替尼的客观反应率(ORR)明显较高(71 %与 31 %;p < 0.001), 中位反应持续时间更长(9.7 个月与 4.1 个月)。此外,奥斯替尼的耐受性优于化疗,可能的治疗相关≥3 级不良事件( AE)发生频率较低( 6 % 与34 %)。研究人员因此指出,奥斯替尼代表了用于使用一线 EGFR TKI 治疗发生疾病进展后的 EGFR T790M 阳性 NSCLC 患者的护理新标准。
图 1:AURA3 中根据研究者评估的 PFS:奥斯替尼具有超越化疗的显著优势
根据 AURA3 的另一项分析,该试验中采用奥斯替尼获得的临床获益与是通过组织测试还是针对循环肿瘤DNA(ctDNA)确定 T790M 阳性无关[2]。使用 cobas® EGFR 突变测试版本 2 作为参考,血浆中 T790M 检测的敏感性和特异性比率分别为 51 %和 77 %。分析显示出对外显子 19 缺失和 L858R 突变的高敏感性和特异性。根据肿瘤组织和 ctDNA 测试,T790M 阳性患者的 PFS 和 ORR 相似。这是一个可喜的发现,因为在疾病进展时进行重新活检并非总是可行,并且可能与风险和治疗延迟相关。
LUX-Lung 7:采用阿法替尼的持续获益超过吉非替尼
IIB 期 LUX-Lung 7 试验是在一线环境 中一对一比较两种 EGFR 定向疗法 (阿法替尼和吉非替尼)的首个前瞻 性全球随机研究。共计 319 名 EGFR 阳性 IIIB/IV 期肺腺癌患者被随机分为每日一次接受 40 mg 阿法替尼或250 mg 吉非替尼。在初步分析中,与吉非替尼相比,阿法替尼显著提高了 PFS 的协同主要终点和治疗失败时间 (TTF)[3]。关键次要终点 ORR 也得到了显著提高。在 WCLC 会议上,Park 等人介绍了初始总生存率(OS) 分析以及其它更新结果[4]。
尽管阿法替尼的死亡风险发生率降低 14 %,但这两组之间的 OS 没有显著差异(对于阿法替尼与吉非替尼,中位 OS,27.9 个月与 24.5 个月;HR,0.86;p = 0.2580)。阿法替尼占据优势的趋势在预先设定亚组中一致,包括具有 19 缺失(30.7 个月与 26.4 个月;HR,0.83)和 L858R 突变(25.0 个月与 21.2 个月;HR, 0.91)的人群。独立审查的 PFS 仍显示出采用阿法替尼治疗的益处(11.0 与 10.9;HR,0.74;p = 0.0178),TTF(13.7 个月与 11.5 个月;HR,0.75;p = 0.0136) 和 ORR(73 % 与 56 %;OR,2.12;p = 0.002)更新结果同样如此。中位反应持续时间为 10.1 个月与 8.3 个月。
这些组之间更新的生活质量数据同样相似。AE 是可预测、可控的,具有同样低的治疗中止率。阿法替尼的剂量减少在不损失疗效的情况下改善毒性。在治疗前 6 个月内接受剂量减 少的患者与在前 6 个月每日一次使用 ≥40 mg 阿法替尼治疗的患者具有相 似的中位 PFS 结果(分别为 12.8 个月和 11.0 个月)。
在老年患者中的发现
由于超过三分之一的肺癌患者至少 75 岁,因此新药的疗效和安全性在该人群中十分重要。由于较差的功能状态和高共病负担, 治疗可能具有挑战性。根据 LUX-Lung 7 中年龄≥75 岁和<75 岁患者的事后亚组分析,高龄不会对使用阿法替尼与吉非替尼治疗取得的结果产生不良影响[5]。PFS 和 OS 结果在各年龄亚组之间一致(图 2)。
图 2:LUX-Lung 7 试验各年龄组中使用阿法替尼与吉非替尼获得的中位 OS
阿法替尼表现出可预测和可控的安全特性。在≥75 岁的患者中,没有出现新的或意料之外的 AE。这些结果表明,阿法替尼能够为具有 EGFR 突变的 NSCLC 老年患者提供有效和可耐受的治疗。
LUX-Lung 8 中的长期反应预测因素
随机化开放标签 III 期 LUX-Lung 8 研究在≥4 周期铂类双药化疗后发生进展的肺鳞状细胞癌(SCC)患者中对每日一次 40 mg 阿法替尼和每日一次150 mg 埃洛替尼进行了比较。这里, 阿法替尼显著提高了 PFS 和 OS(两者的 HR 均为 0.81)[6],这促使其获准用于该适应症。在 LUX-Lung 8 试验中鉴别出一组共 15 名从阿法替尼治疗得到持 久获益 的长期 反应者 (LTR)。在这个队列中,中位治疗持续时间为 16.6 个月。Goss 等人针对有可能指示出阿法替尼长期反应的分子和临床生物标志物进行了研究[7]。
LTR 的基线特征没有与总体阿法替尼治疗人群的基线特征偏离到任何有意义程度。同时,这两组对一线化疗的最佳反应相似。LTR 中的中位 OS 和 PFS 分别为 23.1 个月和 16.2 个月。一名患者经历 CR,四名患者获得PR,并且八名患者具有 SD。在总体研究人群中对 9 名 LTR 和 398 名阿法替尼治疗患者中的 132 名患者进行下一代测序。该分析显示,某些短变体在 LTR 中更常见,诸如 ErbB 家族、MLL、KEAP1 和 PIK3CA 基因中的畸变。在这两组中,拷贝数目畸变具有相似的发生率。根据 VeriStrat®蛋白质组学测定,与总体阿法替尼治疗人群相比,更大比例的 LTR 被归类为“好”(86 %与 62 %)。这些患者存 活≥ 12 个月的几率是“ VeriStrat®-差”患者的近四倍。
LTR 中常见治疗相关 AE 的频率 与在总体阿法替尼治疗人群中观察到的频率相似。对 15 名 LTR 中的 7 位患者保持每日一次 40 mg 阿法替尼, 四位患者增加至 50 mg 阿法替尼。剂 量减少似乎不会对 OS 产生不利影 响。需要进一步研究来预测肺鳞状细 胞癌患者对阿法替尼的长期反应。
然而,Felip 等人没有在 LUX-Lung 8 总体患者人群中发现影响结果的肿瘤生物标志物[8]。虽然这些患者的样本包含多个遗传畸变,但没有生 物标志物能预测阿法替尼或埃洛替尼的临床结果。在“VeriStrat®-差”组中,阿法替尼和埃洛替尼之间的 PFS 和 OS 没有显著差异。研究人员因此得出结论,不论肿瘤特征如何,阿法替尼均比埃洛替尼更有效,并且应被视为肺鳞状细胞癌患者的二线选择。
阿法替尼的脑髓液(CSF) 渗透
CNS 是肿瘤复发的常见部位,原因可能在于一些治疗剂穿过血脑屏障的的渗透率较低。NSCLC 所致脑转移患者的预后不良。LUX-Lung 3 和 LUX- Lung 6 研究表明,阿法替尼对于脑转移 EGFR 阳性 NSCLC 患者的治疗是有效的[9]。
因此,Tamiya 等人前瞻性分析了阿法替尼在 11 名患有 EGFR 阳性 NSCLC 和软脑膜癌的患者中的脑脊液 ( CSF )渗透率 [10] 。他们发现,1.7 %的阿法替尼中位 CSF 渗透率高于先前报道的中位 CSF 渗透率(0.7 %)[11]。分析证明了尤其对于具有外显子 18 突变等罕见 EGFR 突变的患者,阿法替尼对软脑膜癌的疗效。关于毒性,需要特别注意口腔炎、腹泻和皮肤并发症。
阿法替尼在医学上不适宜患者中的使用
由 于 LUX-Lung 3 和 LUX-Lung 6 试验仅包括适合铂基双药化疗的患者, 在不适合这种治疗的患者中,阿法替尼的疗效和毒性仍然未知。一项研究表明, TKI 可以令医学上不适宜的 EGFR 突变东亚患者获益[12]。单组 II 期 TIMELY 试验是在西方人群中开展的关于这一问题的首个试验[13]。39 名被认为不适合进行根治性治疗或化疗,或拒绝化疗的 NSCLC 患者参加了研究。当没有组织适合基因分型, 或基因分型失败/不可用时,他们或者已经具有确认的激活 EGFR 突变,或者显示出具有 EGFR 突变指示的临床特征。治疗包括每日一次 40 mg 阿法替尼直至病情进展。
在 6 个月时,所有患者中有 58 % 存活且无进展( 主要终点)。中位 PFS 和 OS 分别为 7.9 个月和 15.5 个月。在确认具有 EGFR 突变的患者中, PFS 为 10.2 个月,尚未获得 OS。相比之下,怀疑具有 EGFR 突变体的患者相对而言表现较差(分别为 4.4 个月和 10.9 个月),但是这些 PFS 和 OS 结果与 TOPICAL 试验中被认为不适宜进行化疗的类似患者相比有所改善[14]。在 TIMELY 中观察到的毒性比率比在适宜患者中通常观察到的毒性比率更高。39 名患者中有 23 名经历至少一种≥3 级毒性。
埃克替尼优于脑照射
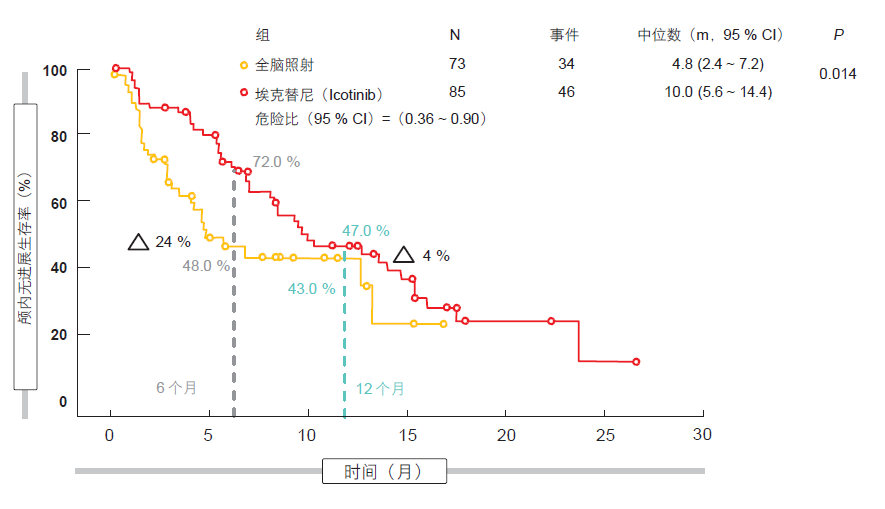
全脑照射( WBI )已经成为脑转移 NSCLC 患者的护理标准。随机化 III 期 BRAIN 试验在具有 EGFR 突变、晚期 NSCLC 和脑转移≥3 个部位的EGFR-TKI 初治患者中将每日三次125 mg EGFR TKI 埃克替尼与协同或不协同化疗的 WBI 相比较进行评价 [15]。在两组中,超过 80 %的患者没有出现与其颅内病灶相关的任何症状。有 85 名和 73 名患者分别接受埃克替尼和 WBI。颅内 PFS 被定义为主要终点。 BRAIN 代表了用来比较EGFR TKI 与 WBI 的首个 III 期试验。
根据这项分析,与 WBI 相比,埃克替尼显著提高了颅内 PFS(中位,10.0 个月与 4.8 个月;HR,0.56;p =0.014)。在 6 个月时,埃克替尼占优达 24 %(72.0 %与 48.0 %;图 3)。
图 3:采用埃克替尼与全脑照射±化疗的颅内 PFS
对于 PFS,也观察到显著获益(6.8 个月与 3.4 个月; HR , 0.44 ; p < 0.001)。采用埃克替尼和 WBI 达到的 6 个月 PFS 比率为 55.0 % 和 22.0 %,而在 1 年时,存活且无进展的患者为 19.0 %与 9.0 %。OS 分析未显示出两组之间存在任何差异。
埃克替尼治疗产生对于颅内 ORR (67.1 %与 40.9 %;p < 0.001)和颅内 DCR ( 84.7 % 与 67.1 % ; p =0.014 )的显著获益。对于总 ORR (55.0 %与 11.1 %;p < 0.001)和总DCR(78.8 % 与 54.8 %;p = 0.001)也是如此。关于治疗相关毒性,埃克替尼组的患者优于对照组,针对所有级别的 AE 均发现 EGFR TKI 占优的显著差异。基于这些数据,作者得出结论,应将埃克替尼用于脑转移晚期 EGFR 突变 NSCLC 患者的一线治疗。
p53 突变的临床意义
Griesinge 等人报告了在具有 EGFR 激活突变的均等使用 TKI 治疗的患者群体中获得的首套数据,表明当分类为致病与非致病/野生型时,p53 突变是 PFS 和 OS 的阴性预测标志物[16]。通常,p53 突变被分类为破坏性或非破坏性。这里,DNA 接触突变 R273C、R273G 和 R248Q 被重新分类为致病性,伴随根据错义分析程序 Align-GVGD 达到 C65 分值的序列置换出现的位于 p53 的 L1-L3 环内的错义突变同样如此。位于 L1-L3 环外的所有其它 p53 突变都被评分为非致病性。
根据 OS 和 PFS 分析,p53 突变的影响是显著的。在那些具有非致病/ 野生型突变的患者中,中位 OS 为 42 个月,而具有致病突变的患者的 OS 为 23 个月。对于 PFS,该时间分别为 18 个月和 11 个月。众所周知,外显子 19 突变患者的预后比外显子 21 突变患者更好,但 p53 突变的预后和预测影响对于这两组均一致。此外,还证明不论患者的临床特征(例如,ECOG 表现状态、CNS 转移、吸烟状态),
p53 突变都是阴性预测因子。研究人员指出,接受 EGFR TKI 的 p53 突变肿瘤患者可能需要不同的治疗管理。在该患者群组中需要 EGFR TKI 与其它药物结合等进一步治疗方法。
另一项分析发现,除了主要的耐药突变 T790M 外,次要突变 L792F 和 C797S 可发生在阿法替尼抗性细胞中[17]。L792F 和 C797S 似乎分别对达克米替尼(dacomitinib)和埃洛替尼敏感。为了能够用这些药物进行治疗,作者建议当出现对阿法替尼的耐药性时,在临床实践中测试这些次要突变。
参考文献
- Papadimitrakopoulou VA et al., Randomised phase III study of osimertinib vs platinum-pemetrexed for EGFR T790-positive advanced NSCLC (AURA3). WCLC 2016, PL03.03
- Wu YL et al., Osimertinib vs platinum-pemetrexed for T790M-mutation positive advanced NSCLC (AURA3): plasma ctDNA analysis. WCLC 2016, MA08.03
- Park K et al., Afatinib versus gefitinib as firstline treatment of patients with EGFR mutationpositive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016; 17: 577-589
- Park K et al., First-line afatinib versus gefitinib in EGFRm+ advanced NSCLC: updated overall survival analysis of LUX-Lung 7. WCLC 2016, OA23.05
- Park K et al., Afatinib versus gefitinib as firstline treatment for EGFR mutation-positive NSCLC patients aged ≥ 75 years: subgroup analysis of LUX-Lung 7. WCLC 2016, P3.02b-044
- Soria J-C et al., Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial. Lancet Oncol 2015; 16: 897-907
- Goss G et al., Second-line afatinib for advanced squamous cell carcinoma of the lung: analysis of afatinib long-term responders in the phase III LUX-Lung 8 trial. WCLC 2016, OA23.03
- Felip E et al., Second-line afatinib versus erlotinib for patients with squamous cell carcinoma of the lung (LUX-Lung 8): analysis of tumour and serum biomarkers. WCLC 2016, P3.02b-003
- Schuler M et al., First-line afatinib versus chemotherapy in patients with non-small cell lung cancer and common epidermal growth factor receptor
gene mutations and brain metastases. J Thorac Oncol 2016; 11: 380-390 - Tamiya A et al., Efficacy and cerebrospinal fluid concentration of afatinib in NSCLC patients with EGFR mutation developing leptomeningeal
carcinomatosis. WCLC 2016, OA08.05 - Hoffknecht P et al., Efficacy of the irreversible ErbB family blocker afatinib in epidermal growth factor receptor (EGFR) tyrosine kinase inhibitor (TKI)-pretreated non-small-cell lung cancer patients with brain metastases or leptomeningeal disease. J Thorac Oncol 2015; 10(1):156-63
- Inoue A et al., First-line gefitinib for patients with advanced non-small-cell lung cancer harboring epidermal growth factor receptor mutations
without indication for chemotherapy. J Clin Oncol 2009; 27(9): 1394-1400 - Popat S et al., Afatinib benefits patients with confirmed/suspected EGFR mutant NSCLC, unsuitable for chemotherapy (TIMELY phase II trial).
WCLC, P3.02b-046 - Lee SM et al., First-line erlotinib in patients with advanced non-small-cell lung cancer unsuitable for chemotherapy (TOPICAL): a doubleblind,
placebo-controlled, phase 3 trial. Lancet Oncol 2012; 13(11): 1161-1170 - Wu YL et al., BRAIN: a phase III trial comparing WBI and chemotherapy with icotinib in NSCLC with brain metastases harbouring EGFR mutations (CTONG 1201). WCLC 2016, PL03.05
- Griesinger F et al., TP53 mutations in EGFR mt+ NSCLC: a new predictive marker. WCLC 2016, MA04.05
- Kobayashi Y et al., EGFR T790M, L792F, and C797S mutations as mechanisms of acquired resistance to afatinib. WCLC 2016, P3.02b-120
More posts
改变实践的肺癌分期细分完善
改变实践的肺癌分期细分完善 第 8 版 TNM 分类已于近期开始实施。与 2009 年发布的第七版[1]相比, 对肺癌分期做出了几项重要调整,目的在于改善预测和研究[2]。
采用尼达尼布(nintedanib)抗血管生成:在间皮瘤中的活性和潜在生物标志物
采用尼达尼布(nintedanib)抗血管生成:在间皮瘤中的活性和潜在生物标志物 LUME-Meso 恶性胸膜间皮瘤通常具有不良的患者预后, 因为其往往在确诊时已属晚期。唯
哪类人群适合免疫疗法?
哪类人群适合免疫疗法? Johan Vansteenkiste, ,医学博士 比利时鲁汶大学校医院呼吸肿瘤科/肺病学 存在哪些定义适合免疫疗法病人的标志物? 当我们考虑
免疫疗法:新型抗 PD-L1 抗体与各种组合方案
免疫疗法:新型抗 PD-L1 抗体与各种组合方案 OAK 亚组分析 与抗 PD-1 抗体相比,针对 PD-L1 的抗体的优点在于它们在不影响 PD- 1/PD-L2 通路
EGFR 突变及其它突变背景下的液体活检
EGFR 突变及其它突变背景下的液体活检 与组织活检和重新活检相比,液体活检具有多个优势,包括最小侵入性, 随时间推移进行连续测量以监测肿瘤反应的机会,以及在影像学检测前检
ALK 阳性NSCLC 的新兴治疗:全新选择与挑战并存
ALK 阳性NSCLC 的新兴治疗:全新选择与挑战并存 使用 ALK 酪氨酸激酶抑制剂(TKI) 克唑替尼(crizotinib)的治疗已被确立为具有 ALK 重排晚期 N