ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題
ALK融合遺伝子陽性NSCLC患者における標準的な第1選択肢として、ALKチロシンキナーゼ阻害薬 (TKI) クリゾチニブによる治療が確立されている。クリゾチニブの出現前は、プラチナ製剤+ぺメトレキセドの2剤併用、それに続くペメトレキセド維持療法が非扁平上皮NSCLCの標準療法であった。しかし、クリゾチニブに対する最初の応答後、ALKチロシンキナーゼドメインでの二次変異を含む可能性のある複数の機序のため常に耐性を獲得する。
さまざまな新世代ALK阻害剤が現在入手可能、または開発中である。セリチニブ、アレクチニブ、ブリガチニブ、エンゼルティニブ、エントレクチニブ、およびローラチニブがある。これらすべてにより、クリゾチニブに対する耐性を付与する変異に対してALK阻害効果と活性が増加する。また、これらの多くはクリゾチニブよりも良好なCNS浸透性を示す。
第1治療薬のセリチニブ:ASCEND-4
セリチニブは、単一群の第I相および第II相ASCEND試験 (ASCEND-1–3) ならびにランダム化第III相試験 (ASCEND-5) において、クリゾチニブ未使用およびクリゾチニブ不応のALK陽性進行NSCLC患者に対して強力な抗腫瘍活性を示した。WCLCの会長シンポジウムで発表された、ランダム化、国際共同、非盲検、ASCEND-4第III相試験において、治療歴のない患者を対象に、第一選択薬のセリチニブ750 mg/日がプラチナ製剤とペメトレキセドの2剤併用の化学療法とそれに続くペメトレキセド維持療法とが比較された[1]。盲検化された独立評価委員会による放射線学的レビューによるPFSが主要評価項目であった。総計376名の患者がこの試験に登録され、189名がセリチニブに、187名が化学療法にランダムに割り付けられた。各群の約3分の1は脳転移を有していた。これら患者の40%に事前の脳放射線治療が実施された。
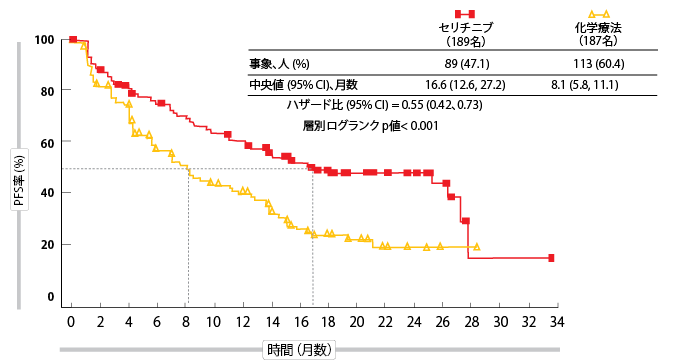
この研究は、主要評価項目に関してポジティブであった。セリチニブ投与群のPFSは化学療法群に比し有意に延長された(16.6カ月対8.1カ月、HR 0.55、 p < 0.001、図)あらかじめ定義されたサブグループの多くで、化学療法に比較してセリチニブでPFS延長が認められた。OSには大きな差はみられなかったが、セリチニブの方が良好な傾向がみられた。24カ月で、OS率は70.6%と58.2%であった。セリチニブのORRは化学療法よりも45%超高かった(72.5%と26.7%)。また、初期奏功中央値はそれぞれ、6.1カ月と13.4カ月であり、患者はセリチニブでより速く奏功した。奏功期間中央値はそれぞれ、23.9カ月と11.1カ月であった。患者の脳転移の有無にかかわらず、セリチニブによりPFSは両群ともに改善した(HRは0.70と0.48)。ALK阻害剤治療は、化学療法と比較して優れた頭蓋内奏効率(72.7%対27.3%)をもたらし、頭蓋内でのセリチニブの効果は持続性があり、奏功期間中央値は16.6カ月であった。
患者報告のアウトカムによると、肺癌症状尺度は化学療法に比し有意に改善され、肺癌特有症状の明確な悪化までの時間が延長された。セリチニブの安全性プロファイルは以前の試験と一致しており、最も多かったAEは、下痢、悪心、肝酵素上昇であった。管理は、用量調整または投与中断/遅延、および併用療法であった。
図:ASCEND-4の主要評価科目:化学療法に対するセリチニブのPFS優位性
J-ALEX:クリゾチニブに対するアレクチニブの優位性
セリチニブに加えアレクチニブは、クリゾチニブ治療において標準的な選択肢である。日本のJ-ALEX試験では、化学療法歴のないまたは化学療法歴1回のみの患者207名が登録された。患者は、第一選択薬のアレクチニブ300 mg 1日2回投与(すなわち、日本でのアレクチニブの標準用量)の群とクリゾチニブ250 mg 1日2回投与の群にランダムに割り付けられた[2]。脳転移の治療歴のある患者および無症候の患者が含まれていた。
試験は非常にポジティブな結果であった。主要評価項目である独立評価委員会評価によるPFSに関して、アレクチニブはクリゾチニブに比較して優れていることが証明された(アレクチニブは50%に未達、クリゾチニブは10.2カ月、HR 0.34、p < 0.0001)。複数層別化Cox回帰分析により、アレクチニブがクリゾチニブに比し優れた治療効果を有するといる整合性のある結果が示され、脳転移のある患者についても同様であった。CNSはALK陽性NSCLC患者の疾患進行の一般的な部位であるので、新規のALK阻害剤の作用は、この点で特に重要である。CNS疾患はJ-ALEX試験における層別化因子ではなかったので、2つの治療群の間で、CNS疾患のない患者の数とCNS疾患のある患者の数に不均衡があった。アレクチニブ治療群に、脳転移治療歴のある患者が多く登録された。
ベースライン時にCNS疾患のある患者およびCNS系疾患のない患者についての別のPFS解析によると、両グループともクリゾチニブに比較してアレクチニブで有意な延長が示された。リスク低
減は、脳病変のない患者で63%(PFS中央値20.3カ月対10.0カ月、HR 0.37、
p = 0.0001)、すでにCNS転移があった患者で91%(50%に未達対10.2カ月、HR 0.09、p = 0.0062)であった。脳病変ありグループのアレクチニブ治療群もまた、CNS疾患の進行までの時間に関して有意に良好であった(HR 0.16、p = 0.0492)。同様に、ベースライン時に脳転移のなかった患者でも、CNS疾患出現までの時間は、アレクチニブに比較して、有意に延長された(HR 0.17、p = 0.0019)。概して、アレクチニブは既存のCNS疾患に対して大きな活性を示し、新しいCNS病変の発現を予防する可能性が高い。
アレクチニブのCNS結果についての最新分析
2つの第II相試験のプール解析により、データがアップデートされた。主要な臨床試験であるNP28761試験およびNP28673試験により、クリゾチニブ治療の進行後のアレクチニブ600 mg 1日2回投与が検討された。NP28761試験は北米で実施され、NP28673は国際的に実施された。試験により、高い奏効率および奏功期間の延長が示された[3, 4]。2015年4月27日にデータを打ち切り、2つの試験のプール解析を行った結果、ベースライン時に測定可能なCNS疾患を伴っていた患者では、CNS ORRは64.0%でありCNS奏功期間は10.8カ月であった[5]。
WCLCにおいて、Ouらは、これら2つの試験でのアレクチニブのCNS有効性を評価する他、2016年に打ち切ったデータを用いてプール解析データをアップデートし、発表した[6]。この解析によると、CNS ORRは、測定可能なCNS疾患を伴っていた患者では64.0%、測定可能なCNS疾患を伴っていなかった患者と測定不可能なCNS疾患を伴っていた患者を合わせると44.1%であった。CNS弛緩抑制率が90.0%および86.0%のとき、完全奏功率はそれぞれ、22.0%と28.7%であった。CNS奏功期間はそれぞれ11.1カ月と13.8カ月であり、奏功期間も延長された。
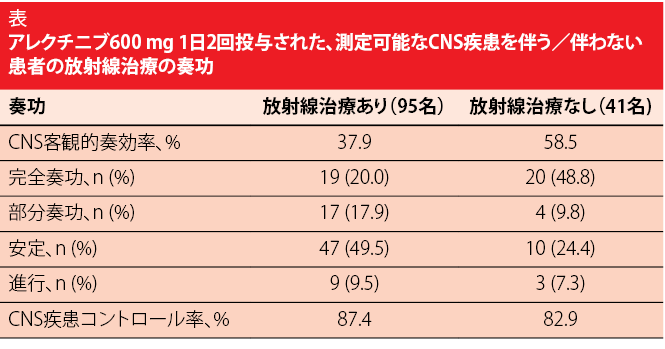
さらに、プール解析により、アレクチニブは放射線治療歴に関係なくCNSに効果があることが示されている。測定可能なCNS疾患を伴っていた患者および測定可能なCNS疾患を伴っていなかった患者の70%に放射線治療歴があった。CNS ORRおよびCNS DCRはそれぞれ、37.9%と87.4%であった。放射線治療歴のない患者では、それぞれ58.5%と82.9%であり、完全奏功率は48.8%であった(表を参照)。
ブリガチニブおよびローラチニブ
同様に、試験段階の次世代ALK阻害剤であるブリガチニブおよびローラチニブも顕著な活性を示し、特にCNSにおいて効果が高い。クリゾチニブ不適応患者を対象にして、2つの用量(1日1回、90 mgおよび180 mg)でブリガチニブを評価した主要なランダム化ALTA第II相試験のアップデートより、両群において大きな有効性と許容可能な安全性プロフ
イルが示された[7]。ブリガチニブ180 mgでは、独立評価委員会評価によるとORRが54%、1年生存率は82%であった。ブリガチニブ180 mg群のPFS中央値は、ブリガチニブ90 mg群のPFS中央値より大きく延長された(15.6カ月対9.2カ月、HR 0.58)。ブリガチニブ180 mgを投与したとき、測定可能な脳転移を伴っていた患者の頭蓋内ORRは67%であった。
これとは別に、現在進行中の第I相/第II相試験およびALTA試験の解析により、頭蓋内CNS転移を伴っていた患者におけるブリガチニブの効果を評価した。その結果、双方の試験において測定可能な転移を伴っていた患者では、それぞれ53%と67%という高い頭蓋内奏功率が示された(ブリガチニブ180 mgのとき)[8]。また、頭蓋内PFS中央値は延長し、14.6カ月および18.4カ月であった。
ローラチニブに関しては、第I相の用量設定試験で、ALK陽性およびROS陽性のNSCLC患者双方で有意な臨床効果が示された。患者の多くは脳転移を伴っており、1回以上のALK TKI治療歴があった[9]。ALK陽性群では、ORRは46%で、PFS中央値が9.6カ月であった。脳転移および標的病変を有する患者で、頭蓋内奏効率42%が達成された。2回以上のALK TKI治療歴のある患者では、奏功期間の延長が認められた。ローラチニブは一般に忍容性が高かった。最も頻度の高い治療に関連する毒性は高コレステロール血症であったが、これはスタチン療法で管理可能であった。この試験の第II相試験は、世界中の57のセンターで実施中である。
治療の選択-現在の見通し
ALKを標的とした薬剤分野の発展に伴い、患者選択およびALK TKI選択に関していくつかの疑問が提起されている。
「多くのクリゾチニブ耐性腫瘍が長期にわたりALK依存のままであるという見解は、逐次療法の根拠となる」と、オーストラリア、メルボルンのPeter MacCallum Cancer CentreのBenjamin Solomon医師 (MBBD、PhD) は述べた[10]。レトロスペクティブな解析により、ALK陽性NSCLS患者における逐次ALK阻害剤療法に生存率向上が示唆された[11, 12]。
近年の臨床試験を踏まえると、クリゾチニブに代わって次世代の阻害剤が最初から使用されるように思われるが、進行したALK陽性NSCLCの最適な第一選択治療はまだ確立されていない。「現在進行中の第III相試験により、この問題に確実に対処するための多くのデータが提供されるでしょう」と、Solomon医師は指摘した。現在のところは、第一選択のクリゾチニブ療法の後に、セリチニブ、アレクチニブ、ブリガチニブなどの第2世代のALK阻害剤が使用できる。これらの薬剤の使用時に進行したとき、第3選択薬の選択はCNS活性および進行時の優性変異に依存する。「ある種のALK阻害剤は、他の種類よりCNSにおいて効果的なことがある」とSolomon医師は説明した。効果はまた変異によっても異なる。例えば、I1171T変異は、アレクチニブに対する耐性を付与するが、セリチニブに対しては耐性を付与しない。新しいALK阻害剤に対する変異のスペクトルは、クリゾチニブ耐性検体で見られる変異スペクトルとは異なる[13]。現在利用可能なALK阻害剤の中で、ローラチニブは最も広く変異をカバーし、クリゾチニブ、セリチニブ、およびアレクチニブに対する耐性を付与するG1202R変異もカバーしている。したがって、ローラチニブのような第3選択薬は、第2世代のALK TKI耐性変異および/またはCNS疾患の場合の選択肢になり得る。
Solomon医師が述べたように、液体生検などの戦略を用いたALK変異の評価が、最終的にALK TKI療法の選択に役立つ可能性がある。標的外の耐性メカニズムを克服するには、組み合わせ戦略が必要になるかもしれない。「この可能性には免疫療法との組み合わせも含まれます。」
参考文献
- De Castro G et al., First-line ceritinib versus chemotherapy in patients with ALK-rearranged (ALK+) NSCLC: a randomized, phase 3 study (ASCEND-4).WCLC 2016, PL03.07
- Kim YH et al., Alectinib (ALC) versus crizotinib (CRZ) in ALK-positive non-small cell lung cancer (ALK+ NSCLC): primary results from phase III study (J-ALEX) – focus on CNS efficacy.WCLC 2016, MA07.03
- Shaw AT et al., Alectinib in ALK-positive, crizotinib-resistant, non-small-cell lung cancer: a single-group, multicentre, phase 2 trial.Lancet Oncol 2016; 17(2): 234-242
- Ou SH et al., Alectinib in crizotinib-refractory ALK-rearranged non-small-cell lung cancer: a phase II global study.J Clin Oncol 2016; 34(7): 661-668
- Gadgeel S et al., Pooled analysis of CNS response to alectinib in two studies of pretreated patients with ALK-positive non-small-cell lung cancer.J Clin Oncol 2016; 34(34): 4079-4085
- Ou SH et al., Updated pooled analysis of CNS endpoints in two phase II studies of alectinib in ALK+ NSCLC.WCLC 2016, MA07.01
- Camidge DR et al., Brigatinib in crizotinib-refractory ALK+ NSCLC: Central assessment and updates from ALTA, a pivotal randomized phase 2 trial.WCLC 2016, P3.02a-013
- Gettinger SN et al., Brigatinib activity in patients with ALK+ NSCLC and intracranial CNS metastases in two clinical trials.WCLC 2016, OA08.06
- Felip E et al., Safety and efficacy of lorlatinib (PF-06463922) in patients with advanced ALK+ or ROS1+ non-small-cell lung cancer (NSCLC).WCLC 2016, MA07.11
- Solomon B, Optimal application and sequence of ALK inhibition therapy.WCLC 2016, SC11
- Gainor JF et al., Progression-free and overall survival in ALK-positive NSCLC patients treated with sequential crizotinib and ceritinib.Clin Cancer Res 2015; 21(12): 2745-2752
- Watanabe S et al., Progression-free and overall survival of patients with ALK rearrangement-positive non-small cell lung cancer treated sequentially with crizotinib and alectinib.Clin Lung Cancer 2016; 17(6): 528-534
- Gainor JF et al., Molecular mechanisms of resistance to first- and second-generation ALK inhibitors in ALK-rearranged lung cancer.Cancer Discov 2016; 6(10): 1118-1133
More posts
診療を変える肺癌ステージ分類の変更
診療を変える肺癌ステージ分類の変更 TNM分類が最近第8版に改定された。2009年に発刊された第7版[1]と比較して、予後と研究の改善を目的として、肺癌のステージ分類にいく
ニンテダニブによる抗血管新生:中皮腫における活性、バイオマーカの候補
ニンテダニブによる抗血管新生:中皮腫における活性、バイオマーカの候補 LUME-Meso 悪性胸膜中皮腫は、一般に進行期に診断されることが多いため、患者の予後が不良である。
インタビュー:「免疫療法の対象者は誰か?」
免疫療法の対象者は誰か Johan Vansteenkiste, MD, PhD, Respiratory Oncology Unit/Pulmonology, Unive
免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン
免疫療法:新規抗PD-L1抗体およびさまざまな併用レジメン OAKサブグループ解析 抗PD-1抗体と比較した抗PD-L1抗体の利点は、PD-1/PD-L2経路をそのまま残し
EGFRおよび他の変異における液体生検
EGFRおよび他の変異における液体生検 組織生検および再生検と比較して、液体生検では最少の侵襲性、腫瘍奏功をモニタリングするための経時的に連続測定が可能、X線検査に先立って
ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題
ALK陽性NSCLCにおける新たな治療法:新しい選択肢と新たな課題 ALK融合遺伝子陽性NSCLC患者における標準的な第1選択肢として、ALKチロシンキナーゼ阻害薬 (TK