免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息
SCLC中肿瘤突变负荷是否相关?
复发性小细胞肺癌(SCLC)患者仅具有有限的治疗选择。CheckMate 032试验在接受过至少一种先前铂类化疗方案的SCLC患者的PD-L1未选择队列中评估了伴或不伴抗CTLA-4抗体易普利姆玛(ipilimumab)的抗PD-1抗体纳武单抗(nivolumab)。在该条件下,单独采用纳武单抗和联合治疗均显示出令人印象深刻的活性:2年OS率分别为26%和14%[1]。无论PD-L1状态如何,均会产生应答。
由于SCLC患者中PD-L1表达并不常见,因此在这种肿瘤类型的免疫治疗中需要改进的生物标志物。对前线纳武单抗与化疗进行比较的随机化III期CheckMate 026试验发现肿瘤突变负荷(TMB)是使用纳武单抗的预测性生物标志物[2]。因此,Antonia等人对CheckMate 032试验数据进行了探索性TMB分析,目的在于评估这种观察是否适用于SCLC[3]。
TMB可评估组纳入了211名患者,其中133名和78名患者分别接受单药纳武单抗和纳武单抗加易普利姆玛。TMB由全外显子组测序确定,并计算作为肿瘤中错义突变的总数。在分析中,基于TMB三分位数将患者分为三个亚组。TMB可评估患者代表了总人群,其中在两个治疗组中具有可比性的PFS和OS结果。
高TMB下改善的活性
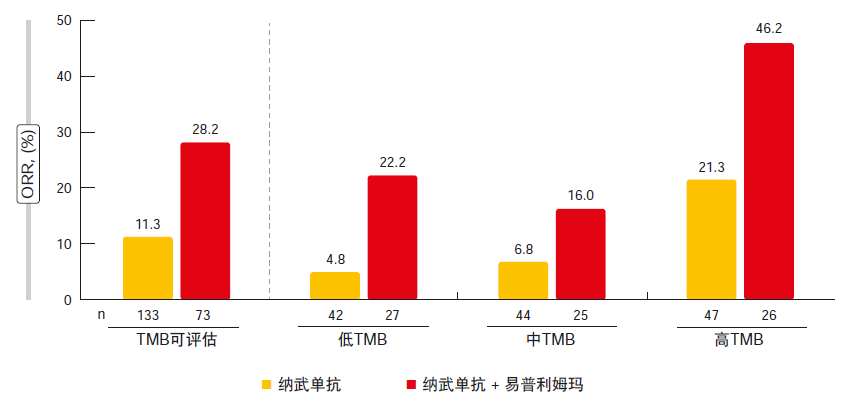
根据各TMB亚组的ORR分析,在低、中、高TMB组中观察到纳武单抗治疗的ORR增量提高,范围为4.8%到21.3%(图1)。另一方面,纳武单抗和易普利姆玛的联合使用在中低TMB队列中得到类似的缓解率,而高TMB组表现出令人印象深刻的46.2 %的ORR。
类似地,对于PFS也有不同获益,其中高TMB队列采用两种治疗均出现了相当长的无进展间隔。1年时,纳武单抗和联合治疗的PFS率分别为21.2 %和30.0 %。与此相反,低TMB和中TMB患者显示出个位数范围的PFS率。OS分析显示,纳武单抗单药治疗时TMB升高则生存率增加;在本研究中,对于具有低、中、高TMB的患者,1年OS率分别为22.1 %、26.0 %和35.2 %。相比之下,同时接受纳武单抗和易普利姆玛治疗的患者在具有高TMB时(1年OS率62.4 %)相比低TMB或中TMB(分别为23.4 %和19.6 %)明显表现更好。
总体而言,在NSCLC条件下,SCLC患者根据其肿瘤突变负荷对免疫治疗表现出不同的应答。在高TMB患者中,纳武单抗单药治疗和纳武单抗加易普利姆玛治疗均产生改善的结果,但联合治疗的结果明显更加稳健。进行TMB截止值的优化和TMB的前瞻性研究是必要的。正如作者所总结的,TMB可能是与所有肺癌相关的预测性生物标志物。
图1: CheckMate 032:根据肿瘤突变负荷的缓解率
OAK:根据Teff基因表达的分析
在II期POPLAR研究中,已经证实作为预存免疫性标志物的T效应物(Teff)基因标签的高表达与用抗PD-L1抗体atezolizumab治疗的患者的生存率改善相关[4]。因此,进行了对III期OAK研究的回顾性探索分析,以评估Teff基因表达与该试验中使用atezolizumab达到的临床获益之间的关系[5]。OAK试验中纳入的患者在二线或二线以上治疗条件下接受atezolizumab或多西他赛(docetaxel)。初步分析显示,与多西他赛相比,使用atezolizumab获得显著改善的中位OS(13.8与9.6个月;HR,0.73;p = 0.0003),但仅在高PD-L1表达的患者中观察到使用atezolizumab带来的PFS获益[6]。
在初始OAK人群中,753名患者具有足以评估Teff基因表达的肿瘤组织。出于该分析目的,通过三种基因(PDL1、CXCL9、IFNG)的mRNA表达定义Teff标签。根据免疫组织化学(IHC),Teff基因标签与PDL1表达之间存在部分重叠,但同时,Teff基因标签在PDL1阴性人群范围内确定了独特的患者子集。
更高准确度的PFS预测
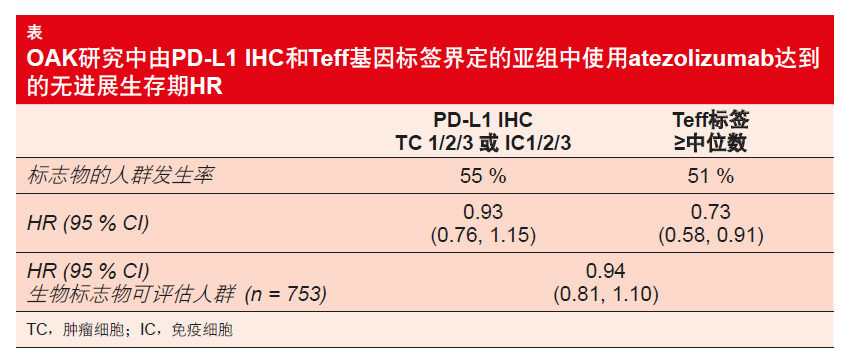
本研究的结果表明Teff基因标签相比PD-L1表达是更敏感的PFS生物标志物。评估了三种不同的Teff基因表达水平。分析显示,更高的表达水平与atezolizumab介导的PFS获益之间存在显著联系。具有高Teff基因表达(≥50%)患者的PFS HR为0.73,而低表达(< 50 %)患者的PFS HR为1.30。与根据IHC的PD-L1状态相比,Teff标签以两种生物标志物具有可比性的人群发生率鉴定出使用atezolizumab治疗出现显著PFS获益的大量患者(表)。对于OS来说,atezolizumab介导的获益类似于在整个生物标志物可评估人群中观察到的获益,尽管Teff标签也在所有表达截止值处富集了改善的结果。
这些发现表明,预存免疫性可能是确定免疫治疗药物在肺癌患者中疗效的重要生物学方面。正在进行的研究旨在进一步验证Teff基因标签作为免疫疗法疗效的潜在预测性生物标志物在一线NSCLC治疗中的作用。
PACIFIC研究:功能和生活质量
双盲安慰剂对照的国际化III期PACIFIC试验在根治性铂类并行放化疗后没有进展的III期、局部晚期、不可切除NSCLC患者中对10 mg/kg抗PD-L1抗体durvalumab每2周一次持续长达12个月(n= 476)与安慰剂(n = 237)进行比较。未根据PD-L1表达状态选择患者。中期PFS分析显示,与安慰剂相比,使用durvalumab产生显著更优的结果(中位PFS,16.8与5.6个月;HR,0.52;p <0.0001)[7]。
在WCLC上,Hui等人介绍了患者报告结果(PRO),这是PACIFIC研究预先设定的次要终点[8]。使用EORTC QLQ-C30 v3问卷及其肺癌模块QLQ-LC13评估症状、身体功能和总体健康状态/生活质量。据此,在整个研究中,使用durvalumab和安慰剂的关键症状评分以及功能和总体健康状态均保持稳定。组间在相对于基线的变化方面无显著差异。在第48周,对于吞咽困难和脱发在每组中均观察相对于基线的临床相关改善,这表明与所有患者接受的并行放化疗相关的毒性缓解。在项目改善的可能性方面,使用durvalumab发生食欲减退改善的可能性更大,而在功能或其他症状方面,而在机能或其他症状方面不存在改善率的组间差异。对于至功能和症状恶化的时间,分析显示使用durvalumab和安慰剂就大多数项目而言无差异。仅至“其他疼痛” 恶化的时间在使用durvalumab时时间更长(HR,0.72)。然而,这种差异并未反映在任何额外“疼痛”项目中。
总体而言,这项分析显示在放化疗后增加使用12个月的durvalumab并不损害局部晚期不可切除NSCLC患者的生活质量。除了来自PACIFIC的积极疗效与安全性数据之外,这些发现进一步支持了durvalumab在早期治疗条件下的临床意义。
一线派姆单抗(pembrolizumab):KEYNOTE-024的更新情况
Brahmer等人介绍了国际随机化开放III期KEYNOTE-024试验的更新分析,该试验在305名未经治疗的表达PD-L1的IV期NSCLC患者(肿瘤比例分数[TPS] ≥ 50 %)中对派姆单抗与铂类化疗进行比较[9]。初步分析显示,在PFS(HR,0.50)和OS(HR,0.60)方面,派姆单抗相对于化疗具有显著优效性,但当时派姆单抗组中尚未达到中位OS [10]。
在25.2个月的中位随访期后,更新的OS分析显示出派姆单抗的显著获益,具有令人瞩目的30.0个月的中位生存结果(化疗组为14.2个月;HR,0.63;p = 0.002;图2)。派姆单抗组和化疗组患者的24个月OS率分别为51.5%和34.5%。尽管化疗组中接受抗PD-1治疗的显著有效交叉率达到了63%,但仍保持了这种改善。
派姆单抗和化疗的ORR分别为45.5 %与29.8 %(p = 0.0031)。交叉到使用派姆单抗的患者出现20.7%的ORR。在所有接受派姆单抗治疗的患者中,尚未达到中位缓解持续时间
(化疗组为7.1个月)。在7.9个月的中位暴露时间(大于化疗组两倍中位暴露时间)后,派姆单抗继续显示出有利的安全性特征。作者得出结论认为,派姆单抗仍然是NSCLC和高PD-L1表达(TPS ≥ 50 %)患者一线治疗的治疗标准。
图2: KEYNOTE-024试验中更新的总生存率结果
使用纳武单抗治疗脑转移患者
一项意大利扩展使用项目提供了在对照临床试验之外在IIIB/IV期非鳞状NSCLC和CNS转移患者中评估每2周一次3 mg/kg纳武单抗持续最多24个月的机会 [11]。具有脑部病灶的患者符合资格,前提是其在入选前至少2周没有神经系统症状,并且无需进行系统性皮质类固醇治疗,或者正在接受≤ 10 mg/天的稳定或减量泼尼松(prednisone)或泼尼松等同物。在153个中心参与研究的1,588名患者的总人群中,409名(26 %)患者具有无症状和受控的脑转移。29 %的患者在基线时接受类固醇治疗,并且18 %的患者接受伴随放疗。
在该组中纳武单抗治疗的疗效和安全性似乎与在整体队列和CheckMate 057试验人群中观察到的类似[12]。ORR和DCR分别为17 %和40 %。4名患者(1%)发生CR,64名患者(16%)发生PR,并且96名患者(23%)发生SD。CNS转移患者的中位OS为8.6个月,而所有患者的中位OS为11.3个月。在1年时,CNS转移患者和总体队列中分别有43%和48%的患者存活。
CNS队列和总人群的中位PFS均为3.0个月。1年PFS率分别为20 %和22 %。这些结果表明,CNS转移患者可获益于使用纳武单抗的免疫疗法。
参考文献
- Hellmann MD et al., Nivolumab (nivo) ± ipilimumab (ipi) in advanced small-cell lung cancer (SCLC): First report of a randomized expansion cohort from CheckMate 032. J Clin Oncol 35, 2017 (suppl; abstr 8503)
- Carbone DP et al., First-line nivolumab in stage IV or recurrent non-small-cell lung cancer. N Engl J Med 2017; 376: 2415-2426
- Antonia SJ et al., Impact of tumor mutation burden on the efficacy of nivolumab or nivolumab + ipilimumab in small cell lung cancer: an exploratory analysis of Checkmate 032. WCLC 2017, OA 07.03a
- Fehrenbacher L et al., Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet 2016; 387(10030): 1837-1846
- Kowanetz M et al., Pre-existing immunity measured by Teff gene expression in tumor tissue is associated with atezolizumab efficacy in NSCLC. WCLC 2017, MA 05.09
- Rittmeyer A et al., Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017; 389(10066): 255-265
- Antonia SJ et al., Durvalumab after chemoradiotherapy in stage III non-small-cell lung cancer. N Engl J Med 2017 Sep 8. doi: 10.1056/NEJMoa1709937. [Epub ahead of print]
- Hui R et al., Patient-reported outcomes with durvalumab after chemoradiation in locally advanced, unresectable NSCLC: data from PACIFIC. WCLC 2017, PL 02.02
- Brahmer JR et al., Updated analysis of KEYNOTE-024: pembrolizumab versus platinum-based chemotherapy for advanced NSCLC with PD-L1 TPS ≥ 50%. WCLC 2017, OA 17.06
- Reck M et al., Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016; 375: 1823-1833
- Crinò L et al., Italian nivolumab expanded access programme (EAP): data from patients with advanced non-squamous NSCLC and brain metastasis. WCLC 2017, P1.01-053
- Borghaei H et al., Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015; 373: 1627-1639
More posts
化疗:新方法、新治疗条件
化疗:新方法、新治疗条件 SCAT:使用BRCA1定制辅助化疗 现有指南推荐,在有淋巴结受累的完全切除NSCLC患者(II-IIIA期)中进行术后铂类化疗[1]。然而,生存
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据 恶性胸膜间皮瘤(MPM)是一种侵袭性肿瘤,如果不进行治疗,则中位生存期为7-9个月[1]。不可切除
以靶向方式治疗鳞状细胞癌
以靶向方式治疗鳞状细胞癌 阿法替尼的潜在获益 在具有鳞状细胞癌(SCC)组织学亚型的NSCLC患者中不对EGFR突变状态进行常规检查,这是由于EGFR突变在这些肿瘤患者中的
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息 SCLC中肿瘤突变负荷是否相关? 复发性小细胞肺癌(SCLC)患者仅具有有限的治疗选择。CheckMate 032试
进一步采取抗EGFR药物治疗:多线
进一步采取抗EGFR药物治疗:多线 先前EGFR TKI疗法后的奥希替尼(osimertinib)治疗 获得性耐药通常伴随着一线EGFR TKI疗法,而门控T790M突变是
“我们正朝着更好地控制肺癌稳步迈进”
“我们正朝着更好地控制肺癌稳步迈进” Keunchil Park, 医学博士 韩国首尔成均馆大学医学院三星医疗中心创新癌症医学研究所血液/肿瘤科 今年WCLC的口号是“携