外科手术有哪些新方法?重新定义当前选择
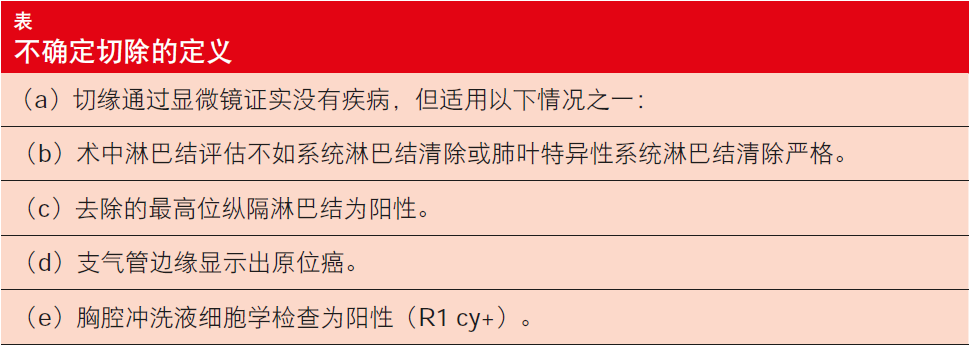
2005年,国际肺癌研究协会(IASLC)分期委员会提出了肺癌完全切除的定义,其包括不确定切除的标准[1]。不确定切除根据下表中详细列出的标准进行定义。该定义包括代表IASLC分期和预后因素委员会,Edwards等人代表IASLC分期和预后因素委员会,使用从第8版数据库获得的接受NSCLC手术的14,712名患者的数据,对切缘状态进行了回顾性分析[2]。可获得这些患者的完全切除状态和生存期数据。排除了新辅助治疗病例。如果以下任何情况适用,则将病例重新分配为R (不确定) [R(un)]:
+ 检查出少于3个N1或N2结节
+ 未进行肺叶特异性系统淋巴结清除
+ N2结节囊外侵袭
+ 最高位淋巴结区阳性(无法获取最高位结节状态)
+ 支气管切缘处原位癌(目前R1[i.s.])
+ 胸腔冲洗液细胞学检查为阳性(目前R1 [cy+])
高质量手术分期的重要性
根据常规切除状态获得的生存期曲线表明R0与R1之间存在显著差异,但R1与R2之间无显著差异。重新分配后,55.8 %的病例(n = 8,203)变成R(un)病例。对于R(un)类别分配原因,尽管存在合理数量的“仅最高区阳性”病例,与系统淋巴结清除相比,术中分期不太严谨,且存在于绝大多数病例中。在最高区阳性的pN2病例中,中位生存期比最高区阴性患者短14个月(41.0个月与55.0个月;HR,1.45;p < 0.0001)。根据N0病例中切除状态获得的生存期曲线分离,但不显著。在结节阳性病例中,R(un)患者的中位生存期比R0患者少20个月(50.0个月与70.0个月;HR,1.27;p < 0.0001)。但是,在其他提出的R(un)类别中病例数量较少。
作者得出结论认为,IASLC提出的完全切除定义具有相关性。承认高质量手术分期结合分期调整,为肿瘤提供最准确的分期分组,以及提供各分期最有利的生存期数据十分重要。然而,临床试验必须考虑手术的质量标准,可以使用这些标准对临床试验进行系统评估。最佳分期数据还允许针对常规辅助疗法作出最适当的决策,并准确解读辅助疗法临床试验中的生存期。R域分委会将继续努力改进所提出的R状态描述符。
如何处理筛选检测到的肺癌
日本东京国立癌症中心医院胸外科Shun-ichi Watanabe博士讨论了使用CT筛查对检测到的小肿瘤进行优化管理[3]。据其报道,第一系列成功的肺段切除术报道于1973年[4],但是比较肺叶切除术与亚肺叶切除术的唯一随机化对照试验结果明显支持肺叶切除术[5],因此令其在半个多世纪以来一直是标准手术疗法。
然而,今天,使用CT筛查检测到许多小的亚实性肿瘤。Watanabe博士强调,“理想的程序,即观察、肺段切除术或肺叶切除术,在当时就一些结节而言是有争议的。”在日本,根据肿瘤大小和C/T比,即最大固结直径除以最大肿瘤直径,选择手术类型。Watanabe博士表示:“根据JCOG0201试验,C/T比< 0.25视为非浸润性[6]。”
当进行亚肺叶切除时,必须在肺段切除术与楔形切除术之间作出选择。如果进行肺段切除术,区域淋巴途径则被去除,这意味着即使对于浸润性肿瘤也可应用解剖性肺段切除术。然而,非解剖楔形切除术应当仅限于非浸润性肿瘤,因为肿瘤细胞可能存在于淋巴途径内。
即将获得的试验结果
Watanabe博士指出,在亚肺叶切除的情况下,关注的重点涉及确保充分的切缘并排除具有胸膜浸润的肿瘤。
“手术边缘应当超过肿瘤直径,当然这可能有困难,尤其是在肺尖部。”在胸膜浸润的情况下,跳跃性转移是可能的。
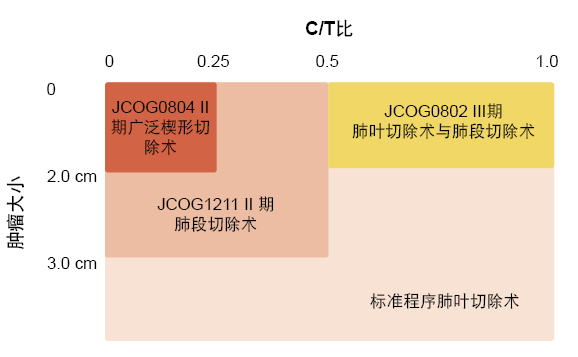
2009年,日本临床肿瘤学组(JCOG)启动了两项临床试验,探索小型(≤ 2 cm)肺部肿瘤的不同手术疗法(图1)。单组II 期JCOG0804研究考察了广泛楔形切除术,并且III期JCOG0802试验比较了肺叶切除术与肺段切除术。“两项研究的招募工作已经完成,并且正在对患者进行随访。”
JCOG正在进行另一项III期试验,JCOG1211,考察在T1c肿瘤大小> 2 cm(C/T比< 0.5)的患者中进行肺段切除术。这项研究基于在直径≤2 cm(C/T比< 0.25)和≤ 3 cm(C/T比<0.5)的肿瘤患者中显示出良好预后的JCOG0201生存期结果而启动[7]。五年总生存(OS)率分别为97.1%和96.7%。
JCOG1211已经完成招募。总体而言,三项亚肺叶切除试验包含1,836例病例。如Watanabe博士所推断,这些结果可能会改变现状。
图1: 正在进行的探索亚肺叶切除的试验
双侧纵隔淋巴结清扫术
试验研究显示,淋巴引流发生在左肺下叶至对侧纵隔淋巴结[8]。迄今为止,关于广泛纵隔切除生存期效果的I级证据尚不可知,并且双侧纵隔淋巴结清除在肺癌中的作用仍不清楚。因此,随机化对照研究的目的在于分析双侧纵隔淋巴结清扫术(BML)对NSCLC患者生存期的影响[9]。2010年至2013年间,89名I期至IIIa期NSCLC患者被随机分配至采用系统性淋巴结清除术(SLND;n = 49)或BML(n = 40)的标准肺切除。
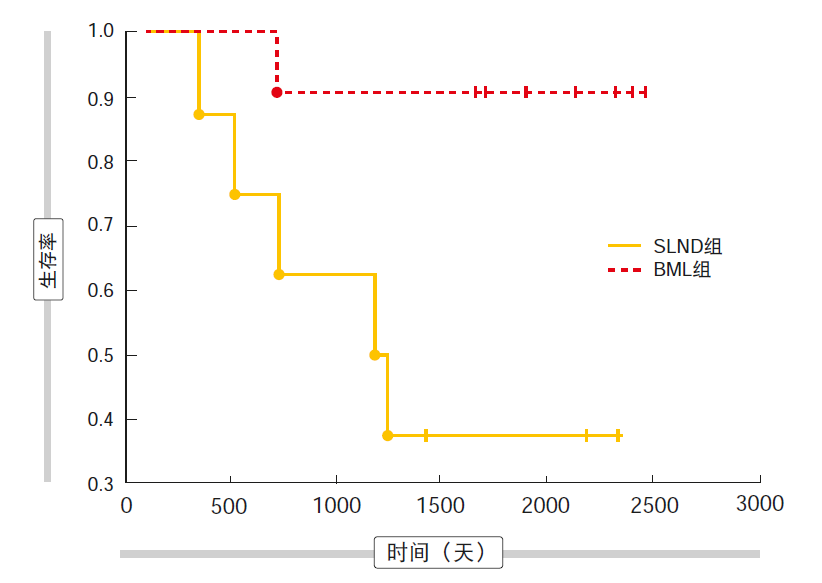
在66.5个月的平均随访期后,BML组的4年生存率显著高于SLND组(72.5 %与51 %;P = 0.039)。对肿瘤的不同肺叶位置进行单独比较,结果显示对于位于右肺和位于左肺上叶的肿瘤,两组之间的4年生存率和平均生存时间没有显著差异。然而,对左肺下叶的分析表明,BML队列的4年生存率显著提高(90.9 %与25 %;p = 0.003;图2)。因此,平均生存期明显更长(1,923天与1,244天;p=0.027)。
这些发现表明,对于位于左肺下叶的NSCLC,对侧纵隔淋巴结的去除可能与显著的生存获益相关。由于患者数量较少,因此应当在更大规模的随机化对照研究中证实试验结果。最近发起了基于类似方案的大型国际试验,其旨在验证这些发现。
图2: 接受采用双侧纵隔淋巴结清扫术(BML)或系统性淋巴结清除术(SLND)的标准肺切除患者的长期生存率
转移性NSCLC患者中的原发性肿瘤切除
寡转移性NSCLC可代表一种惰性表型,其可能从诸如手术或放疗等局部消融治疗中获益。Kang等人在具有转移性OS和无进展生存期(PFS)的患者中评估了原发性肿瘤切除和积极的局部巩固疗法对3年OS和PFS的潜在影响[10]。此外,目的还包括评估转移性NSCLC患者的手术治疗结果以及鉴定预测OS和PFS的临床因素,以便改善患者对手术的选择。
以回顾性方式对具有IV期疾病和≤ 3个转移部位的连续治疗患者进行分析。如果肿瘤已知携带EGFR突变,则患者曾接受过标准一线系统性治疗
(即,≥ 4个周期的铂类双药化疗)或批准的一线EGFR TKI治疗≥ 3个月。根据肺切除程度,将患者分为两个亚组:意向治愈(ITC;去除全部或原发性肺病灶)和意向活检(ITB;保留主要病灶,仅通过微创方法进行诊断性活检)。主要终点为3年OS和PFS。
2000年至2015年间,招募了115名患者。分析显示,与维持治疗或单独观察相比,原发性肿瘤切除联合系统性治疗是可行的、可耐受的,并且显著延长OS和PFS。ITC和ITB的中位OS分别为未达到与23个月(HR,0.38;p < 0.0001),中位PFS分别为36个月与10个月(HR,0.35;p < 0.0001)。ITC队列在M1a、M1b和M1c亚组中出现了更长的OS和PFS。对于在多变量Cox比例回归分析中评估的与OS和PFS相关的特征,仅临床M期和治疗类型(ITC与ITB)被鉴定为显著因素。两组中均没有患者出现4级不良事件(AE)或因AE而死亡。作者指出,这些结果是探索性的,但值得进一步评估。有必要鉴定最有可能获益的患者亚组。
低创手术的优势
在I期NSCLC老年患者中,亚肺叶切除被证明是标准肺叶切除术的替代方法[11]。Laohathai等人认为,这种方法可能是优选的,因为其降低了手术风险并更好地保留了肺功能。从2003年到2016年,招募了77名接受I期NSCLC根治性切除的八旬老年患者。其中53例和24例分别接受肺叶切除和亚肺叶切除。两组在性别、吸烟史、体力状态和合并症方面没有差异,但COPD除外,其在亚肺叶切除治疗组中更为普遍。回顾性地收集了临床数据。OS和无复发生存期(RFS),以及并发症率为结果。
事实上,两组之间的OS差异并不显著,肺叶和亚肺叶切除的5年总生存率分别为51 %和68 %(p = 0.354)。这也适用于RFS(复发率分别为57.14 %和42.86 %;p = 0.623)。同时,采用亚肺叶切除的并发症发生频率低于肺叶切除(13 %与26 %)。肺炎和持续性肺漏气是肺叶切除组中的主要AE。接受亚肺叶切除患者的住院时长(LOS)显著更短(p = 0.011)。
VATS与OT
样,回顾性分析显示,视频辅助胸腔镜手术(VATS)和开放式胸廓切开术(OT)在生存期结果方面相当,同时表明了低创方法的LOS优势[12]。
VATS已成为治疗早期肺癌的推荐方法,但迄今为止,尚无任何大型随机化临床试验正式将其与OT进行比较,尽管英国的VIOLET研究即将完成。
这项单个机构病例审查纳入了总计235名被诊断患有I-III期肺癌的患者,这些病历患者在2005年至2015年间曾接受过VATS或OT。在该组中,VATS和OT分别在101名和134名患者中进行。诊断时的年龄、性别、烟草使用、肿瘤位置和肿瘤大小在各组中类似。
VATS与OT的阳性切缘风险具有可比性。两种技术的OS和RFS相似(分别为p = 0.68和p = 0.23),而接受VATS的患者的中位LOS显著缩短(4天与6天;p = 0.002)。无论诊断时的肿瘤分期如何,均获得了这些有利的结果。
参考文献
- Rami-Porta R et al., Complete resection in lung cancer surgery: proposed definition. Lung Cancer 2005; 49(1): 25-33
- Edwards J et al., The IASLC Lung Cancer Staging Project: analysis of resection margin status and proposals for R status descriptors for non-small cell lung cancer. WCLC 2017, PL 02.06
- Watanabe S et al., What is the optimal management of screen-detected lung cancers? WCLC 2017, PL 01.04
- Jensik RJ et al., Segmental resection for lung cancer. A fifteen-year experience. J Thorac Cardiovasc Surg 1973; 66: 563-572
- Ginsberg RJ, Rubinstein LV, Randomized trial of lobectomy versus limited resection for T1 N0 non-small cell lung cancer. Lung Cancer Study Group. Ann Thorac Surg 1995; 60: 615-623
- Suzuki K et al., A prospective radiological study of thin-section computed tomography to predict pathological noninvasiveness in peripheral clinical IA lung cancer (Japan Clinical Oncology Group 0201). J Thorac Oncol 2011; 6: 751-756
- Asamura H et al., Radiographically determined noninvasive adenocarcinoma of the lung: survival outcomes of Japan Clinical Oncology Group 0201. J Thorac Cardiovasc Surg 2013; 146: 24-30
- Hata E et al., Rationale for extended lymphadenectomy for lung cancer. Theor Surg 1990; 5: 19-25
- Kuzdzal J et al., Randomised trial of systematic lymph node dissection versus bilateral mediastinal lymphadenectomy in patients with NSCLC – the Cracow Study. WCLC 2017, OA 04.01
- Kang X et al., Primary tumor resection versus maintenance therapy of observation for patients with metastatic non-small cell lung cancer in combination with first-line systemic therapy. WCLC 2017, OA 04.03
- Laohathai S et al., Comparison between sublobar and lobar resection in octagenarians with pathologic stage I non-small cell lung cancer. WCLC 2017, P1.16-005
- Shaheen S et al., Less is more – video assisted thoracic surgery (VATS) vs. open thoracotomy in the management of resectable lung cancer. WCLC 2017, P1.16-006
More posts
化疗:新方法、新治疗条件
化疗:新方法、新治疗条件 SCAT:使用BRCA1定制辅助化疗 现有指南推荐,在有淋巴结受累的完全切除NSCLC患者(II-IIIA期)中进行术后铂类化疗[1]。然而,生存
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据
恶性间皮瘤:尼达尼布(nintedanib)和检查点抑制剂的相关近期数据 恶性胸膜间皮瘤(MPM)是一种侵袭性肿瘤,如果不进行治疗,则中位生存期为7-9个月[1]。不可切除
以靶向方式治疗鳞状细胞癌
以靶向方式治疗鳞状细胞癌 阿法替尼的潜在获益 在具有鳞状细胞癌(SCC)组织学亚型的NSCLC患者中不对EGFR突变状态进行常规检查,这是由于EGFR突变在这些肿瘤患者中的
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息
免疫疗法:初露端倪的新型生物标志物与来自关键试验的消息 SCLC中肿瘤突变负荷是否相关? 复发性小细胞肺癌(SCLC)患者仅具有有限的治疗选择。CheckMate 032试
进一步采取抗EGFR药物治疗:多线
进一步采取抗EGFR药物治疗:多线 先前EGFR TKI疗法后的奥希替尼(osimertinib)治疗 获得性耐药通常伴随着一线EGFR TKI疗法,而门控T790M突变是
“我们正朝着更好地控制肺癌稳步迈进”
“我们正朝着更好地控制肺癌稳步迈进” Keunchil Park, 医学博士 韩国首尔成均馆大学医学院三星医疗中心创新癌症医学研究所血液/肿瘤科 今年WCLC的口号是“携