抗EGFR治疗:实际经验与临床试验见解
决定治疗选择的因素
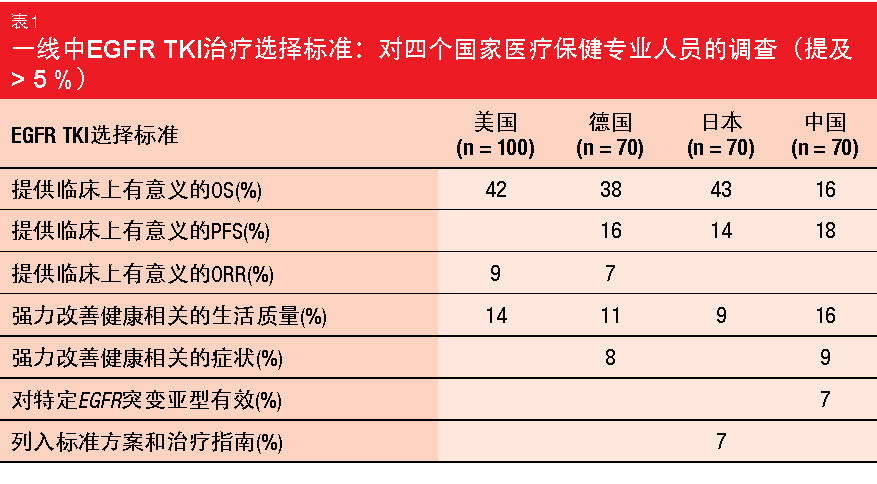
随着EGFR突变IIIB/IV期NSCLC的治疗前景在过去几年发生了显著变化,Hirsh等人评估了医生对EGFR酪氨酸激酶抑制剂(TKI)用药顺序决策的当前态度[1]。在2018年4月至5月,研究人员对310名医疗保健专业人士进行了代表性的在线调查,其中包括来自美国、德国、日本和中国的肿瘤学家、肺病学家、胸外科医师和呼吸内科专家。 不论治疗线,医生在开TKI处方时最重要的治疗目标包括增加OS,随后是改善生活质量。美国、德国和日本较为强调具有临床意义的OS,而提供具有临床意义的PFS、OS和改善与健康相关的生活质量对于中国医生似乎同等重要(表1)。一线条件下治疗结果的可预测性是影响治疗选择的另一个重要因素。就TKI的用药顺序而言,55%的参与者强烈倾向于为患者提供靶向治疗时间最大化的治疗顺序。 所有国家的医师都表达了,在改变他们当前的治疗实践之前,他们强烈需要潜在耐药性突变相关信息。36%的医疗保健专业人士一致认为他们缺少在以何种顺序使用EGFR靶向NSCLC治疗方面做出明智决策所需的全部数据。
阿法替尼(afatinib)的实际数据和在老年患者中的可行性
不可逆的ErbB家族抑制剂阿法替尼在全球多个国家被批准用于治疗EGFR突变NSCLC患者。在2018年WCLC大会上介绍的实际数据证实了阿法替尼在日常临床实践中的功效。一项在五家日本机构对128名患者进行的多中心回顾性研究显示与先前的临床试验相当甚至更好的疗效[2]。在一线和再挑战条件下,中位PFS分别为17.8和8.0个月。一线患者的中位OS为39.5个月。与没有减少剂量的患者相比,剂量减少并未降低治疗效果,甚至显著延长了PFS(18.5与7.9个月;p = 0.018)。另一项对22名患者进行的回顾性观察研究显示,中位PFS为13.1个月,ORR为86.3%,疾病控制率为95.5%[3]。在12个月时,81.8%的患者生存。 一项开放标签多中心单组II期研究将日剂量30 mg的一线阿法替尼确定为老年人的优选治疗选择[4]。在40名年龄70岁或以上的患者中观察此方案的实质活性,ORR为72.5%,疾病控制率为100%。28名患者(70%)达到部分缓解,1名患者(2.5%)发生完全缓解。PFS和OS分别为15.2和30.2个月。研究中观察到的大多数AE被评定为低等级。
RealGiDo
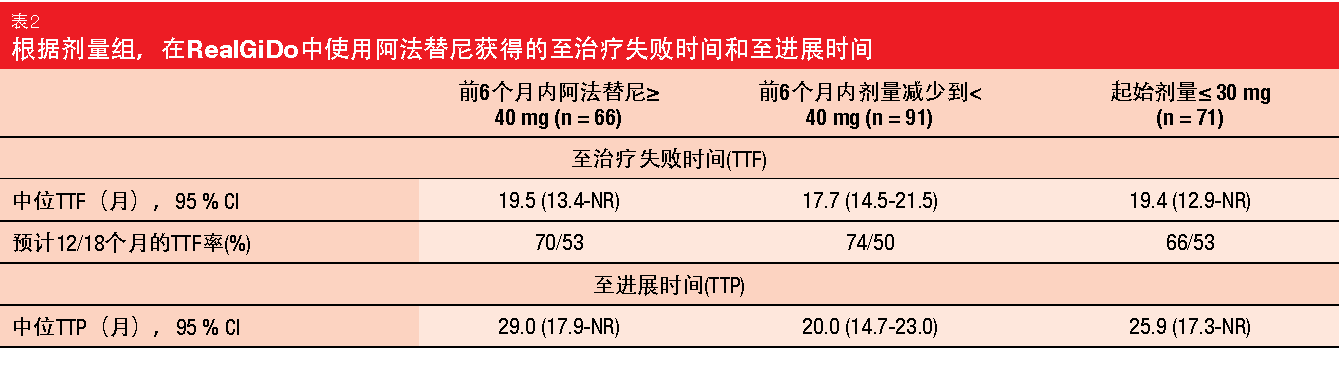
在评估EGFR突变阳性NSCLC患者中的阿法替尼的LUX-Lung临床试验中,通过使用耐受性指导的剂量调整降低了AE的发生率和严重程度,而没有降低疗效[5,6]。来自非介入性观察性RealGiDo研究的实际数据确认,阿法替尼治疗的NSCLC患者的结果可以通过根据个体患者特点和药物不良反应(ADR)对阿法替尼剂量的调整进行优化[7]。剂量调整降低了ARD的频率和强度,而不影响治疗效果。RealGiDo在全球13个国家的29个地点进行,包括228名患者。与关键的LUX-Lung 3试验[8]相比,该队列包含较多具有缺失19的患者(78%与49%)、 较少亚洲患者(44%与72%)和较高比例表现状态不佳的个体,其中12%具有ECOG PS 2-3,而LUX-Lung 3没有ECOG PS 2-3。 总体而言,78%的患者在RealGiDo过程中具有剂量修改。31%的患者接受<40 mg的起始剂量。这些患者中有20%在研究期间实施了剂量增加。ADR构成剂量修改的主要原因。与LUX-Lung 3一致,起始剂量为40 mg的患者中的大多数剂量减少发生在治疗的前6个月内。RealGiDo中,剂量减少率在数值上更高(67%,LUX-Lung 3为53%)。 然而,无论剂量减少或起始剂量修改的情况如何,阿法替尼都证明有一致的活性。至治疗失败时间(TTF)在总人群中为18.7个月,并且在有无剂量修改的组中没有显著差异(表2)。至进展时间同样如此,其在总人群中为20.8个月(表2)。在起始剂量≤ 30 mg的患者中,总体ADR发生率类似于使用起始剂量≥ 40 mg的患者,其中3级ADR较少且无4级ADR。
阿法替尼耐药机制
在接受第一代或第二代EGFR TKI治疗后进展的患者中,预计约有一半具有EGFR T790M耐药突变。对于阿法替尼来说,虽然推测耐药机制可能与第一代EGFR TKI中发现的耐药机制不同,但由于抑制的不可逆和泛HER性,仍然缺乏数据。 Nakamura等人分析了20名具有获得性阿法替尼耐药的患者,包括在EGFR TKI再挑战期间耐药的患者[9]。与第一代EGFR TKI相同,T790M突变与阿法替尼的获得性耐药相关,但频率稍低。在阿法替尼治疗开始前为T790M阴性的患者中,40 %在进展时变为阳性。3名患者出现C797S,但等位基因频率非常低。虽然在1名患者中检测到BRAF V600E突变,但未发生MET扩增。 在25名阿法替尼预先治疗的患者的前瞻性评估中,Iwama等人发现,T790M在44%的患者中被推定为耐药机制[10]。另有40%的原因不明。除了这些组之外,每组仅1名患者显示其他突变或组合异常,这些突变或组合异常在其他代EGFR TKI的条件下也有报道(即MET拷贝数增加[CNG], NRAS CNG,T790M加EGFR CNG, T790M加PIK3CA CNG加PIK3CA E545K)。
ASTRIS:日常临床实践中的奥希替尼(osimertinib)
Wu等人报告了正在进行的ASTRIS试验的第二次中期分析的结果,该试验是在EGFR T790M阳性局部晚期或转移性NSCLC中研究第三代EGFR TKI奥希替尼的最大国际化实际治疗研究[11]。在接受每日80 mg奥希替尼之前,患者已经接受过至少一次先前EGFR TKI治疗。允许无症状的稳定CNS转移。使用广泛的临床上采用的分子测试和标本对患者进行鉴别。 根据研究发现,在此实际人群中评估的奥希替尼的临床活性和安全性与在AURA临床试验计划中观察到的结果一致。在ASTRIS试验的总人群中,缓解率为56.1%,中位PFS达11.0个月。至治疗中止时间为12.6个月。OS数据在分析时尚未成熟,18个月的OS率为63.4%。 亚组分析显示,年龄≥ 75岁和< 75岁患者的疗效一致;其中PFS分别为11.8和10.9个月。此外,奥希替尼在表现状态不佳(PS 2)的患者中提供了临床获益,但该组的PFS短于PS 0或1的人群(PS 2和PS 0/1分别为6.9与11.1个月),这并不令人惊讶。此外,数据证实了奥希替尼的CNS活性。有和没有脑转移的患者的中位PFS结果分别为9.7和11.9个月。
罕见突变:奥希替尼的活性
大约10%的EGFR突变携带罕见突变,代表外显子18至21内罕见分子改变的异质群体。关于这些肿瘤对EGFR TKI治疗的敏感性数据很少[12]。 根据II期开放标签单组多中心研究,奥希替尼在具有罕见突变的NSCLC中具有活性[13]。共包括35名IV期NSCLC和激活EGFR突变的EGFR-TKI初治患者,EGFR突变不包括外显子19缺失、L858R突变、T790M突变和外显子20插入。G719X突变在该人群中最为普遍(54%),其次是L861Q(26%)和S768I(23%)。当用每日80mg奥希替尼进行治疗时,51%的患者经历客观缓解,89%发生疾病控制。中位PFS和缓解持续时间分别为8.2和9.8个月。 根据最常见的罕见突变进行的单独分析显示,与存在G719X和S768I (分别为57.9%和37.5%)相比,存在L861Q突变(77.8%)时的缓解率最高。在一些具有CNS转移的患者中也观察到了活性。9名患者在基线时具有脑部病灶。在开始奥希替尼治疗后,其中一名达到完全颅内缓解,两名具有部分缓解。奥希替尼证明有与先前报道一致的可控安全性特征。
阿法替尼不依赖于突变的影响
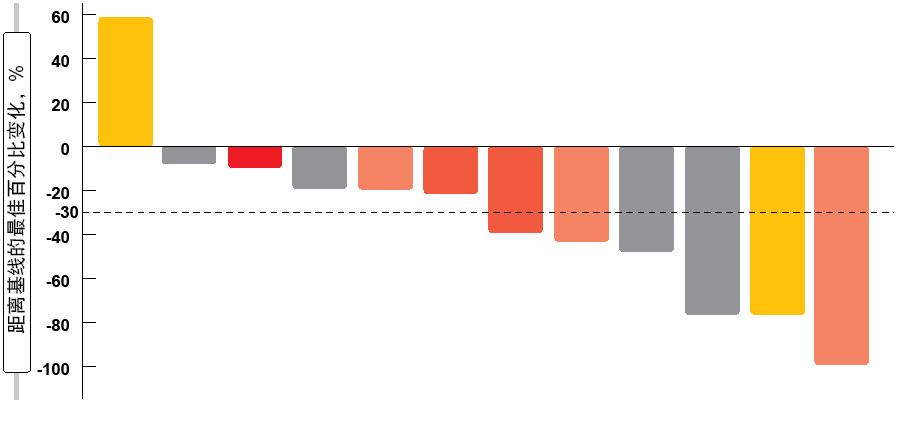
同样,从一项全球性指定患者药物使用计划获得的结果强调了阿法替尼在携带罕见突变的晚期NSCLC患者中的疗效[14]。来自10个亚洲国家的2,242名患者几乎全部接受过涉及厄洛替尼(erlotinib)或吉非替尼(gefitinib)的先前治疗线(中位数,3)。具有已知肿瘤突变状态的患者有97%为EGFR阳性。在具有特定突变的患者中,93.9%具有常见突变,而10.6%具有罕见突变(例如,外显子20插入、 G719X、L861Q、S768I、T790M)。在一些情况下,观察到多个突变。12名患者具有HER2突变但不具有EGFR突变。 总体而言,24.4%的患者对阿法替尼治疗有应答,其中77.7%达到疾病控制。阿法替尼在具有常见和罕见EGFR突变的患者中都具有显著活性(图1)。 这两组的缓解率分别为27.4%和28.1%。 根据罕见突变类型进行分析, G719X、L861Q和S768I突变患者的ORR为42.9%,EGFR外显子20插入患者的ORR为20%。HER2突变患者的缓解率为14.2%。 中位TTF在总队列中为7.6个月,在EGFR阳性组中为7.2个月。同样,具有罕见突变的患者与具有常见突变的患者至少表现相当;这两组的TTF分别为8.4和6.4个月。具有外显子20插入的患者甚至显示18.9个月的中位TTF。在HER2阳性患者群体中,中位TTF为12.2个月。
图1: 常见和罕见突变中的阿法替尼:缓解率(%)
外显子20阳性患者中的poziotinib
泛表皮生长因子受体抑制剂poziotinib被设计作为EGFR和HER2外显子20突变的有效和选择性抑制剂。由于pozitinib的大小和形状使该分子能够符合空间位阻的外显子20结合口袋,使得对这种罕见的难治突变进行靶向成为可能。 在2018年WCLC大会上介绍的一项开放标签II期试验证明,poziotinib在转移性大量预先治疗的EGFR外显子20突变NSCLC中具有明显的抗肿瘤活 性[15]。在50名患者中达到的ORR为55%,其中迄今已确认的ORR为43%。这与使用经批准的EGFR TKI和标准治疗二线药物(包括多西他赛和免疫检查点抑制剂)获得的历史ORR率相比是有利的。观察到持久的缓解。在分析时,6名患者已接受> 1年的治疗。中位PFS为5.5个月。 此外,该试验包含13名HER2外显子20突变NSCLC患者,这些患者也获得了显著获益。50%的可评估患者 (n = 12)发生初始缓解,中位PFS为5.1个月。EGFR相关的毒性证明是可控的。60%的情况下有必要进行剂量减少,但由于AE导致的中止较少,中止率为3%。一项在EGFR和HER2外显子20突变NSCLC患者中评估poziotinib的验证性国际化多中心研究正在招募当中(NCT03318939)。
联合免疫疗法的基本原理
实验数据支持EGFR靶向治疗与免疫检查点抑制剂的联合[16]。发现EGFR TKI治疗通过对免疫细胞的间接作用改变肿瘤微环境。一项I期研究在11名在 前线EGFR TKI治疗后进展的晚期EGFR突变NSCLC患者中检查了阿法替尼每日40mg联合派姆单抗(pembrolizumab)200 mg Q3W的免疫调节作 用[17]。该联合显示适度活性,其中4名患者的ORR为18%,中位PFS > 6个月。这种联合在显示临床获益的患者中诱导免疫微环境的动态变化,例如CD3阳性T细胞计数增加和肿瘤Ki-67减少。 所有部分缓解和/或PFS > 6个月的患者都经历了需要最终停用派姆单抗的免疫相关AE(irAE)。获得临床获益但发生irAE的患者具有独特的循环和肿瘤免疫细胞特征,包括CD4/CD8 T细胞比率增加以及可溶性B淋巴细胞和T淋巴细胞弱化子增加。需要更大的数据集来进一步支持这些发现。
第三代TKI lazertinib的喜人活性
有效的高突变选择性和不可逆第三代EGFR TKI lazertinib在靶向T790M突变和激活EGFR突变的同时,仍保留野生型EGFR。Lazertinib能够渗透血脑屏障。在一项开放标签多中心I/II期研究中,具有局部晚期或转移性NSCLC且对先前EGFR TKI治疗具有获得性耐药的患者接受每日一次lazertinib。Cho等人介绍了在试验中剂量递增和剂量扩增部分获得的发现;其中共包括127名患者[18]。 在剂量递增部分中,在高达320mg的剂量下仍未观察到剂量限制性毒性。最常见的AE包括瘙痒、皮疹、便秘和食欲下降。在整个剂量范围内,确认的ORR达到61%,疾病控制率为89%。对于T790M突变患者而言,ORR和疾病控制率分别为66%和93%。Lazertinib在可测量脑转移患者中也显示出活性,颅内ORR为50% (图2)。缓解持续较长时间,最长缓解持续时间超过12.5个月。在数据截止时,尚未计算中位PFS。 作者指出,lazertinib在对先前EGFR TKI治疗具有获得性耐药的患者中证明了大有前景的抗肿瘤活性。基于风险-获益特征和药代动力学,推荐的II期剂量为240 mg。一项研究一线lazertinib的全球III期临床试验将于2019年开始。
图2: : 可测量脑转移患者对lazertinib的颅内应答
参考文献
- Hirsh V et al., Oncologist treatment considerations and selection in EGFR M+ NSCLC. WCLC 2018, P3.01-108
- Tanaka H et al., Real world study of afatinib in first-line or re-challenge setting for patients with EGFR mutant non-small cell lung cancer. WCLC 2018, P3.13-22
- Liam CK et al., Real-world experience of first-line afatinib treatment in patients with EGFR mutant advanced non-small cell lung cancer. WCLC 2018, P3.15-21
- Suzuki K et al., A phase II study of afatinib treatment for elderly patients with previously untreated advanced non-small cell lung cancer harboring EGFR mutations. WCLC 2018, P1.01-92
- Yang JC et al., Effect of dose adjustment on the safety and efficacy of afatinib for EGFR mutation-positive lung adenocarcinoma: post hoc analyses of the randomized LUX-Lung 3 and 6 trials. Ann Oncol 2016; 27(11): 2103-2110
- Hirsh V et al., First-line afatinib (A) vs gefitinib (G) for patients (pts) with EGFR mutation positive (EGFRm+) NSCLC (LUX-Lung 7): Patient-reported outcomes (PROs) and impact of dose modifications on efficacy and adverse events (AEs). J Clin Oncol 2016; 34 (15_suppl): 9046-9046
- Halmos B et al., Impact of afatinib dosing on safety and effectiveness in real-world patients with EGFR mutation-positive advanced NSCLC (RealGiDo). WCLC 2018, P1.01-28
- Sequist LV et al., Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31(27): 3327-3334
- Nakamura T et al., Mechanisms of acquired resistance to afatinib clarified with liquid biopsy. WCLC 2018, P3.13-18
- Iwama E et al., A multicenter prospective biomarker study to explore mechanisms of afatinib resistance based on digital PCR and next generation sequencing. WCLC 2018, P2.13-18
- Wu YL et al., ASTRIS: A real world treatment study of osimertinib in patients with EGFR T790M mutation-positive NSCLC. WCLC 2018, MA02.03
- Beau-Faller M et al., Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol 2014; 25(1): 126-131
- Cho JH et al., An open-label, multicenter, phase II single arm trial of osimertinib in non-small-cell lung cancer patients with uncommon EGFR mutation (KCSG-LU15-09). WCLC 2018, OA10.05
- Chang GC et al., Named patient use program for afatinib in advanced NSCLC with progression on prior therapy: experience from Asian centers. WCLC 2018, P1.01-11
- Heymach JV et al., Phase II trial of poziotinib for EGFR and HER2 exon 20 mutant NSCLC. WCLC 2018, OA02.06
- Jia Y et al., EGFR-targeted therapy alters the tumor microenvironment in EGFR-driven lung tumors: rationale for combination therapies. WCLC 2018, MA27.10
- Riess JW et al., Immunomodulatory effects of afatinib and pembrolizumab in EGFR-mutant NSCLC with progression on prior EGFR TKI. WCLC 2018, P1.04-09
- Cho BC et al., Lazertinib, a third generation EGFR TKI, in patients with EGFR-TKI-resistant NSCLC: updated results of a phase I/II study. WCLC 2018, MA26.09
More posts
患者视角:评估生活质量和肺癌病耻感
患者视角:评估生活质量和肺癌病耻感 疾病负荷 虽然生活质量(QoL)评估受到患者的高度重视并构成癌症治疗评估的必要组成部分,但这些评估在日常生活和临床试验条件下得到的关注通
使用体积CT筛查显著降低肺癌死亡率:NELSON试验
使用体积CT筛查显著降低肺癌死亡率:NELSON试验 多年前,于2011年公开的大型全国肺部筛查试验证明,与胸部X线摄影相比,超过3年的每年低剂量CT筛查使肺癌死亡率相对降
访谈:新药即使在I期试验中也能产生惊人缓解
访谈:新药即使在I期试验中也能产生惊人缓解 龙浩锋,MD,中国香港中文大学临床肿瘤学系临床助理教授,I期临床试验中心医学副主任 基于目前正在进行的I期临床试验,您认为哪种
抗EGFR治疗:实际经验与临床试验见解
抗EGFR治疗:实际经验与临床试验见解 决定治疗选择的因素 随着EGFR突变IIIB/IV期NSCLC的治疗前景在过去几年发生了显著变化,Hirsh等人评估了医生对EGFR
具有罕见遗传驱动肿瘤的新兴标准
具有罕见遗传驱动肿瘤的新兴标准 一线布加替尼:ALTA-1L 在ALK阳性NSCLC的条件下,新一代药物正在取代第一代ALK抑制剂克唑替尼(crizotinib)成为一线标
PD-L1抑制剂活性和免疫治疗患者结果的决定因素相关新数据
PD-L1抑制剂活性和免疫治疗患者结果的决定因素相关新数据 PACIFIC试验中Durvalumab带来生存期提高 传统上,患有无法切除的III期非小细胞肺癌(NSCLC)