早期肺がんの範囲を広げる
ADAURA試験:アジュバント化学療法が果たす役割
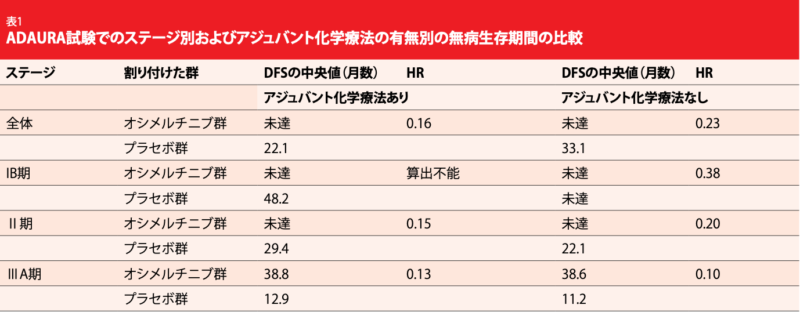
非小細胞肺がん(NSCLC)患者のおよそ30%は、診断を受けた時点で切除可能な段階にある[1~3]。この場合は根治手術が推奨療法となり、術後はⅡ期・ⅢA期の患者とIB期の一部の患者にはシスプラチンベースのアジュバント化学療法を行っているが[4~6]、アジュバント化学療法の実施状態に関わらずどのステージでも再発率は高止まりしている[7]。NSCLCを完全切除したIB期からⅢA期の患者を対象にした第Ⅲ相二重盲検ランダム化比較ADAURA試験で、第三世代のEGFRチロシンキナーゼ阻害薬(TKI)・オシメルチニブを術後に投与した群で無病生存期間(DFS)に統計学的有意かつ臨床的意義のある延長効果(HR:0.20、p<0.0001)が認められた[8、9]。 アジュバント化学療法を併用するかどうかを問わず、オシメルチニブ群(n=339)をプラセボ群(n=343)と比較したところ、両群とも患者の60%はランダム割り付けまでに化学療法を中央値にして4コース受けていた。同試験でのアジュバント化学療法の実施と治療成績に関する探索的データ解析結果を、本学会でWuらが報告した[10]。
初期のがん患者と70歳以上の患者に比べて、進行期のがん患者と70歳未満の患者で予想したとおりにアジュバント化学療法を受ける割合が全体的に増えていたが、WHOのパフォーマンスステータス(0または1)は同化学療法の実施の判断に影響していなかった。同化学療法の実施は、これまでの研究や臨床で観察してきたこととおおむね一致していた[11、12]。同化学療法を実施していてもそうでなくてもオシメルチニブ群とプラセボ群のDFSに影響することはなかった。同化学療法を受けた後の患者のリスク減少率は84%に達し(DFSの中央値はオシメルチニブ群が未達、プラセボ群が22.1か月、HR:0.16、表1)、24か月後のDFSは前者が89%、後者が49%になっている。同化学療法を受けていない患者の場合、リスク減少率は77%(前者は未達、後者は33.1か月、
HR:0.23)、24か月後のDFSは89%と58%となった。
どのステージでもオシメルチニブ群にはDFSの延長効果が一貫して認められた(表1)。同化学療法を受けた IB期の患者のサブグループはサンプルサイズが小さく、事象の発生件数も少なかったため、ハザード比を算出しなかった。 プラセボ群で同化学療法を受けなかった患者よりも受けた患者で再発率が高くなったのは、ステージが臨床転帰の予測因子になることでもわかるように、Ⅱ期・ⅢA期の患者が大分部を占めていたからだろう[4]。IB期・Ⅱ期・ⅢA期のEGFR遺伝子変異陽性NSCLC患者が術後にアジュバント化学療法を受けたかどうかに関係なく、オシメルチニブのアジュバント療法に高い有効性があることを今回の試験データが裏付けたと、著者らは結論づけた。
ADAURA試験での患者報告アウトカム
アジュバント化学療法を行う目的は臨床転帰を改善させるだけでなく、健康関連QoL(HRQoL)を維持することでもあるが、NSCLC患者に同化学療法を行ったときのHRQoLのデータはわずかしかない。ADAURA試験はアジュバント化学療法をすでに受けたか否かを問わず、NSCLCを完全切除したEGFR遺伝子変異陽性患者をEGFR TKIを用いるアジュバント療法群とプラセボ群に分けてHRQoLを評価した、初めての第Ⅲ相国際共同ランダム化比較試験である [13~17]。再発、3年後の治療完了、治療中止のうち先にそうなる時点までのHRQoLを、健康状態を測る調査表のSF-36を用いて判断した。データカットオフの時点の投与期間の中央値はオシメルチニブ群で22.5か月、プラセボ群で18.7か月となった。
本学会での発表によると、完全切除し、無病生存中の患者には同化学療法実施の有無を問わず、オシメルチニブのアジュバント療法はHRQoLに影響を及ぼしていなかった[18]。ベースラインから96週目までの身体的側面と精神的側面のサマリースコアにも健康関連のTスコア(具体的には身体機能、日常役割機能(身体)、体の痛み、全体的健康感、活力、社会生活機能、日常役割機能(精神)、心の健康)にも、両群の間に臨床的意義のある差異は認められなかった。
無病生存期間中、両群の80%を超える患者の身体的側面と精神的側面のどちらのサマリースコアにも、臨床的意義のある低下はみられなかった。スコアが低下した患者については、両群で両方のサマリースコアが低下した時期に違いはなく、健康関連のTスコアが低下した時期についても差はみられなかった。同試験ではオシメルチニブ群の投与期間が長くなったもののHRQoLは低下しておらず、今回のような患者への新しい治療法になりうる可能性をさらに強める結果となった。
イコチニブに関する中間解析結果
現在行われている第Ⅲ相オープンラベルランダム化比較EVIDENCE試験では、中国でEGFR遺伝子変異陽性NSCLCへの単独のファーストライン療法として承認を受けている第一世代のEGFR TKI・イコチニブを、アジュバント療法として評価している。Ⅱ期からⅢA期のNSCLCを完全に切除した患者をイコチニブ125 mgの1日3回投与を2年間続ける群(n=161)と、シスプラチンと組織型に応じてビノレルビンまたはペメトレキセドを併用して4コース行う化学療法群(n=161)のどちらかにランダムに割り付け、DFSを主要評価項目とした。どちらの群でもおよそ3分の2がⅡA期、同じく3分の1がⅢA期に該当したが、ⅡB期の人数は非常に限られ、約90%の患者が肺葉切除術を受けていた。
本学会で報告のあった中間解析結果によると、化学療法群に比べてイコチニブ群でDFSが統計学的有意に延長しており、リスク減少率は64%になっていた(イコチニブ群は46.95か月、化学療法は22.11か月、HR:0.36、p<0.0001)[19]。なお、この時点ではOSの結果は出ていなかった。イコチニブ群は投与期間の中央値の22.2か月後、化学療法群は同じく2.8か月後に行った安全性解析で、新たな懸念材料を見いだすことはなかった。発現率が最高になったグレード3から4の治療関連有害事象(AE)はイコチニブ群では発疹(1.9%)になり、下痢(0.6%)と皮膚乾燥(0.6%)が続き、化学療法群では好中球減少症(41.0%)、白血球減少症(19.4%)、嘔吐(12.9%)となった。なお、間質性肺疾患はどちらの群にも起きなかった。EGFR遺伝子変異陽性の初期NSCLCを完全に切除した患者には、イコチニブのアジュバント療法が新しい治療の選択肢になりうると著者らは報告の中で強調した。
ITACA試験:個別化した化学療法
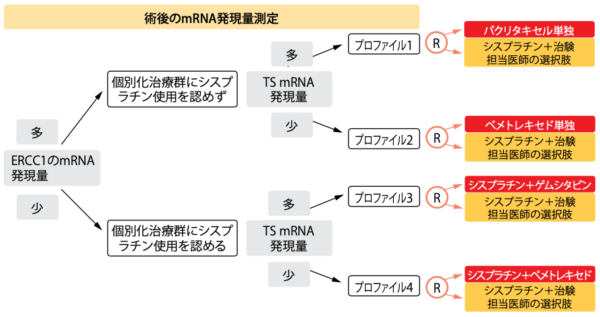
プラチナ製剤ベースのアジュバント化学療法が初期NSCLCのOSに劇的な延長効果をもたらすことはないが、この化学療法によってOSが延長する可能性のある患者と同療法が必要のない患者とを区別する必要性のあることは、はっきりしている。異なる遺伝子に発現す るmRNA量と特定の抗がん剤への 感受性や耐性との間に相関性がみ られるため[20、21]、アジュバント療 法を評価する第Ⅲ相ITACA試験では、分子マーカーのexcision repair cross complementation 1(ERCC1)およびチミジル酸合成酵素(TS)のmRNA発現量が効果予測因子になりうるか評価することを目的にした[22]。完全切除したⅡ期からⅢA期のNSCLCの検体にリアルタイムPCRを行って測定したERCC1とTSのmRNA発現量を中央評価した後に、ランダムに割り付けている。まず、ERCC1のmRNA発現量の多い群と少ない群に分け、次は各群でTSのmRNA発現量の多い群と少ない群に分けた(図1)。
最終的にmRNA発現量の多さで4群に分かれ、それぞれの患者を各治療群にランダムに割り付けた。4つの対照群の全患者にはシスプラチンと治験担当医師の選んだもう一剤を併用する、標準的な化学療法を行うことにした。ERCC1 mRNA発現量の多い被験群にはシスプラチンの使用を認めないことにして、次の段階ではERCC1 mRNA発現量の多い被験群をTS mRNA発現量の多さ別にパクリタキセル群またはペメトレキセド群に、少ない被験群を同じくゲムシタビン群またはペメトレキセド群に振り分けた。同試験に参加したのはイタリア、ドイツ、ポーランドの医療機関31施設 である。
図1:ITACA試験のデザイン:ERCC1およびTSのmRNA発現量を基準に患者を4群にランダム割り付け
試験データの検出力不足で統計学的有意差はつかず
2008年から2014年の間に患者773人をランダムに割り付けた。解析の都合上、mRNA発現量別に分けた全被験群を個別化治療群(n=344)、対照の4群を合わせた標準治療群(n=346)にまとめ直し、主要評価項目はOSとした。両群とも中央値にして4コースの治療を受けている。
腫瘍検体で測定したERCC1 mRNA発現量およびTS mRNA発現量を主な基準にしてアジュバント化学療法を個別化しても、統計学的に有意なOSの延長効果はみられなかった。ITT解析対象集団では個別化治療群の成績が良 好になる傾向があり(個別化治療群 は96.4か月、標準治療群は83.5 か月、 HR:0.76)、最終解析の時点では試験データの検出力不足となり、予測していた事象のうちのわずか46%しか起きなかった。検出力がかなり不足していたものの両群間にOSの差異は生じず、無再発生存期間についても統計学的有意差は認められなかった(前者は64.4か月、後者は41.5 か月、HR:0.94)。
一方、個別化治療群では有効性を損ねることなく治療に伴う毒性プロファイルが統計学的有意に改善しており、主な違いは血液学的有害事象にとどまった。両群間で比較した、グレード3から4の有害事象が1つ以上生じる可能性のオッズ比は0.57になった(p<0.001)。今回、検出力が不足したことを考えると、完全切除したNSCLC患者へのアジュバント化学療法を個別化するには、免疫療法の併用を問わず、より対象範囲が広く、早く結果を得られる診断技術が必要になると、著者らは最後に述べた。
Ⅲ期のEGFR遺伝子変異陽性肺がんへのEGFR TKI療法
切除不能なEGFR遺伝子変異陽性局所進行NSCLCに、EGFR TKIを早い段階で投与した場合の有効性は明確になっていない。そこで、中国にある大学付属のがんセンター12施設で治療を受けた切除不能なⅢA期・ⅢB期のNSCLC患者440人への、ファーストライン療法のパターンを後向き調査することになった[23]。化学放射線療法を並行してもしくは順番に受けた患者を1群、化学療法の実施は問わずに放射線治療とEGFR TKIを併用した患者を2群、腫瘍進行するまでEGFR TKI単独で初期治療した患者を3群とした。解析には多項傾向スコアモデルを用いた逆数を重みとする重み付け解析法(IPTW)を行って、交絡因子の影響を減らしつつ有効なサンプルサイズを最大化することにした。
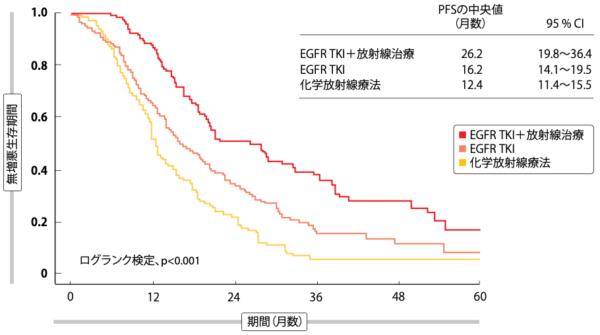
IPTW法で解析した結果、全生存期間(OS)と無増悪生存期間(PFS)に関しては、EGFR TKIと放射線治療の併用療法(化学療法の実施は問わない)に、標準治療である化学放射線療法とEGFR TKIの初期単独療法を上回る効果のあることが証明された。OSの中央値はEGFR TKIと放射線治療を併用した2群が67.4か月であるのに対して、化学放射線療法の1群が51.0か月(HR:0.61、p=0.039)、 EGFR TKIの初期単独療法の3群が49.3か月となり、PFSの中央値については2群が26.2か月、1群が12.4か月(HR:0.40、p<0.001)、3群が16.2か月となった(図2)。OSに延長効果がみられたのは、局所・領域と遠隔の転移や再発を抑制できていたからなのだろう。局所・領域での治療失敗に関しては、1群と3群に比べて2群のリスクが最も低く、リスク減少率は1群に比べて52%となった(HR:0.48、p=0.002)。遠隔転移の場合、EGFR TKIを使用した2群と3群に1群を上回る結果がみられた(HRは2群が0.62、3群が0.56、p値はそれぞ
れ=0.013と<0.001)。
今回のような併用療法の恩恵を受けられる切除不能な局所進行NSCLC患者は数多くいるだろうと、著者らは最後に語った。化学療法の併用は問わずに放射線治療とEGFR TKIの併用療法を調査する、ランダム化比較試験の実施が必要なことは間違いない。
図2:IPTW法で解析した化学放射線療法、EGFR TKI単独療法、EGFR TKI+放射線治療の併用療法ごとの無増悪生存期間
LCMC3試験:アテゾリズマブのネオアジュバント療法
切除可能なNSCLCの未治療患者(ⅠB期からⅢA期の患者は選定せず、ⅢB期の患者は選定)を対象にしたLCMC3試験で、アテゾリズマブを用いるネオアジュバント療法を評価した。術前にアテゾリズマブ2コースを行い、その後は、治験実施計画書で認めた、12か月間のアテゾリズマブのアジュバント療法もしくは、治験担当医師の判断でステージに適した治療を行うことにした。本学会ではLeeらが同試験の一次解析結果を発表した[24]。安全性解析対象集団になった患者181人のうち159人が手術を受け、合計144人が主要評価項目の対象解析集団になった。
主要評価項目の病理学的奏効(MPR、活動性のある腫瘍細胞が10%以下と定義)に合致し、その数は主要評価項目の対象解析集団の21%を占めた。このうちの7%が病理学的完全奏効の判定を受けた。アテゾリズマブのネオアジュバント療法を受けた後のダウンステージは43%、アップステージは19%になり、治験実施計画書が定めた、2コース目終了後から約10日間という短い間に88%が切除術を受けた。2コース目の終了から手術日までの中央値は22日である。大半の患者(79%)が肺葉切除術を受け、R0切除ができた患者は92%にのぼった。
周術期の罹患率も死亡率も低く、4%の患者に術中合併症が起きたものの、すべて治療により回復した。術後30日以内に突然死により1人が亡くなり、30日から90日の間に間質性肺炎により1人亡くなった。入院期間の中央値は7.5日、従前・術後の免疫関連有害事象はほとんどがグレード1あるいは2だった (表2)。
主要評価項目の探索的データ解析には、主要評価項目の対象解析集団の治療転帰を含めた。1年6か月後のDFS率は I期・Ⅱ期の患者群で79%、Ⅲ期の患者群で77%になり、OSは前者が91%、後者が87%になった。同試験で得た臨床データとバイオマーカーに関するデータの解析結果からは、MPRの判定を受けた患者にOSとDFSの延長効果が見てとれる[25]。また、病理学的奏効の良さとSTK11野生型には相関性があり、ベースライン時のがん微小環境の遺伝子変異量、活性化免疫細胞数、CD68陽性細胞数がより多いこととも相関して いた。
アテゾリズマブをプラチナ製剤ベースの化学療法に併用する療法を評価する、現在実施中の第Ⅲ相プラセボ対照IMpower030試験に、同試験がさらなる確証を与えることになった。
KEYNOTE-799試験の最新情報
切除不能なⅢ期のNSCLC患者への標準治療には、同時化学放射線療法(cCRT)と、cCRTを2コース以上受けて病勢が進行していない患者にはデュルバルマブの地固め療法があるが[26]、この患者のおよそ3分の1にデュルバルマブの地固め療法は向いていない[27、28]。そこで、ⅢA期からC期の切除不能なNSCLCの未治療患者を対象に、第Ⅱ相非ランダム化比較KEYNOTE-799試験でペムブロリズマブとcCRTの併用療法を評価することになった。扁平上皮NSCLCと非扁平上皮NSCLCの両患者で構成するコホートAには、ペムブロリズマブにパクリタキセルまたはカルボプラチンのどちらか一方(1コース)と胸部放射線治療(2~3コース)を併用し、その後はペムブロリズマブを単独投与 (4~17コース)した。もう一方のコホートBは非扁平上皮NSCLC患者だけで構成し、ペムブロリズマブにペメトレキセドまたはシスプラチンのどちらか一方(1コース)と胸部放射線治療(2~3コース)を併用して、その後はペムブロリズマブを単独投与(4~17コース)した。一時解析を行った時点のORRはコホートAが67.0%、コホートBが56.6%だった[29]。Reckらが報告したのは追跡調査を6か月間延長した後に得た試験結果である[30]。
ペムブロリズマブとcCRTの併用 療法には、期待できる抗腫瘍作用が ここでも認められた。ORRはコホートA(n=112)69.6%が、コホートBが(n=61)70.5%となり、腫瘍細胞のうちPD-L1発現陽性細胞の占める割合(1%未満とそれ以上)と組織型(非扁平上皮がんと扁平上皮がん)で分けたサブタイプでも、同じようなパーセンテージになった(表3)。どちらのコホートも奏効期間の中央値には達していなかったが、12か月以上奏効状態が続いたのはコホートAでは82.2%、コホートBでは72.1%になっていた。PFSもこれと同様にどちらのコホートも中央値まで達しておらず、12か月時点の同率は前者が67.7%、後者が65.2%だった。12か月時点のOSは前者が81.2%、後者が88.0%になり、中央値は未達となった。
ペムブロリズマブとcCRTの併用療法を受けた患者に生じた有害事象は、Ⅲ期のNSCLCへのcCRTやペムブロリズマブ単独療法に伴うものと同じ内容で [31、32]、グレード3以上の間質性肺炎の発現率はそれぞれ8.0%と7.9%だったため、cCRTに免疫療法を併用した時の発現率の範囲内に収まった[33]。
参考文献:
- Datta D, Lahiri B, Preoperative evaluation of patients undergoing lung resection surgery. Chest 2003; 123(6): 2096-2103
- Le Chevalier T, Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? Ann Oncol 2010; 21 Suppl 7: vii196-198
- Cagle PT et al., Lung cancer biomarkers: present status and future developments. Arch Pathol Lab Med 2013; 137(9): 1191-1198
- Chansky K et al., The IASLC Lung Cancer Staging Project: external validation of the revision of the TNM stage groupings in the eighth edition of the TNM classification of lung cancer. J Thorac Oncol 2017; 12(7): 1109-1121
- Kris MG et al., Adjuvant systemic therapy and adjuvant radiation therapy for stage I to IIIA completely resected non-small-cell lung cancers: American Society of Clinical Oncology/Cancer Care Ontario Clinical Practice guideline update. J Clin Oncol 2017; 35(25): 2960–2974
- Postmus PE et al., Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (suppl4): iv1-iv21
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552–3559
- Herbst RS et al., Osimertinib as adjuvant therapy in patients with stage IB–IIIA EGFR mutation positive NSCLC after complete tumor resection: ADAURA. J Clin Oncol 38: 2020 (suppl; abstr LBA5)
- Wu YL et al., Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med 2020; 383(18): 1711-1723
- Wu YL et al., Postoperative chemotherapy use and outcomes from ADAURA: osimertinib as adjuvant therapy for resected EGFR mutated NSCLC. WCLCL 2020, OA06.04
- Chouaid C et al., Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer 2018; 124: 310-316
- Buck PO et al., Treatment patterns and health resource utilization among patients diagnosed with early stage resected non-small cell lung cancer at US community oncology practices. Clin Lung Cancer 2015; 16(6): 486-495
- Zhong WZ et al., Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study. Lancet Oncol 2018; 19(1): 139-148
- Goss GD et al., Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR19 study. J Clin Oncol 2013; 31(27): 3320-3326
- Kelly K et al., Adjuvant erlotinib versus placebo in patients with stage IB-IIIA non-small-cell lung cancer (RADIANT): a randomized, double-blind, phase III trial. J Clin Oncol 2015; 33(34): 4007-4014
- Clinicaltrials.gov NCT02193282
- Clinicaltrials.gov NCT02511106
- Majem M et al., Patient-reported outcomes from ADAURA: osimertinib as adjuvant therapy in patients with resected EGFR mutated (EGFRm) NSCLC. WCLC 2020, OA06.03
- Zhou C et al., Icotinib versus chemotherapy as adjuvant treatment for stage II-IIIA EGFR-mutant NSCLC (EVIDENCE): a randomized, open-label, phase 3 study. WCLC 2020, FP14.11
- Ceppi P et al., Thymidylate synthase expression in gastroenteropancreatic and pulmonary neuroendocrine tumors. Clin Cancer Res 2008; 14(4): 1059-1064
- Joshi MB et al., High gene expression of TS1, GSTP1, and ERCC1 are risk factors for survival in patients treated with trimodality therapy for esophageal cancer. Clin Cancer Res 2005; 11(6): 2215-2221
- Novello S et al., International tailored chemotherapy adjuvant (ITACA) phase III study of pharmacogenomic-driven versus standard adjuvant chemotherapy in completely resected stage II-IIIA non-small cell lung cancer. WCLC 2020, PS01.04
- Bi N et al., Results of inverse-probability of treatment weighting (IPTW) using propensity score from REFRACT: a multi-center study investigating the treatment patterns in EGFR-mutant unresectable LA-NSCLC. WCLC 2020, OA02.06
- Lee JM et al., Surgical and clinical outcomes with neoadjuvant atezolizumab in resectable stage IB-IIIB NSCLC: LCMC3 trial primary analysis. WCLC 2020, PS01.05
- Carbone D et al., Clinical/biomarker data for neoadjuvant atezolizumab in resectable stage IB-IIIB NSCLC: primary analysis in the LCMC3 study. WCLC 2020, OA06.06
- National Comprehensive Cancer Network. Non-Small Cell Lung Cancer (Version 1.2021). https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf. 2.
- Agulnik J et al., Understanding clinical practice and survival outcomes in patients with unresectable stage III non-small-cell lung cancer in a single centre in Quebec. Curr Oncol 2020; 27(5): e459-e466
- Horinouchi H et al., Real-world outcomes of chemoradiotherapy for unresectable Stage III non-small cell lung cancer: The SOLUTION study. Cancer Med 2020; 9(18): 6597-6608
- Jabbour SK et al., Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799. J Clin Oncol 2020; 38(15 suppl): 9008
- Reck M et al., Pembrolizumab plus platinum chemotherapy and radiotherapy in unresectable, locally advanced, stage III NSCLC: KEYNOTE-799. WCLC 2020, OA02.03
- Yoon SM et al., Therapeutic management options for stage III non-small cell lung cancer. World J Clin Oncol 2017; 8(1): 1-20
- Mok TS et al., Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019; 393(10183): 1819-1830
- Peters S et al., Safety evaluation of nivolumab added concurrently to radiotherapy in a standard first line chemo-radiotherapy regimen in stage III non-small cell lung cancer-the ETOP NICOLAS trial. Lung Cancer 2019;133: 83-87
© 2020 Springer-Verlag GmbH, Impressum