免疫療法:併用療法そして発現頻度の多い遺伝子変異に関する最新データ
KEYNOTE-189試験:46.3か月間の追跡後に得た最新知見
KEYNOTE-189試験でOSおよびPFSに著しい延長効果をもたらした治療レジメンを、EGFR遺伝子・ALK遺伝子感受性変異を伴わない、Ⅳ期の非扁平上皮NSCLCへのファーストラインの標準治療として行い、評価した[1]。ペムブロリズマブ+プラチナ製剤+ペメトレキセド併用療法を最大で4コースまで行い、その後にペムブロリズマブ+ペメトレキセド併用療法を最大で31コース受けた群(n=410)を、プラセボ+プラチナ製剤+ペメトレキセド併用療法の実施後にプラセボ+ペメトレキセド併用療法を受けた群(n=206)と比較し評価した。ペムブロリズマブ併用療法群はOSとPFSの両方でリスク減少率が約50%となった(HRはOSが0.49、PFSが0.52)。追跡期間の中央値の46.3か月を過ぎた時点で得たITT解析集団の有効性・安全性に関する成績以外に、ペムブロリズマブ併用療法35コース(2年間)を終えた患者(n=56)に関する成績をGrayらが発表した[2]。
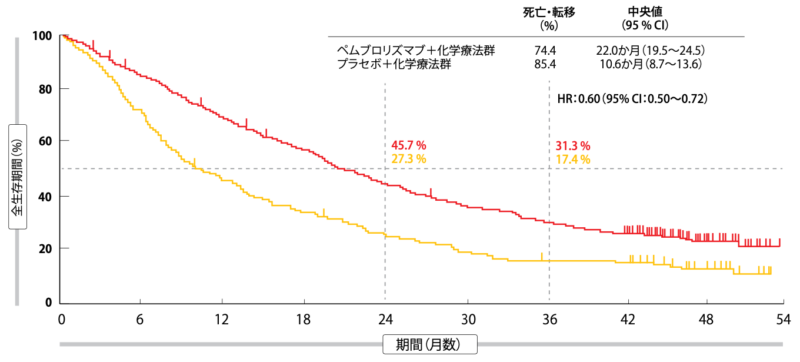
プラセボ併用療法群に比べて、ペムブロリズマブ併用療法群のOSとPFSの延長効果が続いている一方、安全性プロファイルが治療可能な内容であることがみられた。ITT解析対象集団のOSの中央値はペムブロリズマブ併用療法群が22.0か月、プラセボ併用療法群が10.6か月となったが、3年生存率は前者でほぼ2倍の伸びをみせた(前者は31.3%、後者は17.4%、HR:0.60図1)。 PFSの中央値は前者が9.0か月、後者が4.9か月(HR:0.50)、36か月時点で増悪が認められなかったのは前者が11.8%、後者群が1.3%だった。ベースライン時のPD-L1の発現量にかかわらずOSおよびPFSに延長効果がみられ、PFS2(ランダム割り付けから、セカンドライン治療中止・サードライン治療開始のどちらかが必要になるほどの病勢進行ありと治験担当医師が判断するまで、もしくはもしくは死亡するまでの期間)は17.0か月と9.0か月になっていた(HR:0.52)。ORRは前者が48.3%、後者が19.9%、奏効期間の中央値はそれぞれ12.6か月、7.1か月である。
ペムブロリズマブ35コース完遂群の治療完了時を起点にした2年生存率は79.6%、奏効率は87.5%で、完全奏効の判定を受けた患者は10.7%にのぼった。データカットオフの時点で45人(80.4%)が生存しており、そのうちの28人には病勢進行がみられなかった。
図1:KEYNOTE-189試験ではプラセボ+化学療法群よりもペムブロリズマブ+化学療法群でOSの延長効果が持続
ペムブロリズマブ+イピリムマブ併用療法:KEYNOTE-598試験
PD-L1のTPSが50%以上かつ標的遺伝子であるEGFRとALKのどちらにも変異のない、Ⅳ期のNSCLC患者にファーストライン治療として行ったペムブロリズマブ+イピリムマブ併用療法を評価したKEYNOTE-598試験からは思わしくない結果が得られた[3]。 PD-1阻害薬のニボルマブとCTLA-4阻害薬のイピリムマブを併用する免疫療法が、進行性黒色腫や腎細胞がんへの標準治療になっていることを受けて、同試験でこの併用療法を評価することになった[4、5]。 PD-1阻害薬の単独療法とPD-1阻害薬とCTLA-4阻害薬の併用療法をNSCLC患者へのファーストライン治療として、適切な検出力に設定した上で比較検討した試験データは現時点で存在していない。同試験では、ペムブロリズマブを最大で35コース、イピリムマブを最大で18コース行う被験治療群と、ペムブロリズマブにプラセボを併用する対照治療群にそれぞれ284人を割り付けた。
ペムブロリズマブにイピリムマブを併用しても、ペムブロリズマブの単独投与を上回る有効性はみられず、OS(被験治療群21.4か月、対照治療群21.9か月、HR:1.08、p=0.74 )、PFS(前者は8.2か月、後者は8.4か月、HR:1.06、p=0.72)、 ORR(両群とも45.4%)、奏効期間(前者は16.1か月、後者は17.3か月)のどれをとっても両群間に統計学的有意差は認められなかった。この試験はデータモニタリング委員会からの勧告を受けて、有益性がないという理由で中止になった。併用療法には有効性に疑問があるだけでなく単独療法を上回る毒性もみられた。結果的に、PD-L1のTPSが50%以上かつEGFRとALKのどちらの遺伝子変異も伴わないNSCLC患者へのファーストライン治療にはペムブロリズマブ単独療法を引き続き標準治療とする、と著者らは総括した。
KRAS、TP53の両遺伝子変異:免疫療法薬の有効性の予測因子
NSCLC患者から検出することが多いのが、KRASおよびTP53の両遺伝子変異である。対象患者が合計で1,129人にのぼる8つのコホート研究にLiらがメタ解析を行い、野生型のEGFR遺伝子やALK遺伝子が発現する非扁平上皮NSCLC患者への、免疫チェックポイント阻害薬の効果予測における両遺伝子変異の相互関係を調べた[6]。
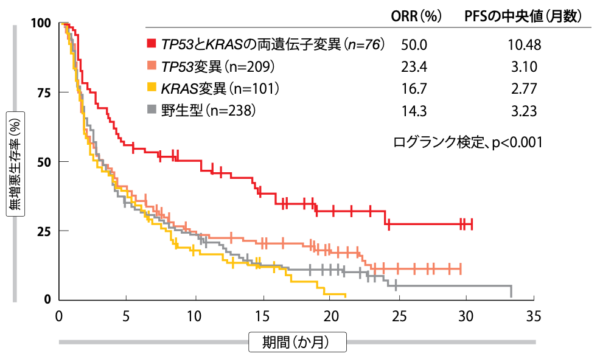
KRAS遺伝子変異が陽性の患者ではTP53変異と高いORR・PFSに相関性がみられたが、KRAS遺伝子が野生型の患者にこの相関性はみられなかった。対して、TP53遺伝子変異が陽性の患者ではKRAS変異と高いORR・PFSに相関性がみられたものの、TP53遺伝子が野生型の患者に同様な傾向はみられなかった。TP53とKRASの両遺伝子変異は、免疫療法薬によるPFSの延長効果の予測因子になったが、遺伝子変異がどちらか一方だけだとこうはならなかった(図2)。化学療法を受けた患者の場合、TP53とKRASの両遺伝子変異が陽性でもPFSへの影響はなかった。両遺伝子変異があると、遺伝子変異量、PD-L1の発現、重要性の高い臨床病理学的特性、免疫療法と関係している一部の遺伝子変異を問わず、ドセタキセルよりもアテゾリズマブで高い効果が得られるという予測因子になることが示された。
免疫チェックポイント阻害薬の効果予測については、KRASとTP53の両遺伝子変異に相互関係があると著者らは最後に強調した。以上を踏まえると、今後、免疫療法の効果予測を調査する研究者には、特に目立つ遺伝子変異同士の相互関係に注目することを勧めたい。
図2:免疫チェックポイント阻害薬を用いた治療を受けた患者の無増悪生存率と期間:TP53およびKRASの両遺伝子変異陽性群と、TP53遺伝子変異群、KRAS遺伝子変異群、野生型群との比較
EGFR遺伝子変異陽性NSCLCへのニボルマブ・イピリムマブ併用療法は効果なし
EGFR遺伝子変異陽性NSCLC患者にPD-1阻害薬を単独で投与した場合、高い臨床効果のないことが示されている[7、8]。そのため、EGFR TKIによる標準治療と化学療法を1ラインずつ失敗した、EGFR遺伝子変異を伴う進行NSCLC患者を対象に、Laiらが第Ⅱ相オープンラベルランダム化比較試験で免疫チェックポイント阻害薬の併用療法について調査した[9]。A群(n=15)にはニボルマブを単独投与し、B群(n=16)にはニボルマブとイピリムマブを併用投与して、転移が認められていても治療しているあるいは安定していれば試験に組み入れ、A群の患者は病勢が進行した段階でB群に移行できるようにした。エクソーム解析や血漿を用いたサイトカイン定量解析、それら以外のバイオマーカーも、試験の一環で調査した。
免疫チェックポイント阻害薬の併用療法に臨床的有用性が認められなかったため、同試験を続ける必要性はないとの判断に至り、31人目を組み入れたところで早期中止となった。患者全体のORRは3.2%になり、併用療法群では1人が部分奏効との判定を受け、単独療法では0人だった。各群で6人が安定の判定を受け(併用群は40.0%、単独群は37.5%)、PFSは両群でほぼ同じになった(中央値は前者が1.31か月、後者は1.22か月)。6か月時点でも部分奏効や安定が継続していている、もしくは部分奏効が最良総合効果となったため、5人に臨床的有用性ありと判定した。全患者からEGFR遺伝子のエクソン19欠失変異を検出し、1人にはT790M変異が認められた。なお、PD-L1の発現状態と免疫チェックポイント阻害薬への反応との間に相関性はみられていない。単独療法で病勢が進行したため併用療法に移行した3人の誰に、統計学的有意な効果はみられなかった。免疫チェックポイント阻害薬を使用しても安全性の問題は増しておらず、免疫関連AEの発現率もCheckMate 227試験での発現率と変わりなかった[10]。
バイオマーカー解析結果を見ると遺伝子変異量は全体的に少なく、臨床的有用性のあった患者でもそうなっていた。遺伝子発現プロファイリング試験(GEP)のスコアと免疫チェックポイント阻害薬への反応との間でも同様に、顕著な相関性は認められていない。ただ、臨床的有用性ありの判定を受けた患者の場合、ベースライン時あるいは治療開始後に“immune-hot”となっており、 骨髄由来免疫抑制細胞の個数が経時的に減少する傾向がみられた。頭蓋内病変への効果がなかったことが転帰不良になった最大の要因かもしれないと、著者らは語っている。従って、EGFR遺伝子変異陽性NSCLC患者に使用する免疫チェックポイント阻害薬を選ぶ際には、頭蓋内病変には十分な効果のないことを必ず考慮に入れる必要があるだろう。今回のような併用療法は治療の選択肢に入るかもしれないが、臨床試験でさらに調査する必要がある。
ニボルマブとMET阻害薬の併用療法
MET遺伝子のシグナル伝達経路を機能不全にすれば免疫細胞の機能を調節できる可能性があり、そうなれば抗がん免疫応答を抑制できるという根拠に基づいて、MET阻害薬のカプマチニブとPD-1阻害薬のニボルマブの併用療法を臨床試験で評価することにした[11]。マウスモデルではカプマチニブが腫瘍細胞自体のMET依存性の高さにかかわらず、免疫療法薬の有効性を高めることが認められている[12]。本学会で発表のあった第Ⅱ相国際多施設共同オープンラベル試験は、野生型のEGFR遺伝子が発現している進行NSCLC患者と同転移性NSCLC患者で、PD-1/PD-L1阻害薬による治療を受けたことがなく、標準治療後に病勢進行した患者を対象にしている[13]。
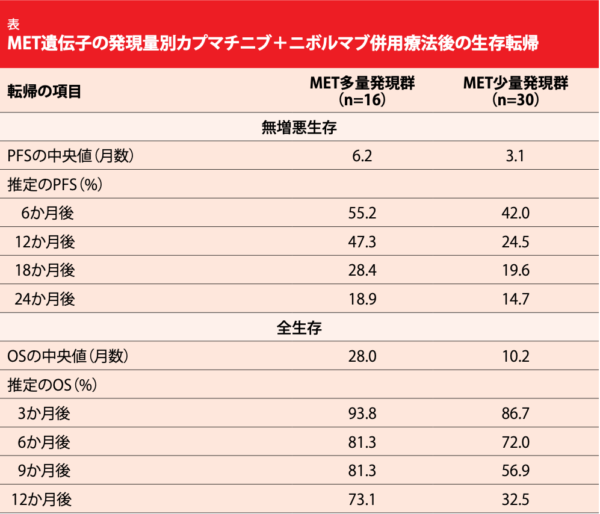
カプマチニブ400 mgの1日2回投与に、ニボルマブ3 mg/kgの2週間間隔投与を併用した。対象患者をMET遺伝子の発現量に沿って層別化したところ、16人が多量発現の基準(腫瘍細胞の50%以上がMET IHC 3+で遺伝子コピー数[GCN]は問わない、同MET IHC 2+かつGCNが5以上、METex14変異型のいずれか)を満たし、30人が少量発現の基準(METex14変異が陰性または不明かつ次のいずれか1つが該当[腫瘍細胞の50%以上がMET IHC 2+かつGCNが5未満、腫瘍細胞の50%未満がMET IHC 2+でGCNは問わない、IHC 0または1+でGCNは問わない])を満たしたことがわかった。6か月後のPFSの中央値を主要評価項目として、MET遺伝子の多量発現群は追跡期間の中央値の22.9か月後、少量発現群は同30.4か月後の成績をFelipらが発表した[13]。
初めの報告では、カプマチニブ+ニボルマブ併用療法の臨床活性が多量発現群と少量発現群の双方に認められている。ORRは前者が25.0%、後者が16.7%、病勢コントロール率はそれぞれ81.3%と40.0%、奏効期間の中央値は22.89か月と24.99か月だった。両群で腫瘍径が縮小しており、PFSの中央値は6.2か月、後者が3.1か月になり、6か月時点の同率は55.2%と42.0%となった (表)。OSの中央値は28.0か月と10.2か月で、12か月時点で前者の73.1%、後者の32.5%が生存していた。同試験のサンプルサイズが小さかったとはいえ、併用療法を受けた多量発現群の主要評価項目の数値が少量発現群のそれを上回り、95%信頼区間が重複していたと著者らは述べている。
カプマチニブ+ニボルマブ併用療法の安全性プロファイルも治療可能な内容で、グレード3から4の治療関連AEはアミラーゼ値上昇(15.2%)、リパーゼ値上昇(10.9%)が上位を占め、次いで嘔吐(8.7%)、悪心、無力症、末梢性浮腫(各6.5%)となった。同AEにより投与中止 になったのは前者が39.1%、後者の19.6%、用量調節もしくは休薬が必要になったのは80.4%と60.9%、AEの発現により他の治療が必要になったのは93.5%と58.7%にのぼった。
抗血管新生薬との併用療法
化学療法薬を使用しない、抗PD-1抗体薬のシンチリマブと抗血管新生療法に用いるマルチキナーゼ阻害薬のアンロチニブの併用療法を、ⅢB期・Ⅳ期でドライバー遺伝子変異のないNSCLCの未治療患者を対象にした第I相試験で評価した。一時解析ではPD-L1の発現状態に関わらずORRに有望な結果がみられている[14]。優れた有効性と良好な忍容性が示された主要評価項目に関する最終解析結果をHanらが報告した[15]。 全体で患者の72.7%(n=22)が治療に反応し、病勢コントロール率は100%に達した。解析の時点では奏効期間の中央値に達しておらず、PFSの中央値は15か月で、OSに関するデータは出揃っていなかった。12か月後に生存していた患者は95.5%で、無増悪生存率は71.4%だった。
遺伝子変異量、PD-L1の発現状態、組織型を問わず、奏効そして無増悪生存を認め、追跡期間がたつに連れて併用療法を受けている患者に予期せぬ毒性が現れることはなかった。新薬を用いた今回の併用療法は、組織型やPD-L1の発現状態に左右されることなく、幅広いタイプのNSCLC患者に効果をもたらす可能性があると、著者らは強調した。現在、第Ⅱ相ランダム化比較試験で同併用療法をさらに調査しているところである(NCT04124731)。
長期生存者に発症する長期的な有害事象
Ⅲ期・Ⅳ期のNSCLCで、PD-1/PD-L1阻害薬による免疫療法の開始から1年超生存した患者に関する後向き研究結果を、Hsuらが発表した[16]。特定したのは2009年11月から2020年2月までの間に治療を受けた317人で、このうちの114人(36%)の生存期間が1年を超えていた。そのおよそ半数は65歳以上で、喫煙者と禁煙者が占める割合は80%を超えた。組織型で最も多かったのは腺がんで66%にのぼり、61%のPD-L1の発現量は不明、21%の同発現量は50%を上回り、投与回数の中央値は13回(範囲は1~121回)となった。3分の2の患者は単独療法を、3分の1の患者は併用療法を受けていた。
長期生存者の59人(52%)に免疫関連AE(irAE)が発現し、呼吸器系(間質性肺炎)と皮膚系(皮膚炎、そう痒、乾癬)の発現が上位を占め、内分泌系(甲状腺機能低下症、甲状腺炎、下垂体炎、1型糖尿病、疲労)、リウマチ系(炎症性関節炎、乾燥症候群、口内乾燥、ドライアイ、肋軟骨炎)、消化器系(大腸炎、下痢、肝炎、膵炎)のAEが続いた。このうちの39人にはirAEが1つ生じただけだったが、20人には複数のAEが生じ、多臓器でのirAEで特に多く生じたのは皮膚炎を伴う間質性肺炎(n=4)、炎症性関節炎(n=3)、乾燥症候群(n=2)だった。単臓器のirAEが発現するまでの期間の中央値は22週間、多臓器の場合は9週間となっている。長期生存者59人のうちの31人(27%)には、治療開始後1年たってもirAEの治療管理が必要だったと著者らは語った。免疫チェックポイント阻害薬を治療に用いたNSCLC患者は、AEの長期治療管理が必要になる患者と言えるだろう。
参考文献:
- Gandhi L et al., Pembrolizumab plus chemotherapy in metastatic non-small-cell lung cancer. N Engl J Med 2018; 387(22): 2078-2092
- Gray JE et al., Pembrolizumab + pemetrexed-platinum for metastatic NSCLC: 4-year follow-up from KEYNOTE-189. WCLC 2020, PF13.02
- Boyer M et al., Pembrolizumab plus ipilimumab vs pembrolizumab plus placebo as 1L therapy for metastatic NSCLC of PD-L1 TPS ≥ 50 %: KEYNOTE-598. WCLC 2020, PS01.09
- Larkin J et al., Combined nivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373(1): 23-34
- Motzer RJ et al., Nivolumab plus ipilimumab versus sunitinib in advanced renal-cell carcinoma. N Engl J Med 2018; 378: 1277-1290
- Li X et al., Interdependence of KRAS and TP53 mutations in predicting ICI efficacy in EGFR/ALKWT non-squamous NSCLC: results from 1,129 patient-level data. WCLC 2020, OA07.06
- Lisberg A et al., A phase II study of pembrolizumab in EGFR-mutant, PD-L1+, tyrosine kinase inhibitor naïve patients with advanced NSCLC. J Thorac Oncol 2018; 13(8): 1138-1145
- Gainor J et al., EGFR mutations and ALK rearrangements are associated with low response rates to PD-1 pathway blockade in non-small cell lung cancer: a retrospective analysis. Clin Cancer Res 2016; 22(18): 4585-4593
- Lai GGY et al., Randomised phase 2 study of nivolumab versus nivolumab and ipilimumab combination in EGFRmutant NSCLC. WCLC 2020, OA01.06
- Hellmann MD et al., Nivolumab plus ipilimumab in advanced non-small-cell lung cancer. N Engl J Med 2019; 381(21): 2020-2031
- Papaccio F et al., HGF/MET and the immune system: relevance for cancer immunotherapy. Int J Mol Sci 2018; 19(11): 3595
- Glodde N et al., Reactive neutrophil responses dependent on the receptor tyrosine kinase c-MET limit cancer immunotherapy. Immunity 2017; 47(4): 789-802.e9
- Felip E et al., Efficacy and safety of capmatinib plus nivolumab in pretreated patients with EGFR wild-type non-small cell lung cancer. WCLC 2020, FP76.03
- Han BH et al., Efficacy and safety of sintilimab with anlotinib as first-line therapy for advanced non-small cell lung cancer. WCLC 2019, JCSE01.11
- Han B et al., Sintilimab in combination with anlotinib as first-line therapy for advanced NSCLC: final analysis of primary endpoints. WCLC 2020, OA07.09
- Hsu M et al., Survivors from anti-PD-(L)1 immunotherapy in NSCLC: clinical features, survival outcomes and long-term toxicities. WCLC 2020, MA07.05
© 2020 Springer-Verlag GmbH, Impressum
More posts
再発悪性中皮腫患者への新しい治療選択肢・ニボルマブ
再発悪性中皮腫患者への新しい治療選択肢・ニボルマブ 再発悪性中皮腫患者のOSの改善効果を示した第Ⅲ相ランダム化比較試験は最近まで存在していなかった[1、2]。
肺がん検診:普段の検診や研究室にとっての課題
肺がん検診:普段の検診や研究室にとっての課題 Luis M. Montuenga, PhD, Centro de Investigaci溶 M仕ica A
免疫療法:併用療法そして発現頻度の多い遺伝子変異に関する最新データ
免疫療法:併用療法そして発現頻度の多い遺伝子変異に関する最新データ KEYNOTE-189試験:46.3か月間の追跡後に得た最新知見 KEYNOTE-189試
小細胞肺がんに関する最新知見
小細胞肺がんに関する最新知見 ルルビネクテジンとイリノテカンの併用療法 小細胞肺がん(SCLC)は転写因子に依存する悪性腫瘍であることがわかっているので、新規
抗体薬物複合体:可能性が広がりゆく時代が始まる
抗体薬物複合体:可能性が広がりゆく時代が始まる Alexander Spira, MD, PhD, US Oncology Research, Virgi
EGFR遺伝子変異陽性NSCLCに特化した治療薬
EGFR遺伝子変異陽性NSCLCに特化した治療薬 エクソン20挿入変異を伴う肺がん:モボセルチニブを評価する第I相および第Ⅱ相の試験データ EGFRエクソン2