EGFR遺伝子変異陽性NSCLCに特化した治療薬
エクソン20挿入変異を伴う肺がん:モボセルチニブを評価する第I相および第Ⅱ相の試験データ
EGFRエクソン20挿入遺伝子変異は、EGFR遺伝子変異陽性NSCLC患者のおよそ5~12%、NSCLC全体で見れば2%から検出されている[1、2]。エクソン20挿入遺伝子変異はL858R点突然変異、エクソン19欠失変異に次いで3番目に多く検出されているが[1、3]、同変異を伴う肺がんの治療にEGFR TKIは使えない。TKIに結合するEGFRの部位の構造が立体的になるため、EGFR TKIに感受性を示さなくなるのがその理由である[4]。同変異陽性肺がんを適応症にする分子標的薬で承認を受けたものはいまだになく、第一世代と第二世代のEGFR TKIも化学療法も奏効率は10%から15%程度で、PFSの中央値は3か月から5か月にとどまっている[5~10]。
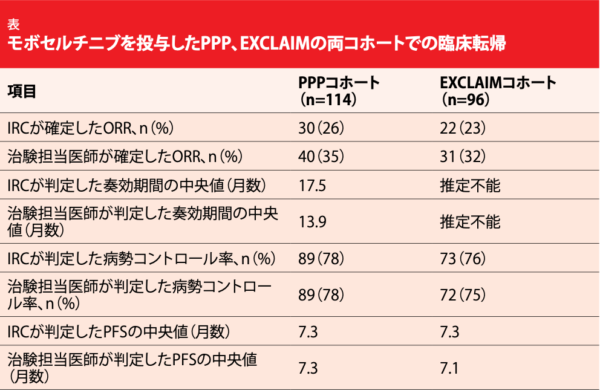
モボセルチニブ(TAK-788)はエクソン20挿入遺伝子変異肺がんを標的にした、強力な作用を持つ画期的な経口EGFR TKIである。米国および中国では第I相・第Ⅱ相試験の暫定的な成績に基づいて、化学療法がうまくいかなかった同変異陽性のNSCLC患者への治療薬としてブレークスルーセラピー指定を受けた[11]。第I相・第Ⅱ相試験と延長試験で対象になった患者コホート(EXCLAIMコホート)に含まれるプラチナ製剤の前治療歴のある患者コホート(PPPコホート)から選び出した、転移性NSCLS患者およびEGFRエクソン20挿入遺伝子変異陽性患者に関する知見をZhouらが 報告した[12]。PPPコホートは114人、 EXCLAIMコホートは96人である。
改善した状態が持続
どちらのコホートにもモボセルチニブは臨床的意義のある効果を示した。独立評価委員会(IRC)が判定したPPPコホートのORRは26%、奏効期間の中央値は17.5か月になり(表)、PFSの中央値は7.3か月になった。EXCLAIMコホートではORRは23%、PFSの中央値は7.3か月となり、奏効期間の中央値の時期には至っていなかった。両コホートの評価に関してIRCと治験担当医師の間で数字上の違いがみられたが、病勢コントロール率とPFSが似通っていたことから、臨床的有用性の程度についてはどちらの評価もほぼ同じであることが示唆さ れた。
PPPコホートでは78%、EXCLAIMコホートでは84%の奏効期間が6か月を超え、データカットオフの時点で奏効状態が続いていたのはどちらのコホートでも50%を超えていた。標的病変のベースラインからの最大縮小率は前者が82%、 後者が80%になり、規定した全サブグループ(具体的にはアジア人群とそれ以外の人種群、以前の治療が免疫療法群とEGFR TKI群、ベースライン時の脳転移がある群とない群)で確定したモボセルチニブの奏効率はほぼ同等だ った。
安全性プロファイルについてはEGFR TKIの既知のプロファイルと一致しており、治療関連の二大有害事象は下痢と発疹で、グレード3から4の下痢が認められたのは前者で21%、後者で16%になった。悪心と下痢が投与中止の二大原因になり、AE全体による投与中止率は前者で17%、後者で10%、減量が前者の25%に、後者の21%に必要になった。PPPコホートの1人に治療関連死が生じたが死因は心不全だった。
症状スコアも解析対象になっている。EXCLAIMコホートではモボセルチニブが2コース目以降、肺がんの中心的症状に臨床的意義のある改善をもたらし(EORTC QLQ-LC13調査票の症状スコアが10点以上低下)、その状態が投与期間終了まで続いた。臨床的意義のある変化が呼吸困難(EXCLAIMコホートの54.4%)、咳嗽(44.4%)、胸痛(37.8%)で顕著になった。
アミバンタマブの優れた有効性
エクソン20挿入遺伝子変異陽性のNSCLC患者への治療薬として、米国と中国でブレークスルーセラピー指定を受けたもう一つの治療薬が、EGFR遺伝子の活性化変異や耐性変異だけでなくMET遺伝子の変異と増幅を標的にした二重特異性抗体のアミバンタマブである[13、14]。CHRYSALIS試験の成績を 受けて、第Ⅱ相試験のアミバンタマブ の推奨用量は体重80 kg未満は1,050 mg、80 kg以上は1,400 mgとなった。プラチナ製剤ベースの化学療法を受けた後に病勢が進行した、EGFRエクソン20挿入遺伝子変異陽性の転移性NSCLC患者および切除不能NSCLS患者を対象に、同試験の用量拡大期に安全性と有効性を調べた。臨床カットオフまでに最低でも判定を3回受けた患者で構成する有効性評価群(n=81)と、第Ⅱ相試験の推奨用量が投与された患者で構成する安全性評価群(n=114)に関する知見をSabariらが報告した[15]。有効性評価群がこれまでに受けた治療ラインの中央値は2ラインで、EGFR-TKI療法を受けたのは25%、免疫療法を受けたのは46%だった。
IRCの盲検下での判定によるとアミバンタマブのORRは40%となり、優れた有効性を示した。臨床的有用率(完全奏効、部分奏効、安定のいずれかの判定が2つ以上)は74%、奏効期間の中央値は11.1か月、データカットオフ時点で患者の47%が治療を続けていて、PFSの中央値は8.3か月、OSの中央値は22.8か月になった。抗腫瘍作用がすべてのサブグループとエクソン20のそれぞれの挿入部位(ヘリカル領域、ループ領域近傍、ループ領域から離れた領域)に認められた。 エクソン20挿入遺伝子変異を伴うNSCLC患者向けの既存の治療薬に比べても、アミバンタマブの有効性は引けを取らなかった[16]。
また、安全性プロファイルも良好で、EGFR TKIやMET阻害薬のそれと変わりなかった。治療関連の二大有害事象は発疹と注入に伴う反応だったが、発疹が原因で投与中止になったのはわずか2%にとどまり、注入に伴う反応がみられたのは大半が初回投与時で、投与中止に至るようなことはめったになかった。グレード3以上のTEAEが発現したのは16%、投与中止に至ったのは4%だった。以上の成績を受けて、現在、アミバンタマブと別の薬剤クラスの治療薬との併用療法の評価が行われている。
PCRでは50%が検出失敗に
エクソン20挿入遺伝子変異陽性のNSCLC患者に適応する新薬の開発が進んでいるが、分子が不均一なエクソン20挿入変異を確実に同定する重要性がますます増している。とりわけ行うことが多いのはポリメラーゼ連鎖反応法(PCR)と次世代シーケンシング(NGS)であるが、PCRで未検出になるケースが多いことをBaumlらが指摘している[17]。そこで、米国のNSCLC患者に協力してもらい、EGFRのエクソン20挿入変異の種類全般を同定する能力がPCRとNGSにどの程度あるのかを評価することにして、実臨床関連のデータベースであるAACR Project Genomics Evidence Neoplasia Information ExchangeとFoundationInsightの2種類を分析 した。
両データベースを分析した結果、NGSでエクソン20挿入変異を検出した患者のおよそ半数が、PCRでは検出できていないことが判明した。NGSが幅広い種類のエクソン20挿入変異を検出したことから(40~102)、大学や民間企業の次世代シーケンサーを利用すれば同変異の種類が明らかになり、検出率の改善につながると思われる。
HER3を標的にする抗体薬物複合体のパトリツマブデルクステカン
80%を超えるEGFR遺伝子陽性NSCLCを含めて大半の肺がんにはHER3が発現しているが、これが有望な治療標的になりうる。HER3の過剰発現と臨床転帰の悪さとの間には相関性があるものの [18~20]、承認を受けたHER3阻害薬はいまだに存在しない。HER3を標的にする抗体薬物複合体の被験薬であるパトリツマブデルクステカンは、HER3 IgG1モノクローナル抗体にペイロードのポイソメラーゼI阻害薬を結合させたものである。EGFR遺伝子変異陽性の転移性NSCLC患者および切除不能なNSCLC患者を対象にした、国際共同多施設オープンラベル第Ⅰ相試験で評価中である。
オシメルチニブの治療後に進行した患者か、エルロチニブ・ゲフィチニブ・アファチニブのいずれかの治療後に進行したがT790M変異が陰性だった患者のどちらかが、この試験の用量漸増期の対象になった。用量拡大期の推奨用量・用法は5.6 mg/kgを3週間ごとに静注することとなった。この用量拡大期の対象になった患者を3つのコホートに分け、コホート1に割り当てた患者のデータを解析した結果をYuらが発表した[21]。コホート1はEGFR TKIとプラチナ製剤ベースの化学療法の前治療歴がそれぞれ1ライン以上あった。
2020年4月30日時点で、用量漸増期と用量拡大期の両コホート57人にパトリツマブデルクステカン5.6 mg/kgを投与し、このうち56人の奏効状態が判定可能だった。進行NSCLC、転移性NSCLCの各患者の前治療歴の中央値は4ラインで、47%にCNSへの転移があった。
耐性変異の有無を問わない早期の有効性
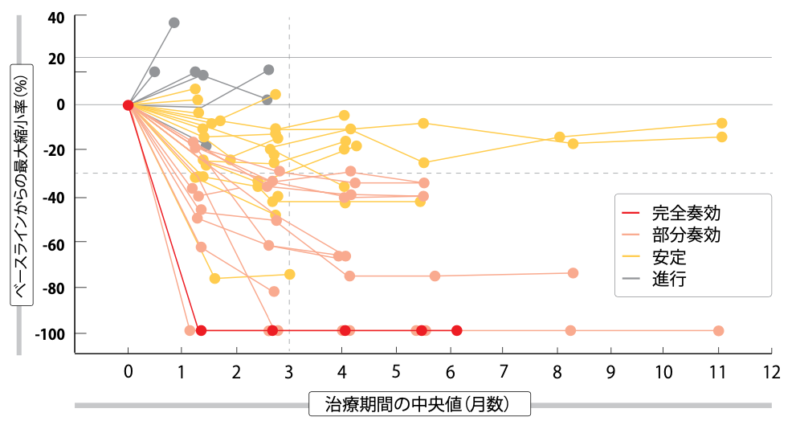
EGFR遺伝子変異陽性NSCLCでさまざまなTKIの耐性変異があり、前治療歴の多いコホートに、パトリツマブデルクステカン5.6 mg/kgが臨床的に意義のある抗腫瘍作用を示したことが、追跡期間の中央値の5か月後にわかった。この耐性変異は、EGFR C797S変異、MET遺伝子増幅、HER2 遺伝子変異、BRAF融合遺伝子、PIK3CA遺伝子変異などである。全体的にみると患者の25%に奏効し、7病勢コントロール率が70%になったが、解析の時点で3例の部分奏効が確定しておらず、6人が一度しか奏効判定を受けていなかった。なお1人(2%)が完全奏効の判定を受けている。投与開始から3か月以内に腫瘍が縮小しており(図1)、奏効期間の中央値は6.9か月だった。
パトリツマブデルクステカンの安全性プロファイルを見る限り治療可能な内容で、グレード3以上のTEAEの発現率が最高レベルになったのは血小板減少症と好中球減少症で、9%がTEAEにより投与中止になった。IRCは間質性肺疾患の3例(5.3%)をTEAEと判定した。なお、グレード5のAEは発現していない。著者らが要旨の中で述べたように、今回の試験成績全体が、該当する分子標的薬のない患者へのパトリツマブデルクステカンの使用を臨床試験でさらに調べる必要性を裏付けることになった。EGFR TKIあるいはプラチナ製剤ベースの化学療法がうまくいかなかった患者を対象に、パトリツマブデルクステカン単剤療法について調査する第Ⅱ相HERTHENA-Lung01試験(NCT04619004)の被験者を募集中である。
図1:パトリツマブデルクステカン:腫瘍径の経時的変化(n=49)
フロントライン治療に用いたメファチニブの優れた阻害作用
変異EGFR遺伝子に不可逆的に結合する第二世代のEGFR TKIであるメファチニブ(Mefatinib)は、EGFRやHER2が過剰発現するEGFR遺伝子変異やKRAS遺伝子変異を伴う肺がんだけでなく、同じ過剰発現がある別のがん種にも阻害作用を示す。ⅢB期・Ⅳ期のEGFR遺伝子変異陽性NSCLC患者106人を対象にした第Ⅱ相オープンラベルランダム化比較試験で、メファチニブ60 mgと80 mgを1日1回経口投与した場合の有効性と安全性を評価した[22]。解析結果によると全体のORRは84.9%という高さで、用量別では60 mg群が80.4%、80 mg群が89.1%、全体の病勢コントロール率は97.2%となり、PFSの中央値は全体で16.3か月、OSの中央値は26.6か月になった。忍容性も良く、全グレードを通して主なAEは下痢(94.3%)そして発疹(86.8%)で、グレード3以上のAEでは下痢(19.8%)、発疹(17%)、口腔内潰瘍(4.7%)、口内炎(4.7%)の順になった。
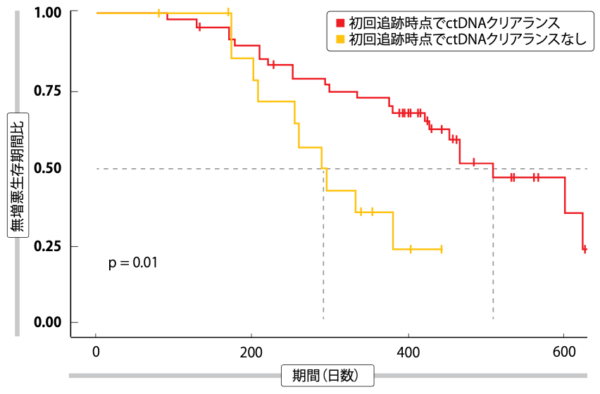
今回の試験では、メファチニブの耐性を獲得する予測因子になりうるバイオマーカーと、その分子機構を突き止めることも目的にした。遺伝子パネル検査で168種類の肺がん関連遺伝子がいずれも検出されなければ、血中循環腫瘍DNA(ctDNA)クリアランスと定めた。投与開始から6週間後の初めての追跡時点でctDNAクリアランスになった患者のPFS(p=0.01、図2)およびOS(p=0.005)は、遺伝子変異を検出した患者のそれに比べて統計学的有意に長くなり、データカットオフの時点で38人の病勢が進行していた。今回、メファチニブの耐性獲得に最も多く関わっていたのがEGFR T790M遺伝子変異(42.1%)だった。 この遺伝子変異が陽性の3人の患者 には耐性遺伝子が共発現しており、 BRAFV600Eミスセンス変異(n=2)とMET遺伝子増幅(n=1)を検出したが、18人(48%)からは既知の耐性遺伝子は検出しなかった。
図2:メファチニブ投与開始後初めての追跡調査時点でのctDNAクリアランスと無増悪生存期間の相関性
ORCHARD試験
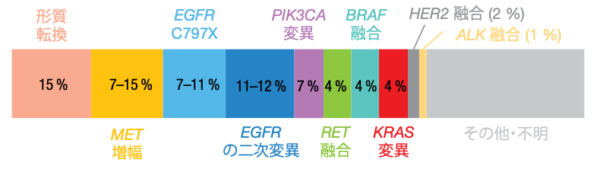
第三世代のEGFR TKIであるオシメルチニブを、EGFR遺伝子変異陽性NSCLC患者へのファーストライン治療に用いたところ良好な結果がみられたが、ほとんどの患者が耐性を獲得した。次の治療ラインで耐性機序に応じた治療ができれば、標準治療の細胞傷害性化学療法に代わる個別化治療が可能になるかもしれない。オシメルチニブをファーストラインで使用する際の耐性機序として今のところ見受けられるものは多い順に、小細胞肺がんへの形質転換(15%)、MET遺伝子増幅(7~15%)、 EGFR C797Xの発現(7~11%)、EGFR遺伝子の二次変異(11~12%)である(図3)[23、24]。
現在進行中の第Ⅱ相ORCHARDプラットフォーム試験では、オシメルチニブのファーストライン治療後に病勢が進行し、遺伝子変異を検出したEGFR遺伝子変異陽性進行NSCLCを対象に、バイオマーカーを指標にした治療を評価している[25]。 また、遺伝子変異が陰性になった患者を対象に新規の療法についても評価している。2019年6月から被験者の募集を始め、2023年11月に試験終了を予定している。
図3:オシメルチニブを用いるファーストライン治療を受けた患者が獲得した主な耐性機序
RET融合遺伝子:オシメルチニブとセルペルカチニブの併用療法
ファーストラインのオシメルチニブに耐性を獲得している患者の約5%から、RET融合遺伝子を検出している[26]。そこで、Rotowらが、RET融合遺伝子変異が生じてオシメルチニブの耐性を獲得したEGFR遺伝子変異陽性NSCLC患者に、オシメルチニブと選択的RET阻害薬 のセルペルカチニブを併用した際の臨床的奏効の特徴を系統的に分析した[27]。多施設拡大アクセスプログラムでセルペルカチニブを使用した全施設から11人のデータを収集した。
この11人にオシメルチニブ+セルペルカチニブ併用療法は活性を示し、ORRは50%、病勢コントロール率は80%となり、病勢が進行したのは1人に限られた。治療が奏効した患者では、治療期間の中央値は11か月になった。同併用療法の忍容性はおおむね良好で、発現した有害事象の内容も、両薬剤に既知のものと一致していた。グレード2の間質性肺炎により1人が投与中止になり、各薬剤の減量がそれぞれ1人に必要になった。グレードの3のTEAEは高血圧、QT延長、好中球減少症、白血球減少症などで、重篤なAEを除いて正式な有害事象報告は任意とした。
同併用療法に生じた耐性遺伝子変異は一貫しておらず、TKIの単独療法にみられるものとほぼ同じで、EGFR C797SやRET G810Sに起きた第二変異などだった。現在、ORCHARD試験で、 RET融合遺伝子変異が生じたEGFR 遺伝子変異陽性NSCLC患者を対象 に、同併用療法を前向きに評価中で ある[25]。
EGFR G724S変異陽性肺がんへのアファチニブ使用
EGFR遺伝子エクソン18のG724Sはまれにしかみられない変異で、第三世代のEGFR TKIの耐性獲得に関与しているが、アファチニブといった第二世代のEGFR TKIへの感受性はある[28、29]。肺がん患者42,316人分のデータベースから抽出したデータをもとに、ZhaoらがG724S変異を伴うNSCLC患者へのアファチニブの有効性と安全性を調査した[30]。生存分析を23人に行い、EGFRとその他の遺伝子の同時変異の分析を52人に行った。その結果、EGFR遺伝子のエクソン19欠失変異の同時変異が75%にのぼり、E746_S752 delinsVと いう非常に珍しいバリアントとの同 時変異が最も多く(55%)、エクソン20 との同時変異は15%であることが 判明した。EGFR G724S変異はE746_S752delinsVと同時に発現することが多かったが、EGFR遺伝子エクソン20変異と同時に発現するG724Sの方が一次変異である可能性が高いと、著者らは結論づけた。
アファチニブによる治療を受けたG724S変異陽性患者全員(n=8)が安定の判定を受けたため、病勢コントロール率は100%になった。アファチニブ以外の治療を受けた患者(n=15)と比べると、PFSは統計学的有意に長くなった(アファチニブ群は4.5か月、その他の治療群は1.7か月、HR:0.33、p=0.04)。オシメルチニブの治療後に進行した患者のサブセットでは、アファチニブ群(n=5)のPFSがその他の治療群(n=8)のそれを上回った(前者は6.2か月、後者は1.0か月、HR:0.04、p=0.006)。アファチニブ単独療法はEGFR G724S変異陽性NSCLC患者への治療の選択肢になりうると、著者らは語った。オシメルチニブの治療を受けた2人にEGFR T790M変異がアファチニブへの主な耐性機序として再度生じたが、アファチニブを用いたファーストライン治療を受けた1人にMET遺伝子増幅が関与する耐性が認められている。
ファーストラインやセカンドラインで使用するEGFR TKIとオシメルチニブの比較
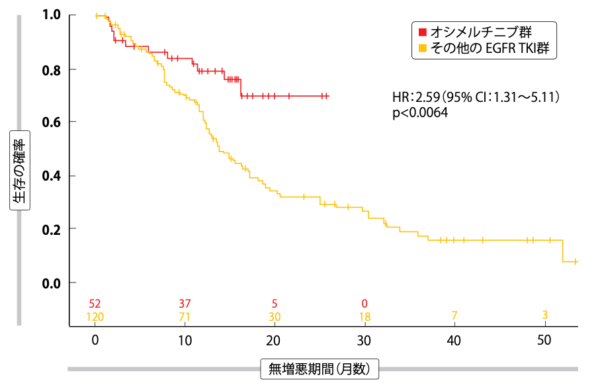
FLAURA試験でEGFR遺伝子陽性進行NSCLC患者へのファーストライン治療にオシメルチニブを用いたところ、第一世代のEGFR TKIに比べてPFSにもOSにも延長効果がみられている[31]。2014年から2019年の間に米国で第一世代・第二世代のEGFR TKIをファーストライン治療に用いた患者と、オシメルチニブを用いた患者の転帰を、多施設共同後ろ向き臨床研究で評価した[32]。全体で172人が対象になり、そのうちオシメルチニブ療法を受けたのが52人(30.2%)に対して、アファチニブ(n=25、 14.5%)、ゲフィチニブ(n=1、0.6%)、エルロチニブ(n=94、54.7%)のいずれかの療法を受けたのは120人(69.8%)だった。
解析の際には二群にまとめ直した(オシメルチニブ群とその他のEGFR TKI群)。ベースライン時の両群の患者背景はどちらもほぼ同じだったが、その他のEGFR TKI群の総ビリルビン値が高い点だけが異なっていた。12か月と18か月時点のPFSは、その他のEGFR TKI群に比べてオシメルチニブ群に延長効果が認められたが(HR:2.59、p<0.0064、 図4)、OSには統計学的有意差が認められなかった(HR:0.95、p<0.9128)。著者らが述べるように、オシメルチニブのOSの延長効果が実臨床でも現れるのかを明確にするためにも、さらに臨床試験を重ね、追跡調査期間も長くとる必要がある。
図4:オシメルチニブとその他のEGFR TKIをEGFR遺伝子変異陽性NSCLC患者へのファーストライン治療に使用した場合の実臨床での無増悪生存期間
参考文献:
- Riess JW et al., Diverse EGFR exon 20 insertions and co-occurring molecular alterations identified by comprehensive genomic profiling of NSCLC. J Thorac Oncol 2018; 13(10): 1560-1568
- Fang W et al., EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer. BMC Cancer 2019; 19(1): 595
- Vyse S, Huang PH, Targeting EGFR exon 20 insertion mutations in non-small cell lung cancer. Signal Transduct Target Ther 2019; 4: 5
- Robichaux JP et al., Mechanisms and clinical activity of an EGFR and HER2 exon 20-selective kinase inhibitor in non-small cell lung cancer. Nat Med 2018: 24(5): 638-646
- Yasuda H et al., Structural, biochemical, and clinical characterization of epidermal growth factor receptor (EGFR) exon 20 insertion mutations in lung cancer. Sci Transl Med 2013; 5(216): 216ra177
- Beau-Faller M et al., Rare EGFR exon 18 and exon 20 mutations in non-small-cell lung cancer on 10 117 patients: a multicentre observational study by the French ERMETIC-IFCT network. Ann Oncol 2014; 25(1): 126-131
- Yang JCH et al., Clinical activity of afatinib in patients with advanced non-small-cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6. Lancet Oncol 2015; 16(7): 830-838
- Udagawa H et al., Clinical outcome of non-small cell lung cancer with EGFR/HER2 exon 20 insertions identified in the LC-SCRUM Japan. J Thorac Oncol 2019; 14(10 suppl): S224 [abstract OA07.03]
- Hanna N et al., Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22(9): 1589-1597
- Kim ES et al., Gefitinib versus docetaxel in previously treated non-small-cell lung cancer (INTEREST): a randomised phase III trial. Lancet 2008; 372(9652): 1809-1818
- Neal J et al., Safety, PK, and preliminary antitumor activity of the oral EGFR/HER2 exon 20 inhibitor TAK-788 in NSCLC. J Thorac Oncol 2018; 13(10): S599
- Zhou C et al., Mobocertinib in NSCLC with EGFR exon 20 insertions: results from EXCLAIM and platinum pretreated patient populations. WCLC 2020, OA04.03
- Haura EB et al., JNJ-61186372 (JNJ-372), an EGFR-cMet bispecific antibody, in EGFR-driven advanced non-small cell lung cancer (NSCLC). J Clin Oncol 37, 2019 (suppl; abstr 9009)
- Park K et al., Amivantamab (JNJ-61186372), an anti-EGFR-MET bispecific antibody, in patients with EGFR exon 20 insertion (exon20ins)-mutated non-small cell lung cancer (NSCLC). J Clin Oncol 38: 2020 (suppl; abstr 9512)
- Sabari JK et al., Amivantamab in post-platinum EGFR exon 20 insertion mutant non-small cell lung cancer. WCLC 2020, OA04.04
- Girard N et al., Comparative clinical outcomes for patients with NSCLC harboring EGFR exon 20 insertion mutations and common EGFR mutations. WCLC 2020, MA04.07
- Bauml JM et al., Underdiagnosis of EGFR exon 20 insertion mutation variants: estimates from NGS-based real-world datasets. WCLCL 2020, FP07.12
- Tan CS et al., Third generation EGFR TKIs: current data and future directions. Mol Cancer 2018; 17(1): 29
- Scharpenseel H et al., EGFR and HER3 expression in circulating tumor cells and tumor tissue from non-small cell lung cancer patients. Sci Rep 2019: 9(1): 7406
- Yi ES et al., High c-erbB-3 protein expression is associated with shorter survival in advanced non-small cell lung carcinomas. Mod Pathol 1997: 10(2): 142-148
- Yu HA et al., Efficacy and safety of the novel HER3 directed antibody drug conjugate patritumab deruxtecan (HER3-DXd; US-1402) in EGFR-mutated NSCLC. WCLC 2020, OA03.04
- Wang P et al., Phase II study of the efficacy of the EGFR inhibitor mefatinib in patients with advanced EGFR-mutant NSCLC. WCLC 2020, P76.28
- Ramalingam SS et al., Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol 2018; 36(9): 841-849
- Schoenfeld AJ et al., Tumor analyses reveal squamous transformation and pff-target alterations as early resistance mechanisms to first-line osimertinib in EGFR-mutant lung cancer. Clin Cancer Res 2020; 26(11): 2654-2663
- Cho BC et al., ORCHARD: A biomarker-directed phase 2 platform study in patients with advanced EGFRm NSCLC progressing on first-line osimertinib. WCLC 2020 P76.27
- Leonetti A et al., Resistance mechanisms to osimertinib in EGFR-mutated non-small cell lung cancer. Br J Cancer 2019; 121(9):725-737
- Rotow J et al., Combination osimertinib plus selpercatinib for EGFR-mutant non-small cell lung cancer with acquired RET fusions. WCLC 2020, FP14.07
- Fang W et al., Emergence of EGFR G724S After Progression on Osimertinib Responded to Afatinib Monotherapy. J Thorac Oncol 2020; 15(3): e36-e37
- Oztan A et al., Emergence of EGFR G724S mutation in EGFR-mutant lung adenocarcinoma post progression on osimertinib. Lung Cancer 2017; 111: 84-87
- Zhao H et al., Afatinib as a potential therapeutic option for non-small cell lung cancer patients with EGFR G724S. WCLC 2020, P76.38
- Ramalingam SS et al., Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med 2020; 382:41-50
- Lee CS et al., A comparison of sequential EGFR-TKI therapy versus first-line osimertinib in NSCLC: a multi-center, retrospective study. WCLC 2020, P76.09
© 2020 Springer-Verlag GmbH, Impressum