KRAS・HER2・ALKの各遺伝子の阻害薬と使用する治療ラインの問題点
ソトラシブの効果の高さ: CodeBreak 100試験
KRAS p.G12C変異は肺がん患者の約13%に生じるがん関連の主要な遺伝子変異で[1]、転帰不良の一因にもなっている。極めて選択性が高いKRASG12Cの画期的な不可逆的阻害薬であるソトラシブが、第Ⅰ相CodeBreaK 100試験に参加した、前治療歴の多いNSCLC患者コホート59人にしっかりとした臨床的有用性を示した[2]。本学会では、申請のもとになる第Ⅱ相オープンラベル単群試験の対象になったNSCLC患者コホートに関する成績をLiらが発表した [3]。標準治療後に進行の判定を受けた、KRAS p.G12C変異陽性の局所進行性NSCLC患者と転移性NSCLC患者が11か国から合計で126人参加して、病勢が進行するまでソトラシブ960 mgを1日1回経口投与された。なお、ほぼ全員が喫煙者もしくは禁煙者である。全身化学療法を1ライン受けたことのある患者は42.9%、2ライン受けたことのある患者は34.9%、3ライン受けたことのある患者は22.2%となり、プラチナ製剤ベースの化学療法後とPD-1/PD-L1阻害薬による治療後に進行した患者が81%にもなった。主要評価項目は奏効率(ORR)とした。
中央値にして12.2か月間の追跡後に確定したORRは37.1%、完全奏効の判定を受けたのは2.4%、部分奏効は34.7%で、病勢コントロール率は80.6%だった。81%には程度を問わず腫瘍縮小効果がみられ、奏効の判定を受けた患者の最良腫瘍縮小効果の中央値は60%になった。また、ソトラシブを投与した患者は早い段階で奏効に至り、それが続くことも認められている。奏効に至るまでの期間の中央値は1.4か月、奏効期間の中央値は10.0か月である。奏効した患者の43%はデータカットオフの時点で投与を続けていて、病勢の進行もなく、無増悪生存期間の中央値は6.8か月と推定した。
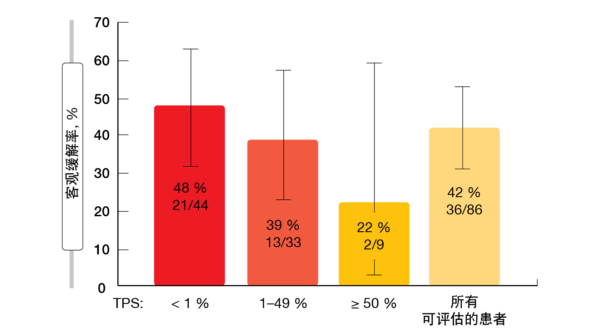
治療関連有害事象は総体的に軽 度で治療も可能なもので、グレード3から4の有害事象の発現率は低くなっていた(グレード3は19.8%、グレード4は0.8%)。7.1%に投与中止が必要になり、22.2%に用量調節が必要になった。発現率が最高レベルだった有害事象は下痢と悪心のほか、ALTとASTの上昇だった。CodeBreaK 100試験で行ったバイオマーカーの探索的データ解析結果によると、PD-L1発現量が少ない患者や発現していない患者ほどソトラシブに反応しており(図1)、 STK11遺伝子やKEAP1遺伝子の変異は関係していなかった。ソトラシブをセカンドライン治 療のドセタキセルと比較検討する 第Ⅲ相CodeBreaK 200試験(検証的試験)の被験者を現在募集している(NCT04303780)。
図1:PD-L1発現量別ソトラシブの奏効率
DESTINY-Lung01試験
HER2の体細胞変異が認められる種類のがんは比較的限られている[4]。前臨床動物モデルに体細胞変異のサブセットがみられると、キナーゼシグナル伝達の構成要素、発がん性形質転換、腫瘍細胞増殖の強化につながっていた[5]。多施設共同第Ⅱ相オープンラベルDESTINY-Lung01試験は、標準治療後に再発したあるいは耐性のある、HER2遺伝子変異陽性で切除不能の非扁平上皮NSCLC患者と同じく転移性非扁平上皮NSCLC患者を対象に、新規の抗体薬物複合体のトラスツズマブデルクステカン(T-DXd)を評価するようデザインしている。この試験のコホート1にはHER2過剰発現のある患者(n=49)を、コホート2にはHER2活性化変異のある患者(n=42)を割り付け、両コホートにT-DXd 6.4 mg/kgを3週間ごとに投与した。本学会では中川らがコホート1に関する中間解析結果を発表した[6]。
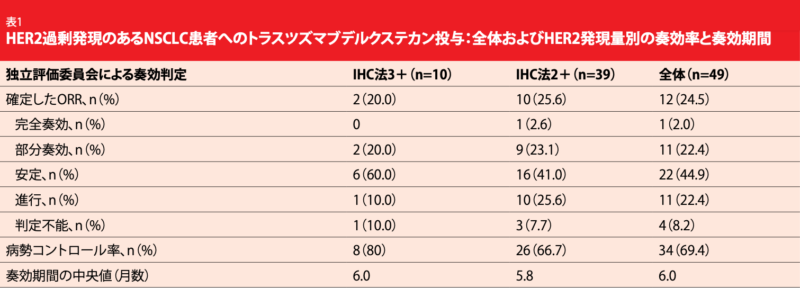
中央値にして3ラインもの前治療歴があり、HER2過剰発現のある患者で構成したこのコホートからは、T-DXdに抗腫瘍作用があるエビデンスが示された。全体のORRは24.5%になったがHER2の発現量によって差が生じることはみられず、IHC法が3+の患者のORRは20.0%、同2+の患者は25.6%だった (表)。1人がCRの判定を受け(2.0%)、病勢コントロール率は69.4%になった。奏効期間の中央値は6.0か月で、PFSの中央値は5.4か月、OSの中央値は11.3か月になった。
安全性の問題になる間質性肺疾患
安全性プロファイルについては、これまでの臨床試験で認められた内容とおおむね一致していた[7~11]。治療関連有害事象(TEAE)により減量が必要になったのは32.7%、投与中止が必要になったのは12.2%である。グレード3以上のTEAEで最も発現率の高かったのは好中球数減少(20.4%)で、これが減量 や休薬の主な理由になっていた(各10.2%)。8人に間質性肺疾患(ILD)が生じ(16.3%)、4.1%にグレード1、6.1%にグレード2、6.1%にグレード5のILDが認められたが、ILDに関して死亡の報告があった3人のうち1人の死因は間質性肺炎だった。治療関連のILDが発症するまでの期間の中央値は全体で64.5日である。8人全員の投与が中止になり、グレード2と5のILDが生じたそれぞれの患者はステロイドで治療した。この試験で期待の持てる有効性が示されたことが、HER2過剰発現のあるNSCLC患者に対するT-DXdの評価を続ける動機になると、著者らは結論の中でこう語った。試験が進むにつれてさらに他のデータも集まるので、試験中はILDが発症しないか慎重にモニタリングを続け、発症すれば積極的に治療していくことになる。
HER2活性化変異のある進行NSCLC患者42人で構成するコホート2に関するデータを、Smitらが報告した[12]。コホート2のORRは61.9%、病勢コントロール率は90.5%で、解析の時点では奏効期間の中央値に達しておらず、しっかりとした効果のあることが証明され、PFSの中央値は14.0か月だった。コホート1と同様に、安全性プロファイルも先の報告とおおむね一致していて、グレードの高いILDは発生しなかった。HER2活性化変異のあるNSCLCには高いアンメットニーズがあるが、T-DXdが新しい治療薬になりうることがデータで示されたと著者らは語っている。コホート2の患者へのT-DXdの特徴をさらに調べ、現在実施中の同試験を継続できるように、このタイプの患者を新たに50人組み入れることになった。
ネラチニブの単独療法と併用療法
経口の不可逆的チロシンキナーゼ阻害薬であるネラチニブは、EGFR、HER2、 HER4の各遺伝子を標的にしている [13]。HER2遺伝子のさまざまな変異とそれが陽性のがんに幅広く臨床活性を示していて、感受性は組織型と変異 の両方のコンテクストに依存している [14]。国際共同第Ⅱ相試験の2試験が、HER2遺伝子変異陽性肺がん患者へのネラチニブの臨床活性を評価している。PUMA-NER-4201試験では、ⅢB期・Ⅳ期のHER2遺伝子変異陽性NSCLC患者の、未治療患者および前治療歴のある患者を、ネラチニブ240 mg/日を単独投与する群(n=17)または、これにmTOR阻害薬のテムシロリムス8 mg/週を併用投与する群(n=43)にランダムに割り付けて比較検討した。オープンラベルのSUMMITバスケット試験(PUMA-NER-5201試験)には、治療法が存在していないHER2 遺伝子変異陽性肺がん患者の一連のオープンラベルコホートを組み入れ、ネラチニブを単独で投与(n=26)もしくは、最初はトラスツズマブを8 mg/kgを、 その後は3週間ごとに6 mg/kgを併 用投与(n=52)した。どちらの試験で もHER2遺伝子変異で最も多くみられたのは、エクソン20の小さなインフレー ム挿入変異である(PUMA-NER-4201試験では95%、SUMMIT試験では 67%)。Liらが両試験の成績を発表し た[15]。
解析結果によると、HER2遺伝子 変異陽性NSCLCへのネラチニブ単独療法の臨床活性は限定的で、ORRは4201試験の単独療法群では0%、SUMMIT試験では4%となった。テムシロリムスとの併用群とトラスツズマブとの併用群ではこの数値が上昇し、それぞれ14%と8%になった。前治療歴のある患者のサブセットではしっかりとした効果がみられ、奏効期間はテムシロリムス併用群が22.6か月、トラスツズマブ併用群が18.3か月になり、OSの中央値はテムシロリムス併用群で最も長く、15.1か月に及んだ。
最も発現率の高かったAEは下痢で、グレードを問わず全患者コホートの80%超に生じた。グレード3以上の下痢が40%近く生じたとの報告があったが、減量や投与中止が必要になることはごくまれにしかなかった。下痢以外のAEは悪心、嘔吐、便秘、疲労などだった。HER2遺伝子変異陽性NSCLC患者に行える、ネラチニブに別のHER2阻害薬を併用する新しい療法を検討中だと著者らは語った。
ARIA試験
ALK TKIの耐性を獲得するメカニズムがわかれば、ALK融合遺伝子変異陽性NSCLC患者への次の治療薬が選びやすくなるかもしれない。そこで、リキッドバイオプシー検体に含まれる薬剤耐性遺伝子変異のある血中循環腫瘍DNA(ctDNA)をもとに、次世代のALK TKIの臨床活性をARIA試験で調査した[16]。解析対象になったのは、ヨーロッパの9施設のALK融合遺伝子変異陽性進行NSCLC患者58人で、いずれも第一世代や第二世代のALK TKI療法を受けたことがある。ブリガチニブまたはロルラチニブの投与を始める直前にリキッドバイオプシーに用いる検体を採取し、遺伝子変異の状態によって次の3通りにグループ分けをして両薬剤の活性を評価した。
- ctDNAのALK遺伝子変異陽性(遺伝子変異が1つ:単一、同2つ以上:複合)
- ALK遺伝子以外の遺伝子変異陽性
- 検出可能な遺伝子変異なし
解析対象の58人のうち16人がブリガチニブ療法を、42人がロルラチニブ療法を受けていた。この両サブグループのうち前者は94%、後者は74%がそれ以前にクリゾチニブ療法を受けていて、第二世代のALK TKI療法を受けたことのある患者はそれぞれ69%と98%に上った。ほとんどの患者に3つ以上の転移巣があり、前者では88%、後者では71%に頭蓋内病変が認められている。
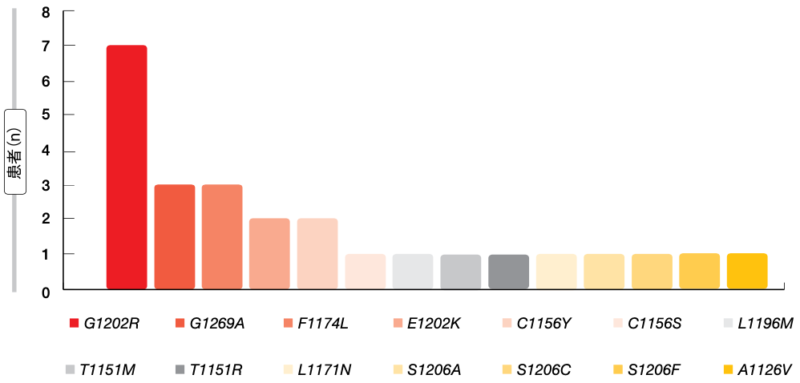
ALK遺伝子変異が陽性になったのは全体で16人(28%)になり、そのうち9人は単一、7人は複合で、その他の遺伝子変異が陽性になったのは17%、遺伝子変異が陰性になったのは55%だった。ALK遺伝子変異は多岐にわたり、最も多く検出したのはG1202R変異、次いでG1269A変異、F1174L変異となった (図2)。検体ごとに変異を1つから6つ検出したが、ALK遺伝子変異が陽性になった16人のうち5人にはアレクチニブの前治療歴があり、これとは別の5人にセリチニブ、6人にブリガチニブの前治療歴があった。
図2:リキッドバイオプシーで同定したALK遺伝子変異のサブタイプ
耐性獲得に関わるALK遺伝子変異別の成績
3群のいずれにも、後に行ったロルラチニブは臨床活性を示した。PFSの中央値はALK遺伝子変異陽性群(n=13、6.5か月)、その他の遺伝子変異陽性群 (n=7、7.6か月)、遺伝子変異陰性群(n=22、7.3か月)で大差はなく、ORRはそれぞれ46%、71%、23%に、CNS病変のORRは56%、60%、67%になった。OSの中央値は順番に62.6か月、45.0か月、未達となっている。
一方、ALK遺伝子変異陽性群へのブリガチニブの効果は振るわなかったが、この群の患者は3人にしかおらず、この人数は一般的にみても少なすぎるため、同群に関する成績は限定的になってしまう。同群のPFSの中央値3.5か月だったのに対して、その他の遺伝子変異陽性群(n=3)では6.2か月、遺伝子変異陰性群(n=10)では8.1か月になり、ORRはそれぞれ0%、67%、22%に、CNS病変のORRは0、%、100%、50%になった。OSの中央値は38.4か月、62.6か月、未達である。 最近は第二世代のALK TKIを初期治療に用いるので、ctDNAが次の治療を決める際のバイオマーカーになりうるのかを確認する目的で今回と同様な試験を行う必要があると、著者らは試験成績を総括する中でこう強調した。
参考文献:
- Biernacka A et al., The potential utility of re-mining results of somatic mutation testing: KRAS status in lung adenocarcinoma. Cancer Genet 2016; 209(5): 195-198
- Hong DS et al., KRASG12C inhibition with sotorasib in advanced solid tumors. N Engl J Med 2020; 383: 1207-1217
- Li BT et al., CodeBreaK 100: registrational phase 2 trial of sotorasib in KRAS p.G12C mutated non-small cell lung cancer. WCLC 2020, PS01.07
- Cousin S et al., Targeting ERBB2 mutations in solid tumors: biological and clinical implications. J Hematol Oncol 2018; 11(1): 86
- Bose R et al., Activating HER2 mutations in HER2 gene amplification negative breast cancer. Cancer Discov 2013; 3(2): 224-237
- Nakagawa K et al., Trastuzumab deruxtecan in HER2-overexpressing metastatic non-small cell lung cancer (NSCLC): interim results of DESTINY-Lung01. WCLC 2020, OA04.05
- Tsurutani J et al., Targeting HER2 with trastuzumab deruxtecan: a dose-expansion, phase I study in multiple advanced solid tumors. Cancer Discov 2020; 10(5): 688-701
- Tamura K et al., Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive breast cancer previously treated with trastuzumab emtansine: a dose-expansion, phase 1 study. Lancet Oncol 2019; 20(6): 816-826
- Modi S et al., Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med 2020; 382(7): 610-621
- Modi S et al., Antitumor activity and safety of trastuzumab deruxtecan in patients with HER2-low-expressing advanced breast cancer: results from a phase Ib study. J Clin Oncol 2020; 38(17): 1887-1896
- Shitara K et al., Trastuzumab deruxtecan (DS-8201a) in patients with advanced HER2-positive gastric cancer: a dose-expansion, phase 1 study. Lancet Oncol 2019; 20(6): 827-836
- Smit EF et al., Trastuzumab deruxtecan in HER2-mutated metastatic non-small cell lung cancer (NSCLC): interim results of DESTINY-Lung01. WCLC 2020, MA11.03
- Wissner A & Mansour TS, The development of HKI-272 and related compounds for the treatment of cancer. Arch Pharm Chem Life Sci 2008; 341(8): 465-477
- Hyman DM et al., HER kinase inhibition in patients with HER2- and HER3-mutant cancers. Nature 2018; 554(7691):189-194
- Li BT et al., Neratinib-based combination therapy in HER2-mutant lung adenocarcinomas: findings from two international phase 2 studies. WCLC 2020, FP14.15
- Mezquita L et al., The ARIA study: Activity of next-generation ALK TKIs based on ALK Resistance mutations detected by liquid biopsy in ALK positive NSCLC patients. WCLC 2020, P84.01
© 2020 Springer-Verlag GmbH, Impressum
More posts
再発悪性中皮腫患者への新しい治療選択肢・ニボルマブ
再発悪性中皮腫患者への新しい治療選択肢・ニボルマブ 再発悪性中皮腫患者のOSの改善効果を示した第Ⅲ相ランダム化比較試験は最近まで存在していなかった[1、2]。
肺がん検診:普段の検診や研究室にとっての課題
肺がん検診:普段の検診や研究室にとっての課題 Luis M. Montuenga, PhD, Centro de Investigaci溶 M仕ica A
免疫療法:併用療法そして発現頻度の多い遺伝子変異に関する最新データ
免疫療法:併用療法そして発現頻度の多い遺伝子変異に関する最新データ KEYNOTE-189試験:46.3か月間の追跡後に得た最新知見 KEYNOTE-189試
小細胞肺がんに関する最新知見
小細胞肺がんに関する最新知見 ルルビネクテジンとイリノテカンの併用療法 小細胞肺がん(SCLC)は転写因子に依存する悪性腫瘍であることがわかっているので、新規
抗体薬物複合体:可能性が広がりゆく時代が始まる
抗体薬物複合体:可能性が広がりゆく時代が始まる Alexander Spira, MD, PhD, US Oncology Research, Virgi
EGFR遺伝子変異陽性NSCLCに特化した治療薬
EGFR遺伝子変異陽性NSCLCに特化した治療薬 エクソン20挿入変異を伴う肺がん:モボセルチニブを評価する第I相および第Ⅱ相の試験データ EGFRエクソン2