推动早期肺癌领域的发展
ADAURA:辅助化疗的作用
约30%的非小细胞肺癌(NSCLC)患者在诊断时存在可切除的疾病[1-3]。此时推荐的方法是根治性手术,然后在II/IIIA期和选定的IB期病例中予以基于顺铂的辅助化疗[4-6]。但是,尽管术后采用化疗,各个疾病阶段的复发率仍然很高[7]。一项随机化、双盲、III期ADAURA研究显示,在完全切除的IB-IIIA期EGFR突变型NSCLC患者中,在辅以第三代EGFR酪氨酸激酶抑制剂(TKI)奥西替尼(osimertinib)的情况下,无病生存期(DFS)在统计学上高度显著且具有临床意义的改善(HR,0.20;p <0.0001)[8, 9]。在有或没有同时使用辅助化疗的情况下比较了奥西替尼(n = 339)与安慰剂(n = 343)。在两个治疗组中,随机分组前60%的患者接受了中位数4个周期的化疗。在WCLC 2020上,Wu等人报告了关于辅助化疗使用和ADAURA中观察到的结果的探索性分析[10]。
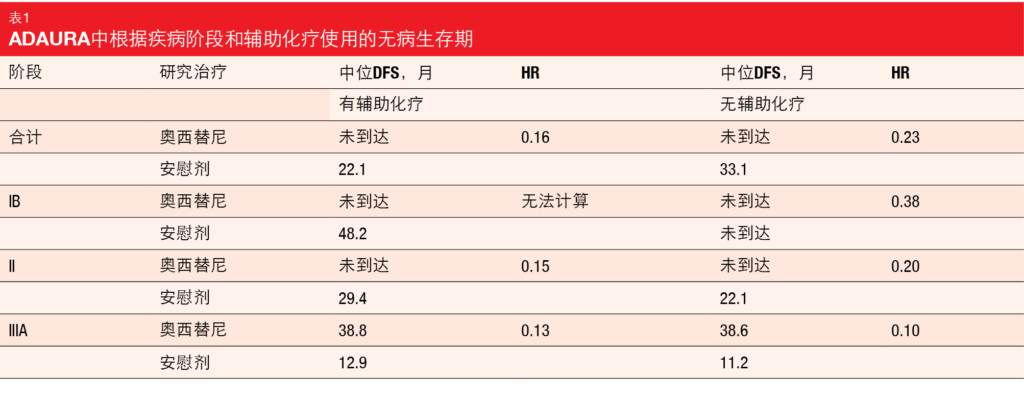
正如预期的那样,与较早期的疾病阶段和较高的年龄相比,较晚期的疾病和较小的年龄(<70岁)通常与辅助化疗的使用增加有关,而WHO表现状态(0或1)并未影响治疗决策。总体而言,化疗的使用与先前研究和临床实践的观察结果一致[11, 12]。奥西替尼与安慰剂相比,DFS获益与是否经化疗无关。辅助化疗后患者的风险降低了84%(中位DFS,未达到与22.1个月;HR,0.16;表1);24个月DFS率为89%与49%。对于未辅助化疗的患者,风险降低为77%(未达到与33.1个月;HR,0.23),24个月DFS率为89%与58%。
奥西替尼在疾病各个阶段持续改善DFS(表1)。在接受化疗的IB期疾病患者亚组中,由于样本量小且事件数少,因此无法计算风险比。与未接受辅助化疗的安慰剂治疗患者相比,接受辅助化疗的安慰剂治疗患者中观察到的较高复发率更高极有可能是因为II/IIIA期疾病患者比例较高,毕竟疾病阶段是临床结果的预后因素[4]。作者得出结论认为,这些数据支持奥西替尼在有或无辅助化疗情况下作为 IB/II/IIIA期EGFR突变型NSCLC患者的高效治疗。
ADAURA中患者报告的结果
辅助治疗的重要目标是改善疗效,同时维持与健康相关的生活质量(HRQoL)。迄今为止,辅助NSCLC条件下的HRQoL数据有限。ADAURA是首个针对EGFR突变型NSCLC切除患者的全球、随机化、III期试验,旨在评估在有或没有先前辅助化疗的情况下,与安慰剂相比,辅助EGFR TKI治疗的HRQoL结果[13-17]。使用健康状况调查表SF-36来衡量HRQoL,直到疾病复发、3年治疗完成或治疗中断为止(以先到者为准)。在数据截止时,奥西替尼的总暴露中位时间为22.5个月,安慰剂为18.7个月。
在WCLC 2020上介绍的发现表明,在完全切除且无病的患者中,伴随或未伴随化疗的奥西替尼治疗都不会影响HRQoL[18]。从基线到第96周,没有观察到奥西替尼和安慰剂在身体和精神成分总评T分数或健康领域T分数(即身体机能、角色-身体、身体疼痛、总体健康、活力、社交功能、角色情感、心理健康)方面有临床上有意义的差异。
在无病期间,两组中超过80%的患者的身体或精神成分总评分未出现任何临床上有意义的恶化。对于那些恶化的患者,奥西替尼和安慰剂的两个总评分中,到达恶化的时间无差异。此外,各治疗组的SF-36健康领域的达到恶化的时间没有差异。总体而言,尽管在ADAURA的实验组中进行了长期治疗,但HRQoL仍保持不变,这进一步证实了奥西替尼在这种情况下作为新治疗策略的重要性。
埃克替尼(icotinib)的中期发现
正在进行的随机化、开放标签、III期EVIDENCE研究正在辅助条件下评估第一代EGFR TKI埃克替尼,该药物已在中国被批准用于EGFR突变型NSCLC的一线单药疗法。完全切除的II-IIIA期NSCLC患者被随机分配至每日3次125 mg埃克替尼持续2年(n = 161),或顺铂加长春瑞滨(vinorelbine)或培美曲塞(pemetrexed)(视组织学而定)的化疗持续4个周期(n = 161)。 DFS构成主要终点。每组中分别有大约三分之二和三分之一的患者属于IIA和IIIA期肿瘤,只有少数患有IIB疾病。大约90%的人进行了肺叶切除术。
正如在WCLC 2020上报告的中期分析所示,与化疗相比,辅助埃克替尼显著延长DFS,风险降低64%(46.95与22.11个月;HR,0.36;p <0.0001)[19]。OS结果尚未成熟。在分别使用埃克替尼和化疗治疗22.2个月和2.8个月的中位时间后,安全性分析未产生新信号。在埃克替尼组中最常见的3/4级治疗相关不良事件(AE)为皮疹(1.9%)、腹泻(0.6%)和皮肤干燥(0.6%)。在化疗组中,这些AE是中性粒细胞减少(41.0%)、白细胞减少(19.4%)、呕吐(12.9%)和恶心(7.2%)。两组均未发生间质性肺疾病。作者在其总结中强调,辅助埃克替尼可能为已完全切除肿瘤的EGFR突变型早期NSCLC患者提供新的治疗选择。
ITACA:化疗定制
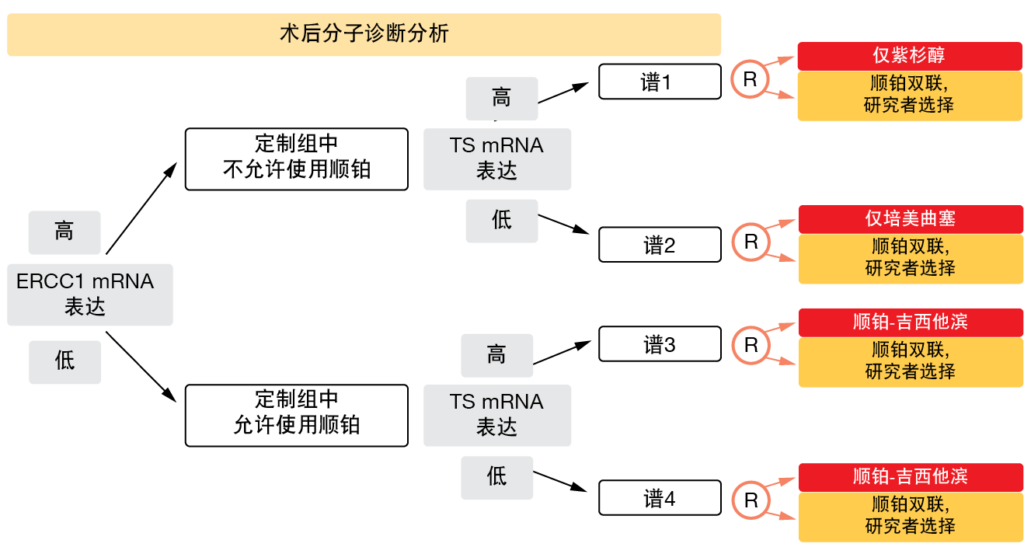
由于早期NSCLC中辅助铂类化疗的OS获益不大,因此显然需要更好地定义最有可能从该治疗中获得生存改善的患者,同时排除那些不需要辅助化疗的患者。基于观察到不同基因的mRNA表达与对特定抗癌药的敏感性或耐药性相关[20, 21],III期辅助ITACA试验旨在评估分子标志物切除修复交叉互补基因1(ERCC1)和胸苷酸合酶(TS)的mRNA表达水平的预测效用[22]。在通过实时PCR对来自完全切除的II-IIIA期NSCLC的样品集中地评估ERCC1和TS水平之后,进行了随机分组。第一次分配涉及高或低的ERCC1 mRNA表达,然后在每个ERCC1组中分配高或低TS mRNA表达(图1)。
这产生了以不同基因组谱为特征的四个组,患者被随机分配到组中进行治疗。根据研究者的选择,四个对照组中的所有患者均接受了顺铂双联的标准化疗。在高ERCC1人群中,定制组中不允许使用顺铂。TS mRNA表达与定制高ERCC1组中使用紫杉醇(paclitaxel)还是培美曲塞以及定制低ERCC1组中使用吉西他滨(gemcitabine)还是培美曲塞的决定有关。共有意大利、德国和波兰的31个中心参与了试验。
图1: ITACA试验设计:使用ERCC1和TS mRNA表达来分配的四个患者组中的随机化
动力不足的样本中无明显结果
在2008年至2014年之间,有773名患者被随机分组。出于统计目的,将所有药物基因组学驱动的组集合在一起为定制组(n = 344),将所有对照组集合为标准组(n = 346)。OS被定义为主要终点。在两组中,患者接受中位数四个周期的治疗。
基于ERCC1和TS的原发肿瘤组织mRNA表达进行辅助化疗定制未导致显著的OS改善。在ITT人群中观察到了有利于定制方法的趋势(96.4与83.5个月;HR,0.76)。在进行最终分析时,该研究的动力不足。仅出现了46%的预期事件。尽管统计量很低,但不同基因组谱之间的OS没有差异。同样,两组的无复发生存期也无显著差异(64.4与41.5个月;HR,0.94)。
同时,治疗定制显著改善治疗的毒性,但不影响疗效。这种差异主要与血液学AE有关。对于定制组与对照组之间的比较,≥1个3-4级事件的优势比为0.57(p <0.001)。考虑到分析的统计量不足,作者得出结论认为,在完全切除的NSCLC中,需要更全面的高通量诊断技术来定制伴随或不伴随免疫治疗的辅助化疗。
EGFR TKI 疗法用于III期EGFR突变型疾病
在无法切除的局部晚期NSCLC且携带EGFR突变的条件下,EGFR TKI早期使用的疗效尚不清楚。一项回顾性分析调查了在12家中国学术癌症机构中接受治疗的440名不可切除的IIIA/IIIB期NSCLC患者的一线治疗模式[23]。第1组接受同时或贯序放化疗;第2组接受放疗加EGFR TKI,有或无化疗;而第3组仅接受前期TKI治疗,直至肿瘤进展。为了进行分析,研究人员使用了基于多项倾向评分模型的逆处理概率加权法(IPTW),以减少潜在混杂因素的影响,同时使有效样本量最大化。
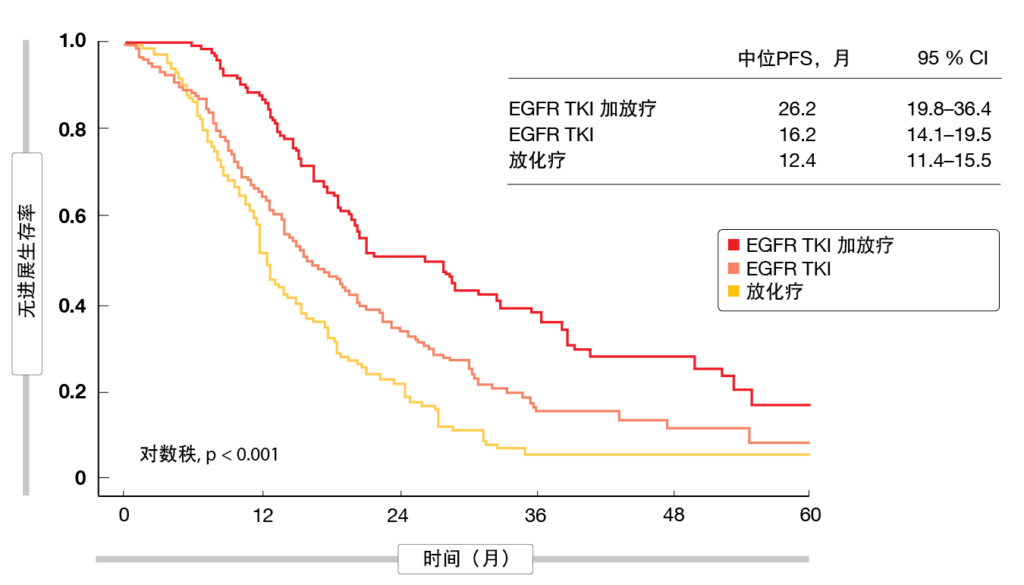
根据IPTW分析,在总体生存率(OS)和无进展生存期(PFS)方面,证明无论是否进行化疗,TKI治疗加放疗均优于标准放化疗方法和仅采用TKI的方法。TKI加放疗的中位OS为67.4个月,而放化疗的中位OS为51.0个月(HR,0.61;p = 0.039),TKI单药治疗的中位OS为49.3个月。PFS分别为26.2个月、12.4个月(HR,0.40; p <0.001)和16.2个月(图2)。可以通过有效控制区域性和远处疾病来解释OS获益。与其他组相比,接受TKI加放疗的患者发生局部区域失败的风险最低,与放化疗相比风险降低52%(HR,0.48;p = 0.002)。对于远处进展,接受TKI加放疗和TKI单药治疗的患者比放化疗组的患者表现更好(HR分别为0.62和0.56;p分别为0.013和<0.001)。
作者在结论中指出,多种治疗模式的结合将为更多无法切除的局部晚期NSCLC患者带来健康益处。随机化对照试验已经获批,旨在在有或没有放化疗的情况下探索辐照加EGFR TKI治疗。
图2: 在IPTW分析后,放化疗、EGFR TKI疗法和EGFR TKI加放疗的无进展生存率
LCMC3:新辅助阿特珠单抗(atezolizumab)
LCMC3试验研究了阿特珠单抗的新辅助用途,该试验纳入了未经治疗的可切除NSCLC(即,未选定的IB-IIIA期和选定的IIIB期)患者。在手术之前,先进行了两个周期的阿特珠单抗治疗。此后,根据研究者的选择,该方案允许选择12个月的辅助阿特珠单抗或适合于疾病阶段的疗法。Lee等人在WCLC 2020上介绍了该试验的主要分析结果[24]。在构成安全性人群的181名患者中,有159名接受了手术。共有144人组成了主要功效人群。
达到主要病理学缓解(MPR;定义为≤10%的存活肿瘤细胞)的主要终点,在主要功效人群中该比率达到21%。 这些患者中有7%达到了病理完全缓解。阿特珠单抗疗法后43%患者降级,19%患者升级。88%的病例在完成阿特珠单抗疗法后±10天的狭窄方案定义窗口内进行切除。从第2周期结束到手术的中位时间为22天。大多数患者接受了肺叶切除术(79%)。R0切除率高达92%。
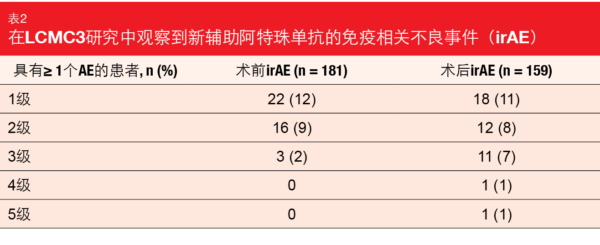
围手术期的发病率和死亡率较低。术中事件发生率为4%,所有并发症均得到成功治疗。一名患者在手术后30天内因猝死而死亡,另一名患者在手术后30-90天的时间窗口内因肺炎而死亡。中位住院时间为7.5天。术前和术后的免疫相关AE大多为1级和2级(表2)。
探索性终点包括主要疗效人群的疗效结果。I/II期和III期疾病患者在1.5年时的DFS率分别为79%和77%,OS率分别为91%和87%。根据对LCMC3的临床和生物标志物数据的分析,达到MPR的患者表现出OS和DFS改善的趋势[25]。同样,更好的病理学缓解与STK11野生型、更高的肿瘤突变负荷以及基线肿瘤微环境中更多的活化免疫细胞和CD68阳性细胞有关。
总体而言,LCMC3为评估阿特珠单抗加铂类化疗的进行中的安慰剂对照的III期IMpower030研究提供了额外的证据。
KEYNOTE-799的更新结果
对于III期不可切除的NSCLC患者,标准治疗包括同步放化疗(cCRT)和对于≥2个cCRT周期后仍未进展的患者给予度伐鲁单抗(durvalumab)作为巩固治疗[26]。但是,多达三分之一的患者可能不符合使用度伐鲁单抗进行巩固治疗的资格[27, 28]。因此,非随机化II期KEYNOTE-799研究调查了派姆单抗(pembrolizumab)加cCRT治疗IIIA-C期、不可切除、先前未治疗的NSCLC患者。由鳞状和非鳞状NSCLC患者组成的队列A接受派姆单抗加紫杉醇/仅卡铂(1个周期),并联合胸腔放疗(2-3个周期),随后接受派姆单抗单药治疗(4-17个周期)。队列B仅限于非鳞状NSCLC患者。其中单独给予派姆单抗加培美曲塞/顺铂(1个周期),并联合放疗(2-3个周期)。在第4-17个周期中,患者接受派姆单抗单药治疗。在初步分析时,队列A的ORR为67.0%,队列B的ORR为56.6%[29]。 Reck等人报告了该研究在6个月的额外随访后的结果[30]。
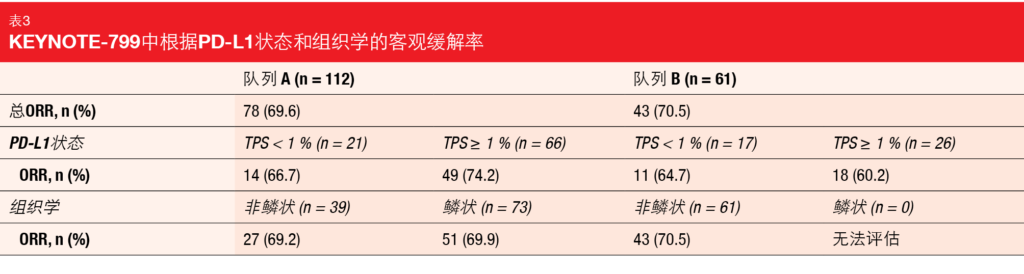
派姆单抗加cCRT继续显示出有希望的抗肿瘤活性。在队列A(n = 112)中,ORR为69.6%,在队列B(n = 61)中,ORR为70.5%。在由PD-L1肿瘤比例评分(<1%与≥1%)和组织学(非鳞状与鳞状;表3)确定的亚组中,观察到了相似的百分比。两个队列都尚未达到中位缓解时间。队列A和队列B分别有82.2%和72.1%的患者的缓解持续≥12个月。同样,两组均未达到中位PFS,12个月PFS率分别为67.7%和65.2%。十二个月的OS率为81.2%和88.0%。中位OS还不成熟。
接受派姆单抗加cCRT的患者中AE的发生率与cCRT用于III期NSCLC以及派姆单抗单药治疗的已确立的毒性相一致[31, 32]。≥3级肺炎的发生率分别为8.0%和7.9%,因此在免疫疗法联合cCRT的预期范围内[33]。
参考文献
- Datta D, Lahiri B, Preoperative evaluation of patients undergoing lung resection surgery. Chest 2003; 123(6): 2096-2103
- Le Chevalier T, Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going? Ann Oncol 2010; 21 Suppl 7: vii196-198
- Cagle PT et al., Lung cancer biomarkers: present status and future developments. Arch Pathol Lab Med 2013; 137(9): 1191-1198
- Chansky K et al., The IASLC Lung Cancer Staging Project: external validation of the revision of the TNM stage groupings in the eighth edition of the TNM classification of lung cancer. J Thorac Oncol 2017; 12(7): 1109-1121
- Kris MG et al., Adjuvant systemic therapy and adjuvant radiation therapy for stage I to IIIA completely resected non-small-cell lung cancers: American Society of Clinical Oncology/Cancer Care Ontario Clinical Practice guideline update. J Clin Oncol 2017; 35(25): 2960–2974
- Postmus PE et al., Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28 (suppl4): iv1-iv21
- Pignon JP et al., Lung adjuvant cisplatin evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008; 26(21): 3552–3559
- Herbst RS et al., Osimertinib as adjuvant therapy in patients with stage IB–IIIA EGFR mutation positive NSCLC after complete tumor resection: ADAURA. J Clin Oncol 38: 2020 (suppl; abstr LBA5)
- Wu YL et al., Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med 2020; 383(18): 1711-1723
- Wu YL et al., Postoperative chemotherapy use and outcomes from ADAURA: osimertinib as adjuvant therapy for resected EGFR mutated NSCLC. WCLCL 2020, OA06.04
- Chouaid C et al., Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer 2018; 124: 310-316
- Buck PO et al., Treatment patterns and health resource utilization among patients diagnosed with early stage resected non-small cell lung cancer at US community oncology practices. Clin Lung Cancer 2015; 16(6): 486-495
- Zhong WZ et al., Gefitinib versus vinorelbine plus cisplatin as adjuvant treatment for stage II-IIIA (N1-N2) EGFR-mutant NSCLC (ADJUVANT/CTONG1104): a randomised, open-label, phase 3 study. Lancet Oncol 2018; 19(1): 139-148
- Goss GD et al., Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR19 study. J Clin Oncol 2013; 31(27): 3320-3326
- Kelly K et al., Adjuvant erlotinib versus placebo in patients with stage IB-IIIA non-small-cell lung cancer (RADIANT): a randomized, double-blind, phase III trial. J Clin Oncol 2015; 33(34): 4007-4014
- Clinicaltrials.gov NCT02193282
- Clinicaltrials.gov NCT02511106
- Majem M et al., Patient-reported outcomes from ADAURA: osimertinib as adjuvant therapy in patients with resected EGFR mutated (EGFRm) NSCLC. WCLC 2020, OA06.03
- Zhou C et al., Icotinib versus chemotherapy as adjuvant treatment for stage II-IIIA EGFR-mutant NSCLC (EVIDENCE): a randomized, open-label, phase 3 study. WCLC 2020, FP14.11
- Ceppi P et al., Thymidylate synthase expression in gastroenteropancreatic and pulmonary neuroendocrine tumors. Clin Cancer Res 2008; 14(4): 1059-1064
- Joshi MB et al., High gene expression of TS1, GSTP1, and ERCC1 are risk factors for survival in patients treated with trimodality therapy for esophageal cancer. Clin Cancer Res 2005; 11(6): 2215-2221
- Novello S et al., International tailored chemotherapy adjuvant (ITACA) phase III study of pharmacogenomic-driven versus standard adjuvant chemotherapy in completely resected stage II-IIIA non-small cell lung cancer. WCLC 2020, PS01.04
- Bi N et al., Results of inverse-probability of treatment weighting (IPTW) using propensity score from REFRACT: a multi-center study investigating the treatment patterns in EGFR-mutant unresectable LA-NSCLC. WCLC 2020, OA02.06
- Lee JM et al., Surgical and clinical outcomes with neoadjuvant atezolizumab in resectable stage IB-IIIB NSCLC: LCMC3 trial primary analysis. WCLC 2020, PS01.05
- Carbone D et al., Clinical/biomarker data for neoadjuvant atezolizumab in resectable stage IB-IIIB NSCLC: primary analysis in the LCMC3 study. WCLC 2020, OA06.06
- National Comprehensive Cancer Network. Non-Small Cell Lung Cancer (Version 1.2021). https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf. 2.
- Agulnik J et al., Understanding clinical practice and survival outcomes in patients with unresectable stage III non-small-cell lung cancer in a single centre in Quebec. Curr Oncol 2020; 27(5): e459-e466
- Horinouchi H et al., Real-world outcomes of chemoradiotherapy for unresectable Stage III non-small cell lung cancer: The SOLUTION study. Cancer Med 2020; 9(18): 6597-6608
- Jabbour SK et al., Phase II study of pembrolizumab (pembro) plus platinum doublet chemotherapy and radiotherapy as first-line therapy for unresectable, locally advanced stage III NSCLC: KEYNOTE-799. J Clin Oncol 2020; 38(15 suppl): 9008
- Reck M et al., Pembrolizumab plus platinum chemotherapy and radiotherapy in unresectable, locally advanced, stage III NSCLC: KEYNOTE-799. WCLC 2020, OA02.03
- Yoon SM et al., Therapeutic management options for stage III non-small cell lung cancer. World J Clin Oncol 2017; 8(1): 1-20
- Mok TS et al., Pembrolizumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial. Lancet 2019; 393(10183): 1819-1830
- Peters S et al., Safety evaluation of nivolumab added concurrently to radiotherapy in a standard first line chemo-radiotherapy regimen in stage III non-small cell lung cancer-the ETOP NICOLAS trial. Lung Cancer 2019;133: 83-87
© 2020 Springer-Verlag GmbH, Impressum