近期小细胞肿瘤管理的基准
KEYNOTE-158
广泛期小细胞肺癌 (ED-SCLC) 对一线治疗反应高,但经常发生早期复发,预后较差。迄今为止,仍未确定生物标志物驱动疗法。
基于免疫系统参与 SCLC 的病理生理学和该疾病的高突变负荷,免疫疗法具有作为一种新型治疗的可能[1-3]。KEYNOTE-158 是一项针对 10 种肿瘤类型的 II 期篮式研究,包括具有高微卫星不稳定性的癌症(MSI-H),它评估了晚期 SCLC 中抗 PD1 抗体派姆单抗,生物标志物状态不予以考虑[4]。具有不可切除和/或转移性 SCLC 且经历标准治疗进展或不耐受的预治疗患者接受派姆单抗 200mg Q3W 治疗 2 年或直至恶化。ORR 构成主要疗效指标。在 107 名患者中,16 名(15%)有稳定的脑转移。该同期群包括一名有类癌组织的患者和七名有神经内分泌肿瘤的患者。
三分之一的群体已经接受了 2 种治疗方案,并且在 23% 的治疗中,已经实施了 ≥ 3 种疗法。在基线状态下,39% 和 47% 的肿瘤分别是 PD-L1 阳性和 PD-L1 阴性,并有 14% 不可评估。此外,生物标志物分析了 91% 的非 MSI-H 状态(即微随体稳定性和低微随体不稳定性),并有 9% 不可评估。
PD-L1阳性组的优异结果
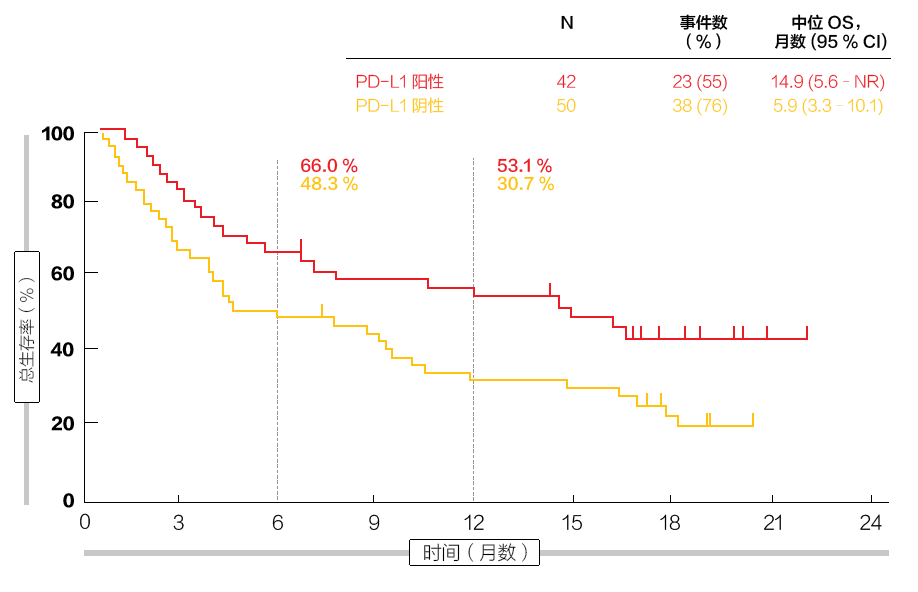
总体而言,反应发生率为 18.7%,疾病控制率为 30%。PD-L1 阳性肿瘤患者的反应率为 35.7%,而 PD-L1 阴性组的患者仅为 6.0%。疾病控制率分别为 43% 和 20%。作者指出,这些发现与 IB 期 KEYNOTE-028 试验的 SCLC 同期群一致,该试验评估了对以前接受表达 PD-L1 广泛期肿瘤治疗的患者使用派姆单抗的效果 [5]。值得注意的是,反应被证明是持久的;在分析时尚未达到其中位持续时间,并且 12 名患者(73%)的反应 ≥1 年。PD-L1 阳性和 PD-L1 阴性患者的中位 PFS 分别为 2.1 个月和 1.9 个月。相应的 OS 结果分别为 14.9 个月和 5.9 个月
(图 1)。在 12 个月时,分别有 53.1% 和 30.7% 的患者存活。
安全性特征与先前在其他肿瘤类型中使用派姆单抗单一疗法的安全性特征相一致。对新诊断 ED-SCLC 的患者进行的 III 期 KEYNOTE-604 研究中,派姆单抗加标准化疗(即依托泊苷/铂类药物)的效果评估正在进行。
图 1:接受派姆单抗治疗的 PD-L1 阳性患者组的较好存活结果
单独使用 durvalumab 及与 tremelimumab 合用
在 SCLC 中研究的另一种检查点抑制剂是抗 PD-L1 抗体 durvalumab。该试剂表现出作为单一试剂和与抗-CTLA-4 抗体 tremelimumab 组合的活性。在单一疗法试验中(这是 1108 研究的多中心、开放性 ED-SCLC 扩展同期群),使用 durvalumab 10mg/kg Q2W 长达 12 个月,证明在某些患者中具有持久的临床活性[6]。在 21 例患者当中,只有 2 例有反应(ORR,9.5%),但这些反应分别持续了 14.6 和 29.5 个月。第二名患者属于铂类药物难治人群,并已接受过 3 种治疗方案。中位 PFS 和 OS 分别为 1.5 个月和 4.8 个月。12 个月的 OS 率为 27.6%。Durvalumab 耐受性良好,未观察到 3/4 级的 AE。
在多中心、开放性联合试验中(这是一项 I 期剂量探索/扩展研究),在先前治疗的有选择性晚期实体瘤的患者中测试了 4 剂量的 durvalumab 20mg/kg Q4W 和 tremelimumab 1mg/kg Q4W。在联合治疗后,患者接受 durvalumab 10 mg/kg Q2W 直至完成 12 个月的治疗。在 ASCO 2018 年大会上,Cho 等人介绍了 ED-SCLC 剂量扩展同期群的第一份临床活动和安全性报告(n = 30)[7]。
与 NSCLC [8]的发现一致,durvalumab 加 tremelimumab 具有显著活性。经确认的 ORR 为 13.3%,包括 2 个完全和 2 个部分缓解。三名铂类耐药/难治性患者对治疗有缓解。反应发生在早期并且持久(中位 DOR,18.9个月)。6 个月的 PFS 率为
16.3%,12 个月的 OS 率为
41.7%。未发生因治疗相关 AE 导致的停药或死亡。3/4 级治疗相关 AE 的发生率为 23.3%。作者得出结论,结合单药治疗数据,这些结果表明 durvalumab 对 ED-SCLC 患者具有活性。正在进行的试验包括研究 durvalumab 加 tremelimumab 对铂类药物难治性患者的疗效的 II 期、开放性 BALTIC 研究,以及调查一线 durvalumab 联合或未联合 tremelimumab 加铂类化疗对比单独化疗疗效的 III 期 CASPIAN 试验。
二线 lurbectedin 单药治疗具有令人信服的活性
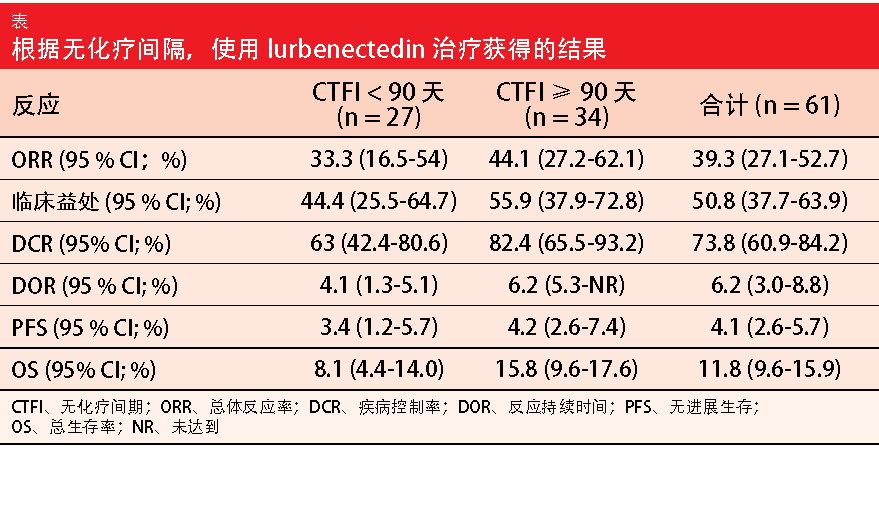
Lurbinectedin 是一种新的抗癌药物,可阻断转录并诱导 DNA 双链断裂,从而导致细胞凋亡。Trigo 等人介绍了 61 例 SCLC 患者在多中心、II 期篮式试验中的结果,该试验评估了 lurbinectedin 3.2 mg/m2 Q3W 在几种类型的晚期实体肿瘤中的疗效和安全性[9]。SCLC 组已接受过一次化疗。不允许脑转移。对于该分析,根据无化疗间隔(CTFI)分层;34 和 27 名患者的 CTFI 分别为 ≥90 天和 <90 天。
具有延长 CTFI 的组在 ORR、临床获益、疾病控制率、DOR、PFS 和 OS 方面表现更好(表)。在 6 个月时,总群体中 36.3% 的患者存活且无进展;
CTFI ≥90 天和 <90 天,这些比例分别为 42.8% 和 28.1%。同样,在 12 个月时,OS 率分别为 59.1% 和 22.9%。在该群体中观察到的安全性是可接受的,并且耐受性良好,没有意外的毒性或与药物有关的死亡现象。根据研究人员的说法,这些结果表明单药 lurbinectedin 可作为复发性 SCLC 患者的替代疗法。
三线环境中的 Rova-T
神经内分泌肿瘤中的新靶标是非典型抑制性 Notch 配体δ样蛋白 3(DLL 3)。它表达于癌症干细胞和肿瘤细胞,但在正常成人组织上不表达。超过 85% 的 SCLC 表达 DLL3,尽管它并非标准治疗结果的预后。抗体-药物偶联物 rovalpituzumab tesirine(Rova-TTM) 已被开发用于靶向 DLL3。I 期研究显示 56 例复发性 SCLC 患者的 ORR 为 16%;这里,那些具有最高 DLL3 表达的反应率为 31%,并且经历了 5.8 个月的中位 OS[10]。
II 期、单组 TRINITY 试验在 339 例有 DLL3 表达、复发或难治性 SCLC 的患者中测试了 Rova-T 0.3mg/kg(2 剂,间隔 6 周),这些患者之前已接受 ≥2 次治疗,并至少含有 1 次基于铂类药物的治疗[11]。允许进展时再治疗。参与 TRINITY 的患者中有 70% 被定义为 DLL3 高,即其肿瘤中 ≥75% 的细胞表达 DLL3。允许稳定的 CNS 转移。在登记参加实验的 339 名患者中,23% 的患者对一线铂类药物疗法有耐药性或难治性。77% 已经接受 2 次预治疗。40% 存在脑转移,25% 存在胸腔积液史。
> 70 % 的临床益处
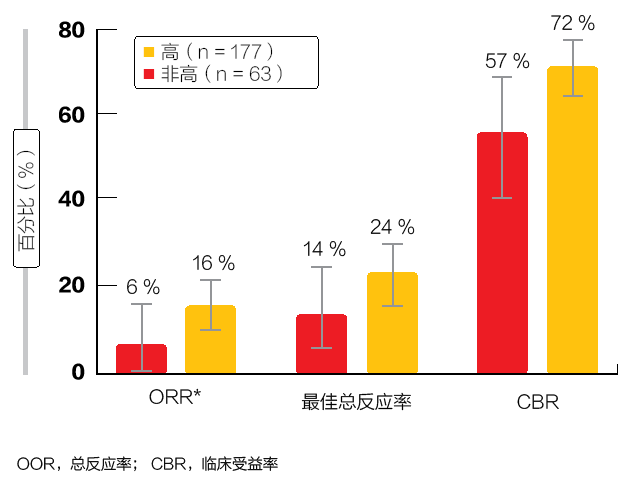
ORR 为主要疗效指标。研究人员表示,整个同期群的 ORR 为 18.0%,DLL3-高亚组的 ORR 为 19.7%。这些结果按 IRC 则为 12.4% 和 14.3%。整组和 DLL3-高患者的中位 OS 分别为 5.6 个月和 5.7 个月。在三线和四线的情况下,反应率似乎更高(根据研究人员所说,三线和四线分别为 29% 和 23%)。重要的是,根据研究人员和 IRC,三线和四线的临床受益率(完全和部分反应加上疾病稳定)> 70%。这些反应似乎在具有高 DLL3 表达的组中得到加强。与那些具有低但阳性 DLL3 表达的患者相比,DLL3 高患者的 ORR、最佳总体反应
率和临床受益率有改善趋势
(图 2)。约 40% 的反应发生在治疗开始 10 周后。在三线和四线情况下,IRC 的 DOR 分别为 4.1 个月和 2.8 个月。全线中,DLL3 高患者经 IRC 评估的 PFS 和 OS 分别为 3.8 个月和 5.7 个月。
与药物有关的严重 AE 发生率为 30%,≥3 级的 AE 发生率为 40%。因全身性水肿、肺炎、腹水、药物性肝损伤、胸腔积液、气胸、呼吸衰竭和败血症,研究期间发生 10 例致死性 AE(3%)。
导致停药的 AE 发生率为 5%。最常见的 AE 包括光敏反应(35%)、
胸腔积液(28%)、疲劳(28%)、
外周性水肿(26%)和血小板减少症(22%)。在治疗前已经出现渗出的患者当中,高度浆膜渗出的风险似乎有所增加。
研究人员得出结论,在尚未批准任何治疗方案的情况下,Rova-T 是二线治疗以外的 SCLC 的活性药物。MERU 和 TAHOE III 期研究正在评估 Rova-T,这些研究分别在一线维持和二线环境中评估该药物。多项 I 期试验也在进行中;这些试验正在测试 Rova-T 与化疗、纳武单抗,及纳武单抗/伊匹单抗的组合。
图 2:ORR、DLL3 高和 DLL3 非高患者的最佳总体反应和临床益处
SCLC 转变后会发生什么?
对 TKI 治疗产生获得性耐药后,
3% 至 10% 的 EGFR 突变型腺癌转变为高级神经内分泌癌,包括 SCLC[12]。已经报告有 EGFR 突变的 de novo SCLC 病例[13]。由于 SCLC 转变 EGFR 阳性肺癌的特征和临床过程在很大程度上是未知的,Marcoux 等人回顾性分析了 67 例 EGFR 突变 SCLC 患者[14]。在转移性癌症的初步诊断中,58 例(87%)的病理学与 NSCLC 一致,9 例(13%)有 SCLC 证据。5 例有纯粹 SCLC,并且 4 例有包括 SCLC 组分的混合组织。转变前患者平均接受 2 次系统治疗。在转变时,93% 的患者接受 EGFR TKI 治疗。转移性 NSCLC 的初始诊断与首个 SCLC 证据之间的中位时间为 17.8 个月。
转变时,所有基因分型患者都保留其基础 EGFR 突变。转变时,大多数先前 T790M 阳性
患者(79%)不再检测到 T790M。TP53、RB1 和 PIK3CA 突变是排在第二位的常见遗传改变。初始诊断转移性肺癌(31.5 个月)的中位 OS 与从未转变为 SCLC 的 EGFR 突变患者的预期 OS 相似,并且从 EGFR 突变 SCLC(10.9 个月)的一手证据得到的中位 OS 与通过 de novo SCLC 观察到的 OS 相似。对铂-依托泊苷和紫杉烷类药物的反应是频繁的,但却是短暂的。重要的是,该分析表明对检查点抑制剂治疗没有反应。作者总结说,需要进一步研究以更好地阐明这些 EGFR 突变肿瘤的最佳诊断和治疗方法。
参考
- George J et al., Comprehensive genomic profiles of small cell lung cancer. Nature 2015; 524(7563): 47-53
- Maddison P et al., Favourable prognosis in Lambert-Eaton myasthenic syndrome and small-cell lung carcinoma. Lancet 1999; 353(9147): 117-118
- Peifer M et al., Integrative genome analyses identify key somatic driver mutations of small-cell lung cancer. Nat Genet 2012; 44: 1104-1110
- Chung HC et al., Phase 2 study of pembrolizumab in advanced small-cell lung cancer: KEYNOTE-158. J Clin Oncol 36, 2018 (suppl; abstr 8506)
- Ott PA et al., Pembrolizumab in patients with extensive-stage small-cell lung cancer: results from the phase Ib KEYNOTE-028 study. J Clin Oncol 2017; 35(34): 3823-3829
- Goldman JW et al., Safety and antitumor activity of durvalumab monotherapy in patients with pretreated extensive disease small-cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr 8518)
- Cho D et al., Safety and clinical activity of durvalumab in combination with tremelimumab in extensive disease small-cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr 8517)
- Antonia S et al., Safety and antitumour activity of durvalumab plus tremelimumab in non-small cell lung cancer: a multicentre, phase 1b study. Lancet Oncol 2016; 17; 299-308
- Trigo JM et al., Efficacy and safety of lurbinectedin (PM1183, Zepsyre®) in small cell lung cancer (SCLC): results from a phase 2 study. J Clin Oncol 36, 2018 (suppl; abstr 8570)
- Rudin CM et al., Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study. Lancet Oncol 2017; 18(1): 42-51
- Carbone DP et al., Efficacy and safety of rovalpituzumab tesirine (Rova-TTM) in patients with DLL3-expressing, ≥ 3rd line small cell lung cancer: results from the phase 2 TRINITY study. J Clin Oncol 36, 2018 (suppl; abstr 8507)
- Sequist LV et al., Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3(75): 75ra26
- Okamoto I et al., EGFR mutation in gefitinib-responsive small-cell lung cancer. Ann Oncol 2006; 17(6): 1028-1029
- Marcoux N et al., Outcomes of EGFR-mutant lung adenocarcinomas that transform to small cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr 8573)
More posts
通过血浆游离 DNA 的全面测序进行非侵入性癌症检测
血浆游离 DNA 的全面测序可检测非侵入性癌症 早期检测肺癌是亟待解决的医疗问题。尽管低剂量计算机断层扫描(LDCT)已被证明可以改善高危人群的肺癌死亡率[1],但临床采用
近期小细胞肿瘤管理的基准
近期小细胞肿瘤管理的基准 KEYNOTE-158 广泛期小细胞肺癌 (ED-SCLC) 对一线治疗反应高,但经常发生早期复发,预后较差。迄今为止,仍未确定生物标志物驱动疗法
ALK 阳性疾病:推动可治疗性突破界限
ALK 阳性疾病:推动可治疗性突破界限 在 ALEX 中证实了艾乐替尼的 CNS 和非 CNS 疗效 ALK 阳性、晚期 NSCLC 患者的标准治疗包括第一代 ALK 抑制
访谈:“定序问题仍然存在
“顺序问题仍然存在” 作者版权所有 Barbara Melosky,医学博士,FRCPC, 加拿大温哥华不列颠哥伦比亚大学和不列颠哥伦比亚省癌症机构 阿法替尼已获批用于肺
关于跨 3 个世代的 EGFR 靶向 TKI 的新数据
关于跨 3 个世代的 EGFR 靶向 TKI 的新数据 厄洛替尼加贝伐单抗 EGFR TKI 治疗已成为晚期、 EGFR 突变阳性 NSCLC 患者的标准一线治疗策略。药物
免疫检查点阻滞:治疗成功的决定因素
免疫检查点阻滞:治疗成功的决定因素 PD-L1表达之外的各种临床因素,已作为对免疫检查点抑制产生反应的预测因子经过探索。具体而言,分析将缺少烟草暴露与 NSCLC 中 PD