PD-1抑制和(非)霍奇金淋巴瘤:在新兴领域的结果可期
纳武单抗(Nivolumab)加BV用于MGZL治疗
纵隔灰区淋巴瘤(MGZL)是一种非常罕见的非霍奇金淋巴瘤,主要出现在年轻男性中[1]。该病表现出在结节性硬化经典霍奇金淋巴瘤(cHL)与原发性纵隔B细胞淋巴瘤(PMBL)之间的过渡特征[2, 3]。但是,与PMBL相比,MGZL患者的常规化疗后生存率较差[4]。II期Checkmate 436试验已经在成年r/r PMBL患者中确定了抗PD-L1抗体纳武单抗联合抗体-药物缀合物 维布妥昔单抗(brentuximab vedotin,BV)的高缓解率[5]。同样,在I/II期条件下治疗的r/r cHL患者中,纳武单抗加BV产生了良好的效果[6]。在CheckMate 436研究的另一队列中,r/r MGZL患者每3周接受一次纳武单抗240 mg加BV 1.8 mg/kg,直至疾病进展。在ASH 2020上报告了MGZL队列(n=10)的主要疗效和安全性分析 [7]。7名患者(70 %)存在难治性疾病,先前的系统性癌症疗法的中位数为2。所有患者均未进行过自体干细胞移植(ASCT)。
支持桥接的发现
在数据库锁定时,所有患者均已停止治疗。原因包括疾病进展(n=5),最大临床获益(n=3),同种异体SCT(n=1)和ASCT(n=1)。所有具有最大临床获益的患者均已完全缓解,并已进行了同种异体SCT。整体组的ORR高达70 %。完全和部分缓解分别占50 %和20 %。而且,到达CR的时间很短(1.2-4.8个月)。正如作者所指出的,这些发现与在r/r PMBL和r/r cHL中针对纳武单抗加BV报告的结果一致[5,6,8]。所有获得CR的患者都被桥接到造血细胞移植(即4个同种异体SCT和1个ASCT)。
尚未达到中位OS。在6个月时,有80%的患者存活。由于对接受后续疗法的患者进行了较早的检查,因此无法可靠地估计出缓解持续时间和PFS。该组合的安全特性是可以忍受的,并且与以前的报告一致[5,6,8]。发生了血细胞减少、感觉异常和周围感觉神经病。没有观察到4级AE。一名患者被诊断为3级发热性中性嗜粒细胞减少,另一名发生皮疹,这是唯一报告的免疫介导的AE,其无需系统性类固醇激素即可治愈。基于这些发现,作者得出结论,对于化疗难治性MGZL患者,纳武单抗加BV代表了桥接干细胞移植的潜在选择。
cHL:派姆单抗与BV
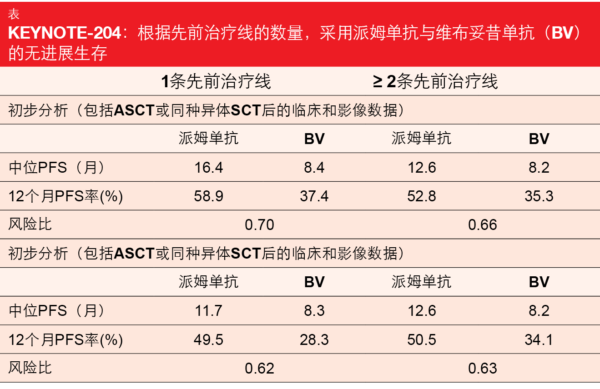
对于ASCT失败、患有原发性难治性疾病或不适合ASCT的复发/难治性cHL患者,预后较差[9-13]。开放标签、国际化、随机、III期KEYNOTE-204研究在r/r cHL患者中测试了PD-1抑制剂派姆单抗作为单药疗法(n=151)以及抗体-药物缀合物维布妥昔单抗(BV;n=153)。两组均进行了多达35个周期的治疗。在ASCO 2020上介绍的初步分析已经显示,派姆单抗与BV相比在PFS方面具有统计学显著且有临床意义的益处(13.2与8.3个月; HR,0.65;p=0.00271)[14]。在ASH 2020上,Kuruvilla等人介绍了一项对该研究的事后探索性分析,该分析根据先前治疗线的数量评估了结果 [15]。在55名先前接受过单线治疗的患者中,分别有27名和28名接受了派姆单抗和BV治疗。≥2条治疗线后的患者队列(n=249)包含随机分配至该检查点抑制剂的124人和随机分配至BV的125人。与BV相比,单药派姆单抗被证明可以改善临床结果,而与先前的治疗数量无关。不管数据集是否包括继续接受巩固ASCT或同种异体SCT的患者,结论都是如此(表)。风险降低幅度在30 %到38 %之间。总体而言,这些结果与初步分析一致[14]。同样,无论采用何种治疗线,ORR均相似。在一条治疗线后,有66.7 %与53.6 %的患者缓解,而≥2条治疗线后,则有65.3 %与54.4 %的患者缓解。缓解持续的中位数分别为20.7与14.1个月,以及20.5与11.2个月。两种药物的安全性在各亚组中总体上相似。没有出现意外的安全信号。同样,按照先前的治疗线评估了随后的ASCT。接受单线治疗的患者组中,派姆单抗和BV组的患者中分别有25.9 %和33.3 %接受了ASCT。对于≥2条先前治疗线的患者,该数据为19.0 %和20.0 %。正如作者在其结论中指出的,这些发现证实,仅接受一条先前治疗线后不适合ASCT的r/r cHL患者似乎可以从派姆单抗单药治疗中获益。
TME对替雷利珠单抗(tislelizumab)疗效的影响
从组织学上看,cHL的特征是肿瘤细胞数量低(1-5 %)和由巨噬细胞、T细胞和其他免疫细胞组成的显性肿瘤微环境(TME)[16]。具有野生型Fc区的抗PD-1抗体(如纳武单抗和派姆单抗)的疗效有限可能是由于与巨噬细胞上的FcγR结合所致,因为这会通过激活抗体依赖性巨噬细胞介导的T效应细胞杀伤而损害药物的抗肿瘤活性[17,18]。抗PD-1抗体替雷利珠单抗经过特殊工程化以最大程度减少与巨噬细胞上FcγR的结合。
临床前数据显示,在巨噬细胞和T细胞富集的情况下,替雷利珠单抗不会诱导抗体依赖性细胞吞噬(ADCP),因此其抗肿瘤活性没有受到损害[19]。一项研究替雷利珠单治疗大剂量化疗/ASCT失败或不适合的中国cHL患者的关键性II期临床试验显示,ORR为87.1 %,CR率为62.9 % [20]。在ASH 2020上报告的该研究探索了cHL TME中巨噬细胞上的FcγR表达是否会影响替雷利珠单抗的疗效[21]。此外,还评估了与CR相关的其他生物标志物。使用多重免疫组化(mIHC)和基因表达谱(GEP)分析了来自BGB-A317-203试验中包含的70名患者的样品。其中,分别有41和36人是mIHC和GEP可评估的。
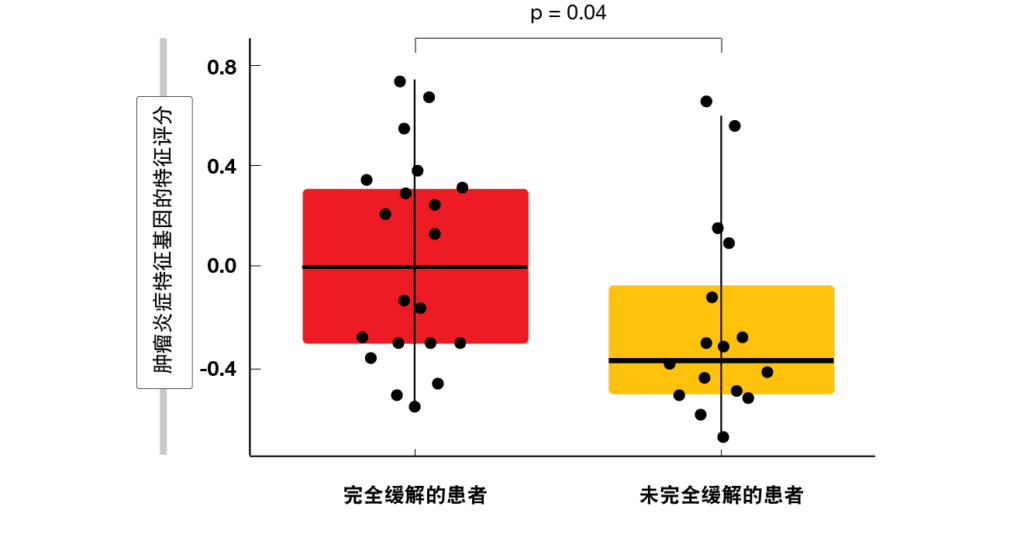
根据替雷利珠单抗的特性,该药物显示出高CR率,而与更可能发生由ADCP诱导的效应T细胞清除的富含CD8+T细胞的TME中巨噬细胞上的FcγR表达水平无关。大量FcγR1+巨噬细胞和少量FcγR1+巨噬细胞下的CR率分别为86.6 %与85.7 %。鉴定出与替雷利珠单抗治疗的完全缓解相关的多个生物标志物。根据mIHC得到的更高CD8 + T细胞浸润和通过GEP得到的在TME中的肿瘤炎症特征基因特征与更高的CR率相对应(图)。此外,混合的细胞性和结节性硬化组织学亚型显示出与完全缓解相关的特定基因特征。
图: 在对替雷利珠单抗治疗产生完全缓解的患者中,肿瘤微环境的炎症显著增加
参考文献
- Quintanilla-Martinez L, Fend F. Mediastinal gray zone lymphoma. Haematologica 2011; 96(4): 496-499
- Eberle FC et al., Methylation profiling of mediastinal gray zone lymphoma reveals a distinctive signature with elements shared by classical Hodgkin’s lymphoma and primary mediastinal large B-cell lymphoma. Haematologica 2011; 96(4): 558-566
- Melani C et al., PD-1 blockade in mediastinal gray-zone lymphoma. N Engl J Med 2017; 377(1): 89-91
- Wilson WH et al., A prospective study of mediastinal gray-zone lymphoma. Blood 2014; 124(10): 1563-1569
- Zinzani PL et al., Nivolumab combined with brentuximab vedotin for relapsed/refractory primary mediastinal large B-cell lymphoma: efficacy and safety from the phase II CheckMate 436 Study. J Clin Oncol 2019; 37(33): 3081-3089
- Moskowitz AJ et al., Brentuximab vedotin and nivolumab for relapsed or refractory classic Hodgkin Lymphoma: long-term follow-up results from the single-arm phase 1/2 study. Blood 2019; 134 (Supplement_1): 238
- Santoro A et al., Nivolumab combined with brentuximab vedotin for relapsed/refractory mediastinal gray zone lymphoma: primary efficacy and safety analysis of the phase 2 CheckMate 436 study. ASH 2020, abstract 2045
- Herrara AF et al., Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood 2018; 131(11): 1183-1194
- Fermé C et al., Intensive salvage therapy with high-dose chemotherapy for patients with advanced Hodgkin’s disease in relapse or failure after initial chemotherapy: results of the Groupe d’Etudes des Lymphomes de l’Adulte H89 Trial. J Clin Oncol 2002; 20(2): 467-475
- Goodman KA et al., Long-term effects of high-dose chemotherapy and radiation for relapsed and refractory Hodgkin’s lymphoma. J Clin Oncol 2008; 26(32): 5240-5247
- Santoro A et al., Five-year results of the BEGEV salvage regimen in relapsed/refractory classical Hodgkin lymphoma. Blood Adv 2020; 4(1): 136-140
- Puig N et al., Different response to salvage chemotherapy but similar post-transplant outcomes in patients with relapsed and refractory Hodgkin’s lymphoma. Haematologica 2010; 95(9): 1496-1502
- Younes A et al., Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol 2012; 30(18): 2183-2189
- Kuruvilla J et al., KEYNOTE-204: Randomized, open-label, phase III study of pembrolizumab (pembro) versus brentuximab vedotin (BV) in relapsed or refractory classic Hodgkin lymphoma (R/R cHL). J Clin Oncol 2020; 38(suppl), 8005
- Kuruvilla J et al., Effect of pembrolizumab monotherapy compared with brentuximab vedotin on patients with relapsed/refractory classical Hodgkin lymphoma by prior lines of therapy: an exploratory analysis of the randomized phase 3 KEYNOTE-204 study. ASH 2020, abstract 1158
- Aoki T et al., Single-cell transcriptome analysis reveals disease-defining T-cell subsets in the tumor microenvironment of classic Hodgkin lymphoma. Cancer Discov 2020; 10(3): 406-421
- Dahan R et al., FcγRs modulate the anti-tumor activity of antibodies targeting the PD-1/PD-L1 axis. Cancer Cell 2015; 28(3): 285-295
- Arlauckas SP et al., In vivo imaging reveals a tumor-associated macrophage-mediated resistance pathway in anti-PD-1 therapy. Sci Transl Med 2017; 9(389): eeal3604
- Zhang T et al., The binding of an anti-PD-1 antibody to FcγRΙ has a profound impact on its biological functions. Cancer Immunol Immunother 2018; 67(7): 1079-1090
- Song Y, et al., Treatment of relapsed or refractory classical Hodgkin lymphoma with the anti-PD-1, tislelizumab: results of a phase 2, single-arm, multicenter study. Leukemia 2020; 34(2): 533-542
- Song Y et al., Tumor microenvironment associated with complete response to tislelizumab monotherapy in relapsed/refractory classical Hodgkin lymphoma reveals a potentially different mechanism of action. ASH 2020, abstract 1116
© 2020 Springer-Verlag GmbH, Impressum