CPM: las alteraciones genómicas preparan el terreno para las estrategias dirigidas
El crecimiento rápido y la aparición precoz de enfermedad metastásica son características del cáncer de pulmón microcítico (CPM), que constituye aproximadamente el 15 % de todos los casos de cáncer de pulmón [1]. En la enfermedad en un estadio limitado es posible la curación mediante quimiorradioterapia. Sin embargo, el 68 % de los pacientes se presentan con CPM en estadio extenso (EE-CPM). Aunque se observan grandes respuestas iniciales a la quimioterapia a base de platino y a la radioterapia, la norma es la recidiva de enfermedad quimiorresistente.
En el momento actual, la falta de tratamientos eficaces para el CPM es una de las mayores necesidades no cubiertas en el tratamiento de los pacientes con cáncer de pulmón. Casi todos los casos de CPM son atribuibles al tabaquismo, lo que tiene implicaciones para el panorama de mutaciones en estos casos y, por tanto, para el posible uso de ciertos tratamientos.
Perfil genómico de los pacientes con CPM
Ali y cols. revisaron a 883 pacientes con CPM utilizando un método integral de perfiles genómicos [2]. Es importante señalar que se identificaron todos los tipos de alteraciones genómicas (es decir, sustituciones de pares de bases, inserciones/deleciones, alteraciones del número de copias, reordenamientos). Este estudio es el más extenso hasta la fecha que describe los perfiles genómicos de los pacientes con CPM durante su asistencia clínica.
Estos resultados demuestran que en el CPM hay frecuentes alteraciones genómicas. Las alteraciones genómicas, que incluían fusiones MYCL1, fueron concordantes con las de la literatura médica publicada. Los genes alterados con más frecuencia fueron TP53 (90 %), RB1 (69 %), MLL2 (12,0 %), LRP1B (10,9 %), PTEN (8,5 %), MYCL1 (8,0 %), RICTOR (6,5 %) y MYC (6,1 %). Fueron frecuentes las amplificaciones focales, que incluían RICTOR/FGF10 en el cromosoma 8 y MYCL1 en el cromosoma 1. La amplificación MYCL1 se detectó en 68 (7,8 %) de los pacientes. Siete pacientes albergaban fusiones MYCL1, y cinco de ellos también tenían amplificación MYCL1.
Entre estos pacientes se encontraba el único caso de referencia de una persona que no había fumado nunca y cuyo tumor albergaba JAZF1-MYCL1 sin amplificación de MYCL1. Este paciente experimentó una remisión completa duradera durante 18 meses cuando recibió tratamiento con alisertib, un inhibidor experimental de la aurora A cinasa (MLN8237), y una respuesta parcial duradera a nivolumab. La implicación biológica de ello es que JAZF1-MYCL1 podría estabilizar ectópicamente la expresión funcional de MYCL1, con lo que aumentaría la aurora cinasa diana anterógrada e inhibiría con intensidad el PD-L1 diana anterógrado. Las amplificaciones MYCL1 representarían una elevación menos llamativa de la actividad anterógrada, aunque todavía conferirían sensibilidad a los inhibidores de la aurora cinasa y PD-L1. Por tanto, algunos pacientes, y en particular los portadores de amplificaciones MYCL1, se beneficiarían de la combinación de un inhibidor de la aurora cinasa y un inmunoterápico.
Se determinó que la carga mutacional tumoral (CMT) en el CPM era de 9,9 mutaciones/megabase. En comparación, la CMT en el melanoma es de 12,6 mutaciones/megabase, mientras que es menor en otros tumores. Si se supone que la CMT guarda relación con la eficacia de los inhibidores de PD-1/PD-L1, la distribución de la CMT en el CPM indica una respuesta similar a la inmunoterapia como se ve en el CPNM.
Inhibición de la aurora A cinasa más paclitaxel
La aurora A cinasa (AAK) es un regulador fundamental de la mitosis. Se puede sobrexpresar o amplificar en una serie de tumores sólidos y neoplasias hematológicas malignas. La inhibición de AAK provoca la interrupción de la mitosis y la muerte celular, lo que la convierte en un posible objetivo de los tratamientos antineoplásicos. Los inhibidores de AAK parecen ser eficaces en estirpes celulares de CPM, sobre todo en aquellas con amplificación o gran expresión de Myc [3,4], que es un importante oncogén inductor en muchos cánceres. Se produce amplificación de la sobrexpresión de Myc en el 18 % al 31 % de los CPM, que es más frecuente en la enfermedad quimiorresistente [3].
Alisertib, un inhibidor de AAK en fase de investigación, disponible por vía oral, selectivo y de molécula pequeña, se estudió en combinación con paclitaxel en un estudio aleatorizado en fase II [5]. Participaron pacientes con CPM que habían sido tratados anteriormente con un pauta de quimioterapia a base de platino y que habían experimentado recidivas antes de 180 días desde su conclusión. Los pacientes del grupo de control recibieron placebo más paclitaxel. En cada grupo del estudio se incluyó a 88 pacientes.
Actividad en tumores que expresan c-Myc
En lo que respecta a la SSP en la población por IT, definida como el criterio de valoración principal, el análisis reveló una ventaja significativa de la combinación de alisertib (3,32 frente a 2,17 meses; HR, 0,71; p = 0,038). Los pacientes con recidivas resistentes también experimentaron un efecto beneficioso significativo en la SSP (2,86 frente a 1,64 meses; HR, 0,659; p = 0,037]. En cuanto a la SG, TCE y TRO, los resultados indicaron resultados favorables con la combinación de alisertib, pero las diferencias no alcanzaron significación.
Alisertib y paclitaxel tienen efectos tóxicos superpuestos. Los AA de grado ≥ 3 fueron más frecuentes con alisertib más paclitaxel (76 % frente al 51 %), al igual que los AA graves relacionados con la medicación (32 % frente al 7 %). Los AA más frecuentes con la combinación de alisertib consistieron en diarrea, cansancio, neutropenia, anemia y estomatitis. La neutropenia fue dominante entre los AA de grado ≥ 3 (38 % frente al 6 %). Todos los AA de grado ≥ 3 fueron al menos dos veces más frecuentes en el grupo experimental que en el grupo de control. La suspensión del fármaco por AA fue más frecuente en el grupo experimental (15 % frente al 6 %), al igual que las reducciones de dosis debidas a AA (38 % frente al 10 %).
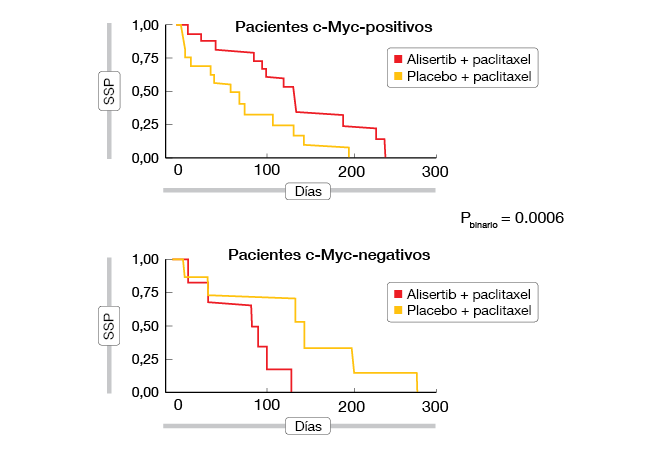
Con la expresión de la proteína c-Myc considerada como biomarcador, un análisis exploratorio especificado de antemano reveló una estrecha asociación con la SSP. La adición de alisertib tuvo un notable efecto beneficioso clínico en la SSP en comparación con paclitaxel solo en pacientes c-Myc-positivos (RRI, 0,29), mientras que en el subgrupo c-Myc-negativo se observó el patrón opuesto (HR, 11,8; Figura 1). Es necesario un estudio prospectivo para validar mejor el valor de predicción de c-Myc.
Figura 1: Effect on PFS of addition of alisertib to paclitaxel, according to c-Myc protein expression
Resultados preliminares con atezolizumab
Atezolizumab, un anticuerpo monoclonal humanizado anti-PD-L1, ha mostrado una actividad clínica prometedora y un perfil de seguridad tolerable en una serie de ensayos clínicos sobre el CPNM. Dado que el CPM se caracteriza por una gran frecuencia de mutaciones somáticas, estos tumores deberían responder al tratamiento con inhibidores de PD-1/PD-L1. Sequist y cols. presentaron los resultados obtenidos en una cohorte de EE-CPM que formaba parte de una fase 1a más extensa de un ensayo clínico en el que se investigó atezolizumab en tumores sólidos localmente avanzados o metastásicos [6]. Los cinco primeros pacientes fueron seleccionados por el PD-L1; después, la incorporación continuó con independencia del estado de expresión de PD-L1. En los análisis de la seguridad y la eficacia se evaluó a 17 pacientes.
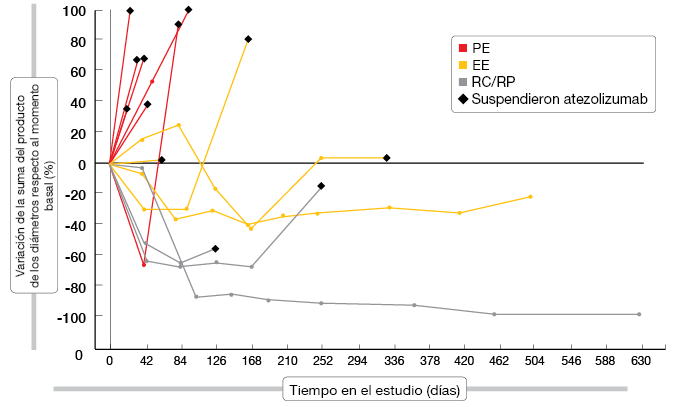
El tratamiento con atezolizumab fue en general bien tolerado, y la mayoría de los AA fueron de grado 1 o 2. Atezolizumab tuvo una actividad prometedora en monoterapia. El gráfico de araña representado en la Figura 2 muestra las respuestas obtenidas según los criterios de respuesta relacionados con la inmunidad (CRri). Se obtuvieron respuestas objetivas según los CRri en el 17,6 % de los pacientes. Se logró el control de la enfermedad en el 41,2 %. La mediana de la SSP fue de 2,9 meses según los CRri en todos los pacientes y la mediana de la SG, de 5,9 meses. En los tumores con expresión de PD-L1, la mayor expresión del distintivo génico efector del ARNm de PD-L1 y T se correspondió con una tendencia a la mejoría de la SSP (según los CRri) y de la SG. El efecto beneficioso de atezolizumab se mantuvo después de la progresión radiológica clásica. En la actualidad está en fase de incorporación de pacientes un estudio aleatorizado en fase III de atezolizumab o placebo más carboplatino/etopósido en pacientes con EE-CPM (NCT02763579).
Figura 2: Confirmed responses to atezolizumab in patients with ES-SCLC (according to irRC)
Otros nuevos medicamentos
Chu y cols. presentaron datos prometedores sobre el anticuerpo monoclonal BMS 986012, dirigido a fucosil-GMl, que es un monosialogangliósido químicamente definido que muestra una expresión limitada en los tejidos normales, pero muy alta en la superficie de las células tumorales del CPM [7]. BMS-986012 se desarrolló como un anticuerpo monoclonal de inmunoglobulina G1 totalmente humano, el primero de su clase. La actividad antitumoral de este fármaco se basa en su citotoxicidad celular dependiente de anticuerpos, su citotoxicidad dependiente del complemento y su fagocitosis celular dependiente de anticuerpos.
El estudio en fase I/II de aumento escalonado de la dosis y de ampliación de la dosis CA001-030 se inició en pacientes con CPM recidivante y resistente. Según los datos preliminares de la parte de monoterapia en fase I de este ensayo, BMS-986012 fue bien tolerado y los pacientes respondieron al tratamiento. No obstante, debido al pequeño número de pacientes en esta parte del estudio y a su heterogeneidad, todavía no se pueden extraer conclusiones firmes relativas a la eficacia de BMS-986012. La farmacocinética de BMS-986012 fue concordante con la que se podría esperar de un anticuerpo monoclonal, y no se detectaron anticuerpos antifármaco en los pacientes tratados. Está en curso la incorporación de pacientes a la parte de monoterapia en fase II de este ensayo. En otros estudios se está investigando actualmente BMS-986012 como parte de pautas combinadas con nivolumab y quimioterapia.
Por el contrario, se obtuvieron resultados negativos con roniciclib, un inhibidor oral muy potente, de pequeña molécula, de las cinasas dependientes de ciclina [8]. En un ensayo en fase II, aleatorizado, doble ciego y controlado con placebo, realizado con pacientes con EE-CPM, se comparó cisplatino/etopósido con carboplatino/etopósido como tratamiento de primera línea en combinación con roniciclib o placebo. No se observaron mejorías con la adición de roniciclib en la SSP, la SG, la TRO y el tiempo hasta la progresión. Además, la combinación no fue bien tolerada, ya que los pacientes que recibieron roniciclib mostraron una mayor incidencia de AA clínicamente importantes y de AA mortales que los del grupo de control. El estudio se suspendió después del final de la primera parte.
BIBLIOGRAFÍA
- Alvarado-Luna G, Morales-Espinosa D, Treatment for small cell lung cancer, where are we now? -a review. Trans Lung Cancer Res 2016; 5: 26-38
- Ali S et al., Small cell lung carcinoma harbors gene fusions including MYCL1 fusions which can respond to aurora kinase inhibitors. ESMO 2016, abstract 14240
- Sos ML et al., A framework for identification of actionable cancer genome dependencies in small cell lung cancer. PNAS 2012; 109: 17034-17039
- Hook et al., AACR 2010, abstract 2615
- Owonikoko TK et al., Randomized phase 2 study of the investigational aurora A kinase (AAK) inhibitor alisertinb (MLN8237) + paclitaxel versus placebo + paclitaxel as second-line therapy for small cell lung cancer (SCLC). ESMO 2016, abstract 14230
- Sequist LV et al., Clinical activity, safety and predictive biomarker results from a phase Ia atezolizumab trial in ES-SCLC. ESMO 2016, abstract 1425PD
- Chu Q et al., A phase 1/2 trial of a monoclonal antibody targeting fucosyl-GM1 in relapsed/refractory small cell lung cancer (SCLC): safety and preliminary efficacy. ESMO 2016, abstract 1427PD
- Reck M et al., Phase II study of roniciclib in combination with cisplatin/etoposide or carboplatin/etoposide as first-line therapy in patients with extensive-disease small-cell lung cancer. ESMO 2016, abstract 1426PD
More posts
Los inhibidores de ALK de la siguiente generación destacan después del fracaso de crizotinib
Los inhibidores de ALK de la siguiente generación destacan después del fracaso de c
„La actuación sobre la angiogénesis puede prolongar la vida“
„La actuación sobre la angiogénesis puede prolongar la vida“ Anders Mellemgaard,
Tratamiento dirigido al EGFR: en el momento adecuado en el paciente adecuado
Tratamiento dirigido al EGFR: en el momento adecuado en el paciente adecuado Ce
Ausencia de efecto beneficioso en fase III con selumetinib en CPNM con mutación KRAS
Ausencia de efecto beneficioso en fase III con selumetinib en CPNM con mutación KRA
CPM: las alteraciones genómicas preparan el terreno para las estrategias dirigidas
CPM: las alteraciones genómicas preparan el terreno para las estrategias dirigidas
Mutaciones inductoras poco frecuentes: resultados alentadores en pequeñas poblaciones de pacientes
Mutaciones inductoras poco frecuentes: resultados alentadores en pequeñas poblacion